ДЕЙСІ-20

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ДЕЙСІ-20
(DAISY-20)
Cклад:
діючі речовини: дезогестрел, етинілестрадіол;
1 таблетка містить дезогестрелу 0,150 мг та етинілестрадіолу 0,020 мг;
допоміжні речовини: лактоза безводна, крохмаль картопляний, вітамін Е (DL-альфа-токоферол), полівінілпіролідон,кремнію діоксид колоїдний безводний, кислота стеаринова.
Лікарська формаТаблетки.
Основні фізико-хімічні властивості: круглі двоопуклі таблетки від білого до майже білого кольору з відбитком «141» на одному боці та гладкі - з іншого.
Фармакотерапевтична група
Гормони статевих залоз та препарати, які застосовують при патології статевої сфери. Гормональні контрацептиви для системного застосування. Прогестагени та естрогени у фіксованих комбінаціях. Код АТС G03A A09.Фармакологічні властивості
Дейсі-20 - це комбінований пероральний контрацептивний засіб, що містить 0,150 мг дезогестрелу і 0,020 мг етинілестрадіолу.
Етинілестрадіол - добре відомий синтетичний естроген.
Дезогестрел - це синтетичний прогестаген. Після перорального застосування чинить потужну дію, спрямовану на інгібування овуляції, виявляє потужну прогестагенну та антиестрогенну активність, не виявляє естрогенної активності, демонструє дуже слабку андрогенну/анаболічну активність.
Дезогестрел
Абсорбція. Перорально прийнятий дезогестрел швидко і практично повністю всмоктується та перетворюється на етоногестрел. Пікова концентрація у сироватці крові досягається приблизно через 1,5 години. Біодоступність становить 62-81 %.
Розподіл. Етоногестрел зв’язується зі сироватковим альбуміном та глобуліном, що зв’язує статеві гормони (ГЗСГ). Тільки 2-4 % загальної концентрації лікарського засобу в сироватці крові наявні у вигляді вільного стероїду, а 40-70 % специфічно зв’язані з ГЗСГ. Спричинене етинілестрадіолом збільшення ГЗСГ впливає на розподіл між білками сироватки крові, тим самим спричиняє збільшення ГЗСГ-зв’язаної фракції та зменшення зв’язаної з альбуміном. Уявний об’єм розподілу дезогестрелу - 1,5 л/кг.
Метаболізм. Етоногестрел повністю метаболізується відомими шляхами метаболізму стероїдів, включаючи цитохром Р450 3А4. Швидкість виведення метаболітів із сироватки крові становить приблизно 2 мл/хв/кг. Взаємодії з етинілестрадіолом, що приймається супутньо, не виявлено.
Виведення. Рівень етоногестрелу в сироватці крові зменшується у два етапи. Кінцевий етап виведення характеризується періодом напіввиведення приблизно 30 годин. Дезогестрел та його метаболіти виводяться разом із сечею і жовчю у співвідношенні приблизно 6:4.
Стан рівноваги.Рівень ГЗСГ, що зростає втричі під дією етинілестрадіолу, впливає на фармакокінетику етоногестрелу. Після щоденного застосування рівень речовини в сироватці крові зростає приблизно у 2-3 рази, досягаючи рівноважного стану у другій половині циклу лікування.
Етинілестрадіол
Абсорбція. При пероральному застосуванні етинілестрадіол швидко і практично повністю всмоктується. Пікова сироваткова концентрація досягається протягом 1-2 годин. Абсолютна біодоступність внаслідок пресистемної кон’югації і метаболізму першого проходження становить майже 60 %.
Розподіл. Етинілестрадіол характеризується сильним, але неспецифічним зв’язуванням зі сироватковим альбуміном (приблизно 98,5 %) і спричиняє підвищення сироваткової концентрації ГЗСГ. Визначено, що уявний об’єм розподілу становить приблизно 5л/кг.Метаболізм. Пресистемне кон’югування етинілестрадіолу відбувається як у слизовій тонкого кишечнику, так і в печінці. Етинілестрадіол спочатку метаболізується шляхом ароматичного гідроксилювання з утворенням великої кількості гідроксильованих і метильованих метаболітів, які наявні як вільні метаболіти і як сполуки з глюкуронідами та сульфатами. Швидкість метаболічного кліренсу - приблизно 5 мл/хв/кг.
Виведення. Рівень етинілестрадіолу в плазмі крові зменшується у два етапи, кінцевий етап виведення характеризується періодом напіввиведення приблизно 24 години. У незміненому вигляді етинілестрадіол не виводиться; виведення метаболітів етинілестрадіолу відбувається разом із сечею і жовчю у співвідношенні 4:6. Період напіввиведення метаболітів - приблизно 1 доба.
Стан рівноваги. Рівноважні концентрації досягаються через 3-4 дні, коли рівень у сироватці крові на 30-40 % перевищує концентрацію після застосування одноразової дози.
Доклінічні дані з безпеки
Доклінічні дослідження етинілестрадіолу та дезогестрелу не виявили особливої небезпеки для людини, грунтуючись на даних традиційних досліджень токсичності повторних доз, генотоксичності, канцерогенного потенціалу та токсичного впливу на репродукцію. Однак слід пам’ятати, що статеві стероїди можуть спричиняти ріст певних гормонзалежних тканин і пухлин.
Клінічні характеристики
Показання.
Оральна контрацепція.
Рішення про призначення лікарського засобу Дейсі-20 слід приймати з урахуванням індивідуальних факторів ризику для жінки, що існують на даний момент, у тому числі факторів ризику розвитку венозної тромбоемболії (ВТЕ), а також ризику ВТЕ, пов’язаного із прийомом лікарського засобу Дейсі-20, порівняно з іншими комбінованими гормональними контрацептивами (КГК) (див. розділи «Протипоказання» та «Особливості застосування»).
Протипоказання
Комбіновані гормональні контрацептиви (КГК) не слід застосовувати за наявності хоча б одного із нижчезазначених станів. Якщо будь-який із цих станів виникає вперше під час застосування КГК, прийом лікарського засобу слід негайно припинити.
• Наявність або ризик розвитку ВТЕ:
o ВТЕ на даний час, зокрема внаслідок терапії антикоагулянтами, або в анамнезі [наприклад, тромбоз глибоких вен (ТГВ) або тромбоемболія легеневої артерії (ТЕЛА)];
o відома спадкова або набута схильність до ВТЕ, така як резистентність до активованого протеїну С (у тому числі мутація фактора V Лейдена), дефіцит антитромбіну-III, дефіцит протеїну С, дефіцит протеїну S;
o великі оперативні втручання із тривалою іммобілізацією (див. розділ «Особливості застосування»);
o високий ризик ВТЕ через наявність множинних факторів ризику (див. розділ «Особливості застосування»).
• Наявність або ризик розвитку артеріальної тромбоемболії (АТЕ):
o наявність артеріальної тромбоемболії на даний час або в анамнезі (наприклад, інфаркт міокарда) або наявність продромальних симптомів (наприклад, стенокардія);
o порушення мозкового кровообігу на даний час або в анамнезі, наявність продромальних симптомів [наприклад, транзиторна ішемічна атака (TIA)];
o відома спадкова або набута схильність до АТЕ, така як гіпергомоцистеїнемія та наявність антитіл до фосфоліпідів (антитіла до кардіоліпінів, вовчаковий антикоагулянт);
o мігрень із вогнищевими неврологічними симптомами в анамнезі;
o високий ризик АТЕ через наявність множинних факторів ризику (див. розділ «Особливості застосування») або через наявність одного серйозного фактора ризику, такого як:
- цукровий діабет із судинними ускладненнями;
- тяжка артеріальна гіпертензія;
- тяжка дисліпопротеїнемія.
• Наявність на даний час або в анамнезі панкреатиту, пов’язаного із тяжкою гіпертригліцеридемією.
• Наявність тяжкого захворювання печінки на даний час або в анамнезі, якщо показники функції печінки не повернулися в межі норми.
• Наявність пухлин печінки на даний час або в анамнезі (доброякісних або злоякісних).
• Виявлені або підозрювані естрогензалежні пухлини (див. розділ «Особливості застосування»).
• Гіперплазія ендометрія.
• Вагінальна кровотеча нез’ясованої етіології.
• Підозрювана або підтверджена вагітність.
• Підвищена чутливість до діючих речовин або до будь-якого із компонентів лікарського засобу.
Лікарський засіб Дейсі-20 протипоказаний при одночасному застосуванні лікарських засобів, що містять омбітасвір/паритапревір/ритонавір та даcабувір, або лікарських засобів, що містять глекапревір/пибрентасвір (див. розділи «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Особливості застосування»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Взаємодії між пероральними контрацептивами та іншими лікарськими засобами можуть призвести до проривної кровотечі та/або неефективності перорального контрацептиву. Про нижчезазначені взаємодії повідомляється в літературних джерелах.
Метаболізм у печінці. Можлива взаємодія з лікарськими або рослинними засобами, які індукують мікросомальні ферменти, зокрема ферменти Р450 (CYP), що призводить до підвищеного кліренсу і зменшеної концентрації у плазмі крові статевих гормонів і може знизити ефективність комбінованих пероральних контрацептивів (КПК), у тому числі лікарського засобу Дейсі-20. До таких лікарських засобів належать фенітоїн, фенобарбітал, примідон, босентан, карбамазепін, рифампіцин, рифабутин та, можливо, окскарбазепін, модафініл, топірамат, фельбамат, гризеофульвін, деякі інгібітори протеази ВІЛ (наприклад, ритонавір) і ненуклеозидні інгібітори зворотної транскриптази (наприклад, ефавіренз) та лікарські засоби, що містять рослинний компонент звіробій.
Індукція ферментів може спостерігатися через кілька днів лікування. Максимальна індукція ферментів зазвичай спостерігається протягом декількох тижнів. Після припинення застосування лікарського засобу індукція ферментів може тривати протягом приблизно 28 днів.
Жінкам, які приймають будь-який із цих лікарських або рослинних засобів, що індукують ферменти печінки, слід мати на увазі, що ефективність лікарського засобу Дейсі-20 може бути зменшена. Під час прийому лікарських засобів, що стимулюють мікросомальні ферменти, слід використовувати бар’єрний метод контрацепції як доповнення до лікарського засобу Дейсі-20 протягом усього терміну застосування лікарського засобу, що стимулює мікросомальні ферменти, та протягом 28 днів після припинення застосування такого лікарського засобу.
Якщо період прийому супутнього лікарського засобу поширюється за межі прийому активних таблеток з упаковки КПК, наступну упаковку слід починати без звичайної перерви у застосуванні таблеток. У разі тривалого лікування ферментостимулюючими засобами слід розглянути альтернативний метод контрацепції, на який не впливають лікарські засоби, що стимулюють мікросомальні ферменти.
При супутньому застосуванні з гормональними контрацептивами багато інгібіторів протеази ВІЛ (наприклад, нелфінавір) і ненуклеозидних інгібіторів зворотної транскриптази (наприклад, невірапін) та/або лікарські засоби проти вірусу гепатиту С (ВГС) (наприклад, боцепревір, телапревір) можуть збільшувати або зменшувати плазмові концентрації прогестину, в тому числі етоногестрелу, активного метаболіту дезогестрелу, або естрогенів. Чистий ефект цих змін у деяких випадках може бути клінічно значущим.
Одночасне застосування з потужними (наприклад, кетоконазол, ітраконазол, кларитроміцин) або помірними (наприклад, флуконазол, дилтіазем, еритроміцин) інгібіторами CYP3A4 може призвести до підвищення сироваткових концентрацій естрогенів або прогестинів, у тому числі етоногестрелу, активного метаболіту дезогестрелу.
Пероральні контрацептиви можуть впливати на метаболізм інших лікарських засобів. Відповідно, у плазмі крові та в тканинах концентрація таких лікарських засобів може підвищуватися (наприклад, циклоспорину) або знижуватися (наприклад, ламотриджину).
Примітка. Необхідно уважно прочитати інструкцію для медичного застосування супутнього лікарського засобу для встановлення можливих взаємодій.
Фармакодинамічні взаємодії
Одночасне застосування з лікарськими засобами, що містять омбітасвір/паритапревір/ритонавір і дасабувір разом із рибавірином або без нього, або глекапревір/пибрентасвір, може підвищити ризик підвищення рівня аланінамінотрансферази (АЛТ) (див. розділи «Протипоказання» та «Особливості застосування»). У такому разі слід замінити застосування лікарського засобу Дейсі-20 на альтернативний метод контрацепції (наприклад, контрацепція тільки прогестагеном або негормональні методи) до початку застосування такого комбінованого режиму. Поновлювати застосування лікарського засобу Дейсі-20 слід приблизно через 2 тижні після завершення комбінованого лікування.
Лабораторні аналізи. Застосування контрацептивних стероїдів може вплинути на результати певних лабораторних тестів, включаючи біохімічні показники функції печінки, нирок, щитовидної залози, надниркових залоз, рівень білків (переносників) у плазмі крові, наприклад глобуліну, що зв’язує кортикостероїди та/або ліпідну/ліпопротеїнову фракції, показники вуглеводного обміну, коагуляції та фібринолізу. Зміни зазвичай залишаються в межах норми.
Особливості застосування
Попередження
За наявності будь-яких станів або факторів ризику, зазначених нижче, слід обговорити з жінкою доцільність застосування лікарського засобу Дейсі-20.
У разі загострення або при перших проявах будь-яких із вказаних станів або факторів ризику жінкам рекомендується звернутися до лікаря та визначити необхідність припинення прийому лікарського засобу Дейсі-20.
Циркуляторні розлади
Ризик розвитку ВТЕ
Застосування будь-яких КГК підвищує ризик розвитку венозної тромбоемболії (ВТЕ) у жінок, які їх застосовують, порівняно з тими, які їх не застосовують.Лікарські засоби, що містять левоноргестрел, норгестимат або норетистерон, пов’язані з нижчим ризиком ВТЕ. Застосування інших лікарських засобів, таких як Дейсі-20, може призводити до підвищення ризику удвічі. Рішення про застосування лікарських засобів, окрім тих, що мають найнижчий ризик розвитку ВТЕ, слід приймати лише після обговорення з жінкою. Необхідно переконатися, що вона усвідомлює ризик розвитку ВТЕ, асоційований із застосуванням лікарського засобу Дейсі-20, ступінь впливу наявних у неї факторів ризику та той факт, що ризик ВТЕ є найвищим протягом першого року застосування. За деякими даними ризик ВТЕ може зростати при відновленні застосування КГК після перерви у 4 тижні або довше.
У 2 з 10 000 жінок, які не приймають КГК та не є вагітними, розвивається ВТЕ протягом року. Однак у кожної окремої жінки ризик може бути значно вищим залежно від наявних у неї факторів ризику (див. нижче).
Встановлено1, що з 10 000 жінок, які застосовують КГК, що містять дезогестрел, у 9-12 жінок розвинеться ВТЕ протягом одного року. Це порівнюється з показником 62 у жінок, які застосовують КГК, що містять левоноргестрел.
В обох випадках кількість випадків ВТЕ за рік була меншою, ніж зазвичай очікується протягом вагітності або у післяпологовому періоді.
ВТЕ може призводити до летальних наслідків у 1-2 % випадків.
Рисунок 1
Кількість випадків ВТЕ на 10 000 жінок за один рік
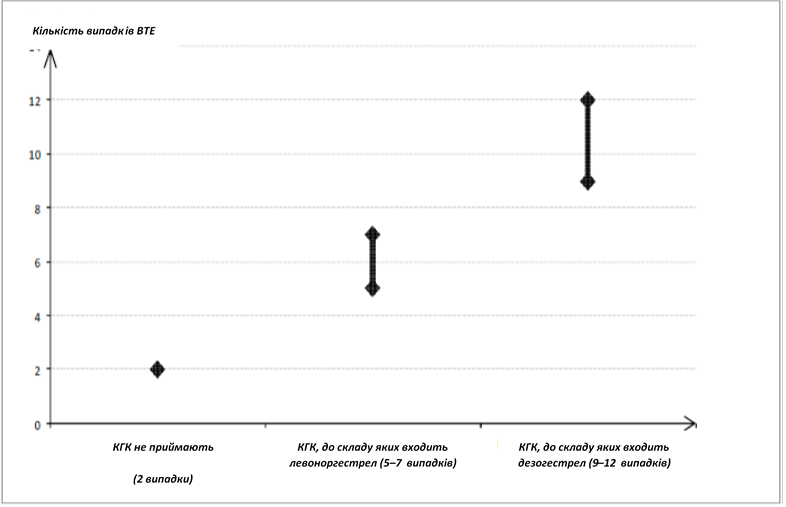
1 Ці показники отримано на основі всіх даних епідеміологічних досліджень з урахуванням відносних ризиків, пов’язаних із прийомом різних КГК, порівняно із застосуванням КГК, що містять левоноргестрел.
2 У середньому 5-7 випадків на 10 000 жінко-років на основі розрахунку відносного ризику застосування КГК, що містять левоноргестрел, порівняно з таким у жінок, які не отримують КГК (приблизно 2,3-3,6 випадку).
Надзвичайно рідко повідомлялося про виникнення тромбозу в інших кровоносних судинах, наприклад артеріях і венах печінки, нирок, мезентеріальних судинах, судинах сітківки, у жінок, які застосовують КГК.
Фактори ризику розвитку ВТЕ
Ризик розвитку венозних тромбоемболічних ускладнень у жінок, які застосовують КГК, може бути значно вищим за наявності додаткових факторів ризику, особливо множинних (див. таблицю 1).
Застосування лікарського засобу Дейсі-20 протипоказане жінкам із множинними факторами ризику, що може підвищити ризик розвитку венозного тромбозу (див. розділ «Протипоказання»). Якщо жінка має більше одного фактора ризику, зростання ризику може бути більшим, ніж сума ризиків, асоційованих із кожним окремим фактором, тому слід брати до уваги загальний ризик розвитку ВТЕ. Якщо співвідношення користь/ризик є несприятливим, не слід призначати КГК (див. розділ «Протипоказання»).
Таблиця 1
Фактори ризику розвитку ВТЕ
Фактор ризику | Примітка |
Ожиріння (індекс маси тіла перевищує 30 кг/м2) | Ризик значно підвищується при збільшенні індексу маси тіла. Особливо потребує уваги за наявності інших факторів ризику. |
Тривала іммобілізація, велике оперативне втручання, будь-яка операція на нижніх кінцівках або органах таза, нейрохірургічні втручання або обширна травма Примітка: тимчасова іммобілізація, у тому числі перельоти > 4 годин, також можуть бути фактором ризику розвитку ВТЕ, особливо у жінок з іншими факторами ризику | У таких ситуаціях рекомендується припинити застосування лікарського засобу (у разі планового оперативного втручання щонайменше за 4 тижні) та не відновлювати застосування раніше ніж через 2 тижні після повного відновлення рухової активності. З метою уникнення небажаної вагітності слід використовувати інші методи контрацепції. Необхідно розглянути доцільність антитромботичної терапії, якщо застосування лікарського засобу Дейсі-20 не було припинено попередньо. |
Сімейний анамнез (венозна тромбоемболія у когось із родичів або батьків, особливо у відносно молодому віці, наприклад до 50 років) | У разі наявності спадкової схильності перед застосуванням будь-яких КГК жінкам рекомендується порадитися зі спеціалістом. |
Інші стани, пов’язані з ВТЕ | Рак, системний червоний вовчак, гемолітичний уремічний синдром, хронічне запальне захворювання кишечнику (хвороба Крона або виразковий коліт) та серпоподібноклітинна анемія. |
Вік | Особливо у віці понад 35 років. |
Немає єдиної думки щодо можливого впливу варикозного розширення вен та поверхневого тромбофлебіту на розвиток та прогресування венозного тромбозу.
Необхідно звернути увагу на підвищений ризик розвитку тромбоемболії під час вагітності, особливо протягом 6 тижнів після пологів (інформацію див. у розділі «Застосування у період вагітності або годування груддю»).
Симптоми ВТЕ (тромбоз глибоких вен та ТЕЛА)
Жінкам слід порадити у разі появи нижчевказаних симптомів негайно звернутися до лікаря та повідомити про те, що вони застосовують КГК.
Симптомами ТГВ можуть бути: однобічний набряк ноги та/або ступні або ділянки уздовж вени на нозі; біль або підвищена чутливість у нозі, що може відчуватися тільки при стоянні або ходьбі; відчуття жару в ураженій нозі; почервоніння або зміна кольору шкіри на нозі.
Симптомами ТЕЛА можуть бути: раптова задишка нез’ясованої етіології або прискорене дихання; раптовий кашель, можливо з кров’ю; раптовий біль у грудній клітці; переднепритомний стан або запаморочення; швидке або нерегулярне серцебиття.
Деякі з цих симптомів (наприклад, задишка, кашель) є неспецифічними або можуть бути неправильно інтерпретовані як більш поширені або менш тяжкі явища (наприклад як інфекції дихальних шляхів).
Інші прояви васкулярної оклюзії можуть включати раптовий біль, набряк та незначне посиніння кінцівки.
При оклюзії судин ока початковою симптоматикою може бути нечіткість зору, що не супроводжується больовими відчуттями і яка може прогресувати до втрати зору. Інколи втрата зору розвивається майже миттєво.
Ризик розвитку АТЕ
За даними епідеміологічних досліджень, застосування будь-яких КГК пов’язане з підвищеним ризиком артеріальної тромбоемболії (інфаркт міокарда) або цереброваскулярних ускладнень (ТІА, інсульт). Артеріальні тромбоемболічні явища можуть мати летальний наслідок.
Фактори ризику розвитку АТЕ
При застосуванні КГК ризик розвитку артеріальних тромбоемболічних ускладнень або цереброваскулярних ускладнень зростає у жінок із факторами ризику (див. таблицю 2). Застосування лікарського засобу Дейсі-20 протипоказане, якщо жінки мають один серйозний або множинні фактори ризику розвитку АТЕ, які можуть підвищити ризик розвитку артеріального тромбозу (див. розділ «Протипоказання»). Якщо жінка має більше одного фактора ризику, зростання ризику може бути більшим, ніж сума ризиків, асоційованих із кожним окремим фактором, тому слід брати до уваги загальний ризик. Якщо співвідношення користь/ризик є несприятливим, не слід призначати КГК (див. розділ «Протипоказання»).
Таблиця 2
Фактори ризику розвитку АТЕ
Фактор ризику | Примітка |
Збільшення віку | Особливо у віці понад 35 років. |
Паління | Жінкам, які користуються КГК, рекомендується утримуватися від паління. Жінкам віком від 35 років, які продовжують палити, настійно рекомендується використовувати інший метод контрацепції. |
Артеріальна гіпертензія | |
Ожиріння (індекс маси тіла перевищує 30 кг/м2) | Ризик значно підвищується при збільшенні індексу маси тіла. Особливо потребує уваги за наявності у жінок інших факторів ризику. |
Сімейний анамнез (артеріальна тромбоемболія у когось із родичів або батьків, особливо у відносно молодому віці, наприклад до 50 років) | У разі наявності спадкової схильності перед застосуванням будь-яких КГК жінкам рекомендується порадитися зі спеціалістом. |
Мігрень | Зростання частоти виникнення або тяжкості перебігу мігрені під час застосування КГК (можливі продромальні стани перед розвитком цереброваскулярних ускладнень) можуть стати причиною негайного припинення прийому КГК. |
Інші стани, пов’язані з небажаними реакціями з боку судин | Цукровий діабет, гіпергомоцистеїнемія, вади клапанів серця, фібриляція передсердь, дисліпопротеїнемія та системний червоний вовчак. |
Симптоми АТЕ
Жінкам слід порадити у разі появи нижчезазначених симптомів негайно звернутися до лікаря та повідомити про те, що вони застосовують КГК.
Симптомами цереброваскулярного розладу можуть бути: раптове оніміння обличчя, слабкість або оніміння кінцівок, особливо однобічне; раптове порушення ходи, запаморочення, втрата рівноваги або координації; раптова сплутаність свідомості, порушення мовлення або розуміння; раптове погіршення зору на одне або обидва ока; раптовий, сильний або тривалий головний біль без визначеної причини; втрата свідомості або зомління зі судомами або без них.
Транзиторний характер симптомів може свідчити про ТІА.
Симптомами інфаркту міокарда можуть бути: біль, дискомфорт, відчуття тиску, тяжкості, відчуття стиснення або переповненості у грудній клітці, руці або нижче груднини; дискомфортне відчуття, що віддає у спину, щелепу, горло, руку, шлунок; відчуття переповнення шлунка, порушення травлення або ядуха; посилене потовиділення, нудота, блювання або запаморочення; надзвичайна слабкість, тривожний стан або задишка; швидке або нерегулярне серцебиття.
Пухлини
Результати деяких епідеміологічних досліджень вказують на підвищений ризик розвитку раку шийки матки при довготривалому застосуванні КПК, проте це твердження залишається суперечливим, оскільки остаточно не з’ясовано, наскільки результати досліджень враховують супутні фактори ризику, наприклад статеву поведінку та інші фактори, такі як папіломавірусна інфекція людини.
Метааналіз 54 епідеміологічних досліджень вказує на незначне підвищення відносного ризику (ВР = 1,24) розвитку раку молочної залози у жінок, які застосовують КПК. Підвищення ризику може бути обумовлене як більш ранньою діагностикою раку молочної залози у жінок, які застосовують КПК, так і біологічною дією КПК або поєднанням обох факторів. Рак молочної залози, що діагностують у жінок, які приймають КПК на даний момент або застосовували КПК в останні десять років, ймовірніше локалізуватиметься в молочній залозі, ніж діагностований рак у жінок, які ніколи не приймали КПК.
Рак молочної залози рідко виникає у жінок віком до 40 років, незалежно від того, чи застосовують вони КПК. Оскільки цей фоновий ризик зростає з віком, додаткова кількість випадків раку молочної залози у тих жінок, які застосовують КПК тепер або застосовували раніше, є малою порівняно із загальним ризиком розвитку раку молочної залози (див. рисунок 2).
Найважливішим фактором ризику раку молочної залози у тих, хто застосовує КПК, є вік, в якому жінка припиняє приймати КПК - чим старша жінка при припиненні застосування, тим вища ймовірність діагностування раку молочної залози. Тривалість застосування менш важлива, і підвищений ризик поступово зникає протягом 10 років після припинення застосування КПК настільки, що через 10 років ризик вже не перевищує звичайний.
Можливе підвищення ризику раку молочної залози слід обговорити з жінкою і зважити переваги застосування КПК з урахуванням даних про те, що КПК забезпечують значний захист від ризику розвитку деяких інших видів раку (рак яєчників та ендометрія).
Рисунок 2
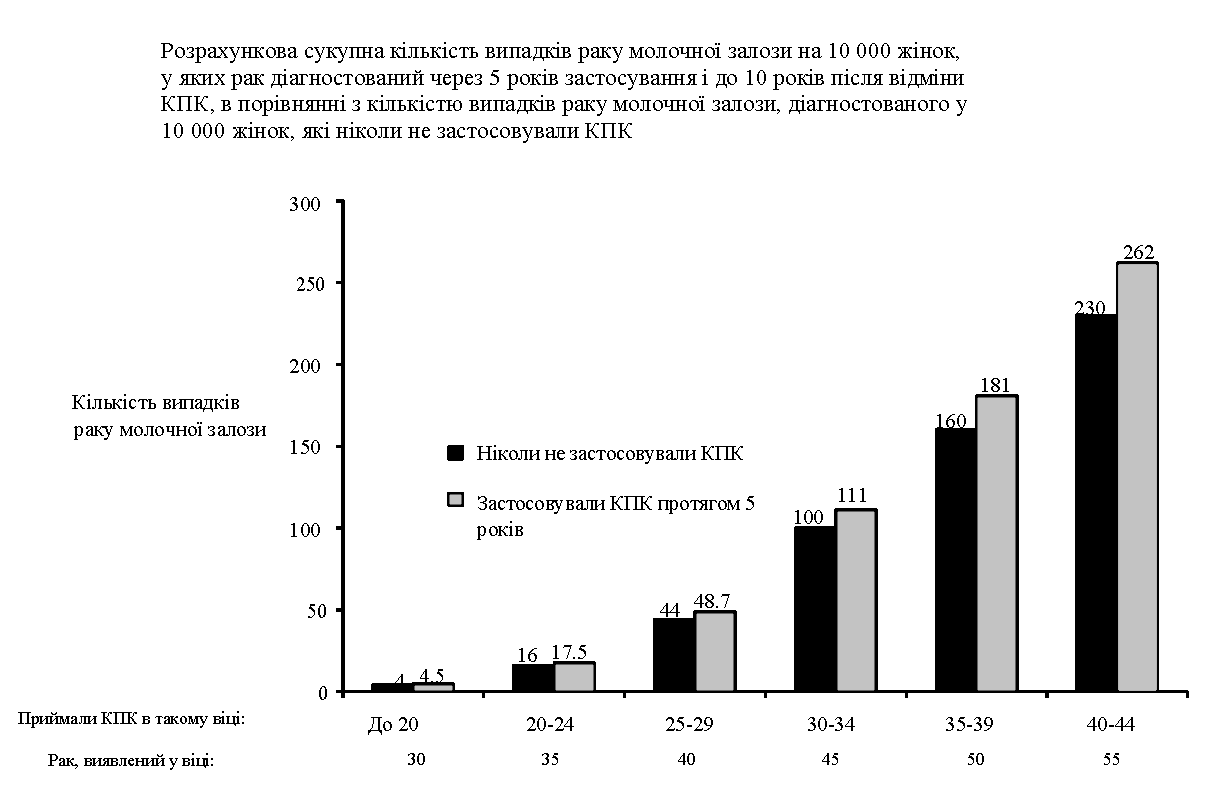
У жінок, які застосовували КПК, у рідкісних випадках повідомлялося про доброякісні і, набагато рідше, про злоякісні пухлини печінки. В окремих випадках такі пухлини призводили до небезпечних для життя внутрішньочеревних кровотеч. Таким чином, пухлини печінки слід враховувати при диференціальній діагностиці, якщо у жінок, які застосовують КГК, виникає біль у верхній частині живота, збільшення печінки або ознаки внутрішньочеревного крововиливу.
Підвищення рівня АЛТ
У процесі клінічних досліджень лікування гепатиту С лікарськими засобами, що містять омбітасвір/паритапревір/ритонавір та дасабувір із рибавірином або без нього, підвищення рівня АЛТ більше ніж у 5 разів вище верхньої межі норми (ВМН) достовірно частіше зустрічалося у жінок, які застосовували лікарські засоби, що містять етинілестрадіол, такі як КГК. Крім того, також серед пацієнтів, які отримували лікування глекапревіром/пибрентасвіром, спостерігалося підвищення рівня АЛТ у жінок, які застосовували лікарські засоби, що містять етинілестрадіол, такі як КГК (див. розділи «Протипоказання» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Інші стани
При застосуванні КГК у жінок із гіпертригліцеридемією або з її наявністю в сімейному анамнезі можливий підвищений ризик розвитку панкреатиту.
Хоча повідомлялося про незначне підвищення артеріального тиску у багатьох жінок, які приймають КГК, клінічно значущі підвищення зустрічаються рідко. Взаємозв’язок між прийомом КГК і клінічною гіпертензією не встановлено. Однак, якщо тривала клінічно значуща артеріальна гіпертензія розвивається на тлі застосування КГК, лікар має заборонити застосування КГК та лікувати артеріальну гіпертензію. Застосування КГК можна відновити у разі нормалізації артеріального тиску за допомогою антигіпертензивної терапії.
Повідомлялося про виникнення або погіршення таких станів при вагітності і при застосуванні КГК: жовтяниця та/або свербіж, пов’язані з холестазом; утворення каменів у жовчному міхурі; порфірія; системний червоний вовчак; гемолітичний уремічний синдром; хорея Сиденгама; герпес вагітних; втрата слуху, пов’язана з отосклерозом; ангіоневротичний набряк (спадковий).
Гострі або хронічні порушення функції печінки вимагають негайного припинення застосування КГК доти, доки печінкові проби не повернуться до нормальних показників. Рецидиви жовтяниці, пов’язані з холестазом, які виникали раніше під час вагітності або застосування статевих стероїдів, також вимагають припинення прийому КГК.
Хоча КГК можуть впливати на периферійну резистентність до інсуліну та толерантність до глюкози, немає необхідності змінювати схеми лікування хворих на цукровий діабет, які приймають КГК. Однак за жінками, хворими на цукровий діабет, має бути ретельний нагляд під час застосування КГК.
Хвороба Крона і виразковий коліт пов’язані з прийомом КГК.
Хлоазма може періодично виникати, особливо у жінок з наявністю в анамнезі хлоазми вагітних. Жінкам зі схильністю до хлоазми рекомендується під час застосування даного лікарського засобу уникати перебування на сонці або під дією ультрафіолетового випромінювання.
Лікарський засіб Дейсі-20 містить 58,125 мг лактози на 1 таблетку. При рідкій спадковій непереносимості галактози, лактазній недостатності Лаппа або мальабсорбції глюкози/галактози не рекомендовано застосовувати цей лікарський засіб.
Відносні протипоказання
Тяжка депресія або наявність цього стану в анамнезі. Депресивний настрій або депресія є добре відомими небажаними ефектами застосування гормональних контрацептивів (див. розділ «Побічні реакції»). Депресія може бути серйозною та є добре відомим фактором ризику, що призводить до суїцидальної поведінки та суїциду. Жінкам слід порекомендувати звернутися до лікаря у разі змін настрою та появи симптомів депресії, включаючи симптоми, що виникають невдовзі після початку лікування.
Консультації/медичне обстеження
Перед початком або відновленням прийому лікарського засобу Дейсі-20 рекомендується зібрати повний медичний анамнез (включаючи сімейний анамнез), пройти повне медичне обстеження та виключити вагітність. Необхідно виміряти артеріальний тиск та провести медичне обстеження, беручи до уваги протипоказання (див. розділ «Протипоказання») та попередження (див. розділ «Особливості застосування»). Слід звернути увагу жінки на інформацію щодо венозного та артеріального тромбозу, у тому числі на ризик, який пов’язаний із застосуванням лікарського засобу Дейсі-20, порівняно з таким при застосуванні інших КГК, щодо симптомів ВТЕ та АТЕ, відомих факторів ризику та дій, які необхідно здійснити при підозрі на тромбоз.
Пацієнткам рекомендується уважно прочитати інструкцію для медичного застосування лікарського засобу та дотримуватися рекомендацій, які містяться в ній.
Частота і характер оглядів повинні ґрунтуватися на існуючих нормах медичної практики з урахуванням індивідуальних особливостей кожної жінки.
Пацієнток потрібно попередити, що гормональні контрацептиви не захищають від зараження ВІЛ-інфекцією (СНІД) та будь-яким іншим захворюванням, що передається статевим шляхом. Якщо існує такий ризик зараження (у тому числі й під час вагітності або після пологів), рекомендується адекватне використання презерватива, окремо або разом з іншими методами контрацепції.
Зниження ефективності
Ефективність КГК може знижуватись у разі пропуску прийому таблетки (див. розділ «Спосіб застосування та дози»), розладів шлунково-кишкового тракту (див. розділ «Спосіб застосування та дози») або при одночасному застосуванні інших лікарських засобів, що знижують концентрацію в плазмі крові етоногестрелу, активного метаболіту дезогестрелу (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Погіршення контролю менструального циклу/нерегулярні кровотечі
При прийомі КГК можуть спостерігатися нерегулярні кровотечі (кровомазання або проривні кровотечі), особливо протягом перших кількох місяців. Тому оцінка будь-яких нерегулярних кровотеч може бути коректною лише після адаптаційного періоду, який становить приблизно три цикли.
Якщо нерегулярні кров’янисті виділення зберігаються або з’являються після періоду регулярних кровотеч, потрібно розглянути негормональні причини кровотеч та відповідні діагностичні заходи, включаючи обстеження з метою виключення наявності пухлин та вагітності. До діагностичних заходів можна включити кюретаж.
У деяких жінок може не настати кровотеча відміни під час перерви в прийомі лікарського засобу. У разі прийому КГК відповідно до вказівок, зазначених у розділі «Спосіб застосування та дози», вагітність малоймовірна. Проте якщо прийом КГК відбувався нерегулярно до відсутності першої кровотечі відміни або якщо кровотечі відміни відсутні протягом двох циклів, перед продовженням застосування КГК необхідно виключити вагітність.
Застосування у період вагітності або годування груддю.
Лікарський засіб протипоказаний до застосування у період вагітності. У разі виникнення вагітності під час застосування лікарського засобу Дейсі-20 його прийом необхідно припинити. Однак більшість результатів епідеміологічних досліджень не вказують на підвищення ризику появи вроджених вад у дітей, матері яких приймали КГК до вагітності, так само як і на існування тератогенної дії при ненавмисному прийомі КГК на початку вагітності.
При відновленні застосування лікарського засобу Дейсі-20 у післяпологовому періоді слід враховувати підвищення ризику розвитку ВТЕ (див. розділи «Особливості застосування» та «Спосіб застосування та дози»).
КГК можуть впливати на годування груддю, оскільки під їх впливом може зменшуватися кількість грудного молока та змінюватися його склад. Зважаючи на це, КГК не рекомендується приймати до повного припинення годування груддю. Невеликі кількості контрацептивних стероїдів та/або їх метаболітів можуть проникати у грудне молоко під час застосування КГК, але немає жодних доказів, що це негативно впливає на здоров’я немовляти.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Лікарський засіб не впливає на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Спосіб застосування та дози.
Як приймати лікарський засіб Дейсі-20
Таблетки слід приймати регулярно приблизно в один і той самий час, запиваючи при необхідності невеликою кількістю рідини, у порядку, зазначеному на блістері. Лікарський засіб приймають по 1 таблетці на добу протягом 21 дня поспіль. Прийом таблеток з кожної наступної упаковки слід розпочинати після закінчення 7-денної перерви у прийомі лікарського засобу, під час якої зазвичай настає кровотеча відміни. Зазвичай вона починається на 2-3-й день після прийому останньої таблетки і може не закінчитися до початку прийому таблеток з наступної упаковки.
Як розпочати застосування лікарського засобу Дейсі-20
Гормональні контрацептиви у попередній період (минулий місяць) не застосовувалися
Прийом таблеток із першої упаковки бажано розпочинати у перший день менструації у разі відсутності додаткових застережень щодо контрацепції.
Якщо менструація вже розпочалася (2, 3 або 4 дні тому), таблетку слід прийняти на 5-й день менструального циклу. У такому випадку протягом перших 7 днів застосування таблеток рекомендується використовувати додатковий метод контрацепції.
Якщо з початку менструації пройшло більше 5 днів, слід порекомендувати пацієнтці дочекатися наступної менструації, щоб розпочати прийом лікарського засобу Дейсі-20.
Перехід з іншого 21-денного або 22-денного гормонального контрацептиву на Дейсі-20
Слід завершити прийом всіх таблеток попередньо застосованого гормонального контрацептиву. Необхідно прийняти першу таблетку лікарського засобу Дейсі-20 наступного дня після прийому останньої таблетки попереднього КГК, не слід робити перерву у прийомі таблеток або чекати початку наступного циклу. Таблетки потрібно приймати згідно з інструкціями, наведеними вище у підрозділі «Як приймати лікарський засіб Дейсі-20». Додаткові засоби контрацепції не вимагаються. У пацієнтки може не бути кровотечі до закінчення прийому першої упаковки Дейсі-20, це не становить небезпеку, так само як і наявність кровотечі протягом прийому таблеток.
Перехід з іншого 28-денного гормонального контрацептиву на Дейсі-20
Слід розпочинати застосування лікарського засобу Дейсі-20 після останнього застосуванняактивної таблетки (останньої таблетки, що містить активні субстанції) попереднього КГК (наприклад, після прийому 21 або 22 таблеток). Слід прийняти першу таблетку лікарського засобу Дейсі-20 наступного дня після прийому останньої таблетки попереднього КГК, не слід робити перерву у прийомі таблеток або чекати початку наступного циклу. Лікарський засіб приймають по 1 таблетці на добу у той самий час, без перерви протягом 21 дня, з наступною 7-денною перервою. Прийом таблеток з кожної наступної упаковки слід розпочинати після закінчення 7-денної перерви у прийомі лікарського засобу. Додаткові засоби контрацепції не вимагаються. Таблетки, що залишилися від попередньо застосованого КГК, слід утилізувати.
У пацієнтки може не бути кровотечі до закінчення прийому першої упаковки Дейсі-20, це не становить небезпеку, так само як і наявність кровотечі протягом прийому таблеток.
Перехід з методу, що базується на застосуванні лише прогестагену (таблетки прогестагену або «міні-пілі»), на Дейсі-20
Першу таблетку лікарського засобу Дейсі-20 слід прийняти у перший день менструального циклу, навіть якщо пацієнтка вже прийняла «міні-пілі» у цей день. Лікарський засіб приймають по 1 таблетці на добу у той самий час, без перерви протягом 21 дня, з наступною 7-денною перервою. Прийом таблеток з кожної наступної упаковки слід розпочинати після закінчення 7-денної перерви у прийомі лікарського засобу. Додаткові засоби контрацепції не вимагаються. Таблетки прогестагену або «міні-пілі», що залишилися, слід утилізувати.
Якщо пацієнтка приймає «міні-пілі», вона не завжди може мати кровотечу, особливо якщо вона годує груддю. Першу таблетку Дейсі-20 слід прийняти наступного дня після припинення прийому «міні-пілі». Всі таблетки «міні-пілі», що залишилися в упаковці, слід утилізувати. Протягом перших 7 днів застосування таблеток рекомендується використовувати додатковий метод контрацепції.
Перехід з методу, що базується на застосуванні лише прогестагену (ін’єкція або імплантат), або з внутрішньоматкової системи (ВМС), що вивільняє прогестаген
Можна розпочати прийом лікарського засобу Дейсі-20 у будь-який день після припинення використання методу, що базується на застосуванні лише прогестагену (у разі застосування імплантату або ВМС - у день їх видалення, у випадку ін’єкції - замість наступної ін’єкції). Рекомендується використовувати додатковий метод контрацепції протягом перших 7 днів прийому лікарського засобу.
Застосування після пологів
Жінкам, які не годують груддю, слід розпочинати прийом лікарського засобу Дейсі-20 з 21-го дня після пологів. У такому випадку додаткові засоби контрацепції не вимагаються. Проте якщо статевий акт уже відбувся, то слід дочекатися настання першої менструації.
Якщо застосування лікарського засобу розпочалося пізніше 21-го дня після пологів, рекомендується використовувати додатковий метод контрацепції протягом перших 7 днів застосування таблеток.
Примітка: жінкам, які годують груддю, слід рекомендувати не застосовувати КГК, оскільки вони можуть знизити кількість грудного молока, а замість них приймати препарати, що містять тільки прогестаген. Після викидня або аборту слід негайно розпочати застосування лікарського засобу, у такому разі додаткові засоби контрацепції не вимагаються.
Додаткові заходи контрацепції
Якщо вимагаються додаткові заходи контрацепції, слід рекомендувати пацієнтці не мати статевих контактів або застосовувати ковпачок зі сперміцидом, або порадити партнеру використовувати презерватив.
Методи, що засновані на розрахунку циклу, використовувати не слід, оскільки таблетки змінюють звичайний цикл порівняно з природним менструальним циклом, наприклад зміни температури та слизової оболонки шийки матки.
Як відтермінувати настання кровотечі відміни
Щоб затримати кровотечу відміни, слід продовжувати приймати таблетки лікарського засобу Дейсі-20 із нової упаковки і не робити перерви у застосуванні лікарського засобу. Таблетки приймають як звичайно. При цьому можуть спостерігатися незначне кровомазання або проривна кровотеча, але це не впливає на контрацепцію, якщо прийом таблеток не пропущено. Після планового 7-денного періоду без таблеток розпочинають прийом наступної упаковки таблеток Дейсі-20, незалежно від того, закінчилася менструація чи ні.
Що робити у випадку пропуску прийому таблетки
Надійність препарату Дейсі-20 може бути знижена при пропуску прийому таблеток.
Якщо запізнення у прийомі таблетки не перевищує 12 годин, додаткові перестороги не вимагаються, наступну таблетку необхідно прийняти у звичний час.
Якщо запізнення з прийомом однієї або більше таблеток перевищує 12 годин, контрацептивний захист може знизитися. Слід прийняти останню пропущену таблетку якомога швидше, навіть якщо доведеться прийняти дві таблетки одночасно. Після цього продовжують приймати таблетки у звичний час. Крім того, протягом наступних 7 днів слід використовувати додатковий метод контрацепції, це називається «правилом 7 днів». Цим правилом користуються, якщо запізнення з прийомом таблетки перевищує 12 годин, якщо у пацієнтки блювання або діарея тривають більше 12 годин або якщо пацієнтка приймає будь-який із лікарських засобів, що описаний у розділі «Взаємодія з іншими лікарськими засобами та інші види взаємодій». Однак, якщо 7-денний період виходить за межі прийому поточної упаковки, слід розпочати прийом таблеток з наступної упаковки відразу після закінчення попередньої, тобто без перерви. Це попередить тривалу перерву у прийомі таблеток, яка може збільшити ризик вивільнення яйцеклітин яєчниками та, таким чином, зменшити протизаплідну здатність препарату. У пацієнтки може не бути менструації до закінчення прийому другої упаковки, але це не становить загрозу, так само як і наявність кровотечі протягом прийому таблеток.
Рекомендації у разі блювання та тяжкої діареї
У разі тяжких розладів з боку шлунково-кишкового тракту можливе неповне всмоктування лікарського засобу, у такому разі слід застосовувати додаткові засоби контрацепції. Діарея не впливає на всмоктування стероїдів, окрім надзвичайно тяжкої діареї. Якщо блювання трапилося протягом 3-4 годин після застосування таблетки або у разі тяжкої та тривалої діареї, слід дотримуватися рекомендацій щодо пропущених таблеток (див. підрозділ «Що робити у випадку пропуску прийому таблетки» вище). Якщо жінка не хоче змінювати свою звичну схему застосування таблеток, вона повинна прийняти додаткову таблетку (таблетки) з іншої упаковки.
Діти.
Немає клінічних даних щодо ефективності та безпеки застосування лікарського засобу дітям (віком до 18 років).
Передозування.
Про серйозні ускладнення при передозуванні не повідомлялося. При передозуванні можуть виникати такі симптоми: нудота, блювання, незначна вагінальна кровотеча. Антидотів не існує, лікування передозування повинно бути симптоматичним.
Побічні реакції.
Опис окремих побічних реакцій
На початку застосування КПК спостерігалися зміни у характері вагінальної кровотечі, особливо в перші місяці прийому, що також включали зміни частоти кровотечі (відсутність, менш часто, більш часто або тривалий час), інтенсивності (зменшення або збільшення) або тривалості вагінальної кровотечі.
При застосуванні КГК спостерігався підвищений ризик артеріального та венозного тромбоемболізму, включаючи інфаркт міокарда, інсульт, ТІА, тромбоз вен та емболію легеневих судин; більш детальну інформацію див. у розділі «Особливості застосування».
Можливі відносні побічні реакції1, про які повідомлялося при застосуванні лікарського засобу або КГК, зазначено у таблиці 3. Всі побічні реакції подано за класами систем органів та частотою: часто (≥ 1/100), нечасто (≥ 1/1000, < 1/100) та рідко (< 1/1000).
Таблиця 3
Клас системи органів | Часто | Нечасто | Рідко |
З боку імунної системи | Підвищена чутливість | ||
З боку метаболізму та харчування | Затримка рідини | ||
З боку психіки | Депресивний настрій, зміна настрою | Зниження лібідо | Підвищення лібідо |
З боку нервової системи | Головний біль | Мігрень | |
З боку органів зору | Непереносимість контактних лінз | ||
З боку судин | Венозний тромбоемболізм2, артеріальний тромбоемболізм2 | ||
З боку травного тракту | Нудота, біль у животі | Діарея, блювання | |
З боку шкіри та підшкірних тканин | Висипання, кропив’янка | Вузликова еритема, мультиформна еритема | |
З боку репродуктивної системи та молочних залоз | Біль у молочних залозах, болісність молочних залоз | Гіпертрофія молочних залоз | Виділення з піхви, виділення з молочних залоз |
Дослідження | Збільшення маси тіла | Зменшення маси тіла |
1Найбільш прийнятний термін MedDRA (версія 11) для опису певної небажаної реакції. Синоніми або подібні стани не перераховані, але їх також потрібно враховувати.
2Частота спостережень у когортних дослідженнях від ≥ 1/10 000 до 1/1000 жінок-років.
Якщо Вам стало відомо про будь-які побічні реакції, пов’язані із застосуванням продукту компанії, у т. ч. застосуванням у період вагітності або годування груддю, або про такі, що виникли у результаті медичних помилок, неправильного застосування, зловживання, передозування, взаємодії з іншими лікарськими засобами чи взаємодії лікарського засобу та їжі, застосування не за показаннями чи внаслідок впливу, пов’язаного з професійною та непрофесійною діяльністю, підозрюваною передачею інфекційного агента чи відсутністю ефективності, а також асоційовані з дефектом якості, необхідно повідомити про це особі, відповідальній за фармаконагляд, за електронною адресою infosafety.cis@viatris.com
Повідомлення про підозрювані побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua
Термін придатності.
2 роки.
Умови зберігання.
Зберігати при температурі не вище 25 °С у захищеному від світла місці. Зберігати у недоступному для дітей місці.
Упаковка.
По 21 таблетці у блістері; по 1 блістеру у ламінованому пакеті; по 1, 3 або 6 ламінованих пакетів у пачці з картону.
Категорія відпуску.За рецептом.
Виробник.
Майлан Лабораторіз Лімітед/Mylan Laboratories Limited.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Плот № 20/21, Фармез, Фармасьютикал Спешл Економік Зон, Сархедж-Бавла НХ №-8А, Віледж Матода, Ахмедабад, 382213, Індія/Plot nr. 20/21, Pharmez, Pharmaceutical Special Economic Zone, Sarkhej-Bavla NH No-8A, Village Matoda, Ahmedabad, 382213, India.
Дата останнього перегляду.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО

