УМАН КОМПЛЕКС 500 МО/20МЛ
 від 2 °С до 8 °С. Не заморожувати
від 2 °С до 8 °С. Не заморожувати 

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
УМАН КОМПЛЕКС 500 МО/20 мл
Склад:
1 флакон містить:
діючі речовини:протромбіновий комплекс людини:
фактор коагуляції крові людини IX - 500 МО;
фактор коагуляції крові людини IІ - 500 МО;
фактор коагуляції крові людини X - 400 МО;
допоміжні речовини: натрію хлорид, натрію цитрат, гліцин, гепарин, антитромбін ІІІ;
розчинник: вода для ін’єкцій - 20 мл.
Фактор ІХ титрується згідно з міжнародним стандартом.
Вміст загального білка у флаконі становить ≤ 300 мг. Специфічна активність препарату становить більше ніж 0,6 МО/мг, виражена як активність фактора ІХ.
Допоміжні речовини з відомим ефектом: лікарський засіб містить до 92 мг натрію на флакон (20 мл).
Лікарська формаПорошок та розчинник для розчину для інфузій.
Основні фізико-хімічні властивості:препарат являє собою білий або ледь забарвлений дуже гігроскопічний порошок або крихку тверду речовину.
Фармакотерапевтична група
Протигеморагічні засоби. Комбінація факторів коагуляції крові ІХ, ІІ, VII і Х. Код АТС В02В D01.Фармакологічні властивості
Фактори коагуляції ІІ, VII, ІХ і Х, які синтезуються в печінці за допомогою вітаміну К, зазвичай називають протромбіновим комплексом.
Фактор VII - зимоген активної серинової протеази фактора VIIа, за допомогою якого ініціюється коагуляція крові зовнішнім шляхом. Комплекс тканинний фактор - фактор VIIа активує фактори коагуляції Х та ІХ, внаслідок чого формуються фактори ІХа та Ха. З подальшою активацією коагуляційного каскаду активується протромбін (фактор ІІ) та трансформується в тромбін. Під дією тромбіну фібриноген перетворюється у фібрин, в результаті чого формується згусток. Нормальне утворення тромбіну є також дуже важливим для тромбоцитарної функції як складової частини первинного гемостазу.
Окрема тяжка недостатність фактора VII призводить до зменшення формування тромбіну і схильності до кровотечі через ослаблену функцію формування фібрину та ослаблений первинний гемостаз. Окрема недостатність фактора ІХ є однією з класичних гемофілій (гемофілія В). Окрема недостатність фактора ІІ або фактора Х існує дуже рідко, але у тяжкій формі спричиняє кровотечі, подібні до кровотеч при класичній гемофілії.
Набута недостатність залежних від вітаміну К факторів коагуляції спостерігається при лікуванні антагоністами вітаміну К. Якщо недостатність стає серйозною, це призводить до схильності до тяжкої кровотечі, переважно до такої, як ретроперитонеальна або церебральна, ніж до кровотечі в м’язах та суглобах. Тяжка печінкова недостатність також призводить до помітно знижених рівнів залежних від вітаміну К факторів коагуляції та схильності до клінічної кровотечі, яка, однак, є часто складною через одночасну безперервну слабко виражену інтраваскулярну коагуляцію, низькі рівні тромбоцитів, недостатність інгібіторів коагуляції та порушення фібринолізу.
Введення протромбінового комплексу людини забезпечує підвищення рівнів залежних від вітаміну К факторів коагуляції у плазмі, а також може певний час коригувати порушення коагуляції у пацієнтів з недостатністю одного або декількох факторів.
Фактор коагуляції | Період напіввиведення |
Фактор ІІ | 40-60 годин |
Фактор ІХ | 16-30 годин |
Фактор Х | 30-60 годин |
Доклінічні дані з безпеки
Концентрат факторів протромбінового комплексу є природною складовою плазми людини і діє подібно до ендогенних факторів.
Дослідження токсичності разової дози не є значущими, оскільки високі дози спричиняють гіперволемію.
Дослідження токсичності при повторних (багаторазових) введеннях у тварин не є можливими через інтерференцію антитіл, що утворюються до гетерологічного білка.
Навіть дози, що значно перевищують рекомендовані для людини на 1 кг маси тіла, не демонструють будь-якої токсичної дії у піддослідних тварин.
Оскільки за результатами клінічного досвіду застосування факторів протромбінового комплексу людини не підтверджена їхня канцерогенна та мутагенна дії, проведення експериментальних досліджень, зокрема за участю гетерологічних видів, не вважається необхідним.
Клінічні характеристики
Показання.
- Для лікування кровотеч і періопераційної профілактики кровотеч при набутій недостатності факторів коагуляції протромбінового комплексу, наприклад, недостатність, спричинена лікуванням антагоністами вітаміну К або передозуванням антагоністами вітаміну К, коли необхідна швидка корекція недостатності.
- Для лікування кровотеч і періопераційної профілактики при вродженій недостатності будь-якого залежного від вітаміну К фактора коагуляції, коли відсутній препарат очищеного специфічного фактора коагуляції.
Протипоказання.
Гіперчутливість до діючої речовини або до будь-якої з допоміжних речовин, що наведені у розділі «Склад».
Відома алергія на гепарин або індукована гепарином тромбоцитопенія в анамнезі.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Препарати протромбінового комплексу людини нейтралізують дію антагоністів вітаміну К.
Взаємодія з іншими лікарськими засобами невідома.
Вплив на біологічне дослідження
При проведенні досліджень на тромбоутворення, що є чутливими до гепарину у пацієнтів, які отримують високі дози протромбінового комплексу людини, слід враховувати гепарин як складову препарату, що вводиться.
Діти
Специфічні дані щодо дітей відсутні.
Особливості застосування.
Простежуваність
Нагально рекомендується записувати назву і номер серії препарату щоразу при введенні пацієнту лікарського засобу УМАН КОМПЛЕКС 500 МО/20 мл для простежуваності зв’язку між пацієнтом і конкретною серією препарату.
Лікування розладів коагуляції слід проводити спеціалістам із відповідним досвідом.
Пацієнтам із набутою недостатністю залежних від вітаміну К факторів коагуляції (наприклад, спричиненою лікуванням антагоністами вітаміну К) препарат УМАН КОМПЛЕКС 500 МО/20 мл слід застосовувати тільки у разі необхідності швидкої корекції рівнів протромбінового комплексу, наприклад, при значних кровотечах або невідкладних хірургічних втручаннях. У інших випадках зазвичай достатньо знизити дозу антагоніста вітаміну К та/або ввести вітамін К.
Пацієнти, які отримують антагоністи вітаміну К, можуть мати прихований гіперкоагуляційний стан і введення протромбінового комплексу людини може його загострити.
При вродженій недостатності будь-якого залежного від вітаміну К фактора рекомендується застосовувати препарат специфічного фактора коагуляції за наявності.
У разі розвитку алергічної реакції або реакції анафілактичного типу ін’єкцію/інфузію лікарського засобу слід негайно припинити.
У разі розвитку шоку необхідно вжити стандартних медичних протишокових заходів.
Важлива інформація щодо допоміжних речовин лікарського засобу УМАН КОМПЛЕКС 500 МО/20 мл
Цей лікарський засіб містить до 92 мг натрію у флаконі (20 мл), що складає 4,6 % рекомендованої ВООЗ максимальної щоденної дози натрію для дорослих, яка становить 2 г.
Вірусна безпека
Стандартні заходи для попередження інфекцій внаслідок застосування лікарських засобів, виготовлених з крові або плазми людини, включають відбір донорів, скринінг (перевірку) окремих порцій донорської плазми та пулів плазми на специфічні маркери інфекцій та проведення ефективних заходів для інактивації/видалення вірусів під час виробництва.
Незважаючи на це, при введенні лікарських засобів, виготовлених з крові або плазми людини, не можна цілком виключити можливість передачі інфекційних агентів. Це також стосується невідомих або нових вірусів та інших патогенів.
Заходи, яких вживають, вважаються ефективними щодо оболонкових вірусів, таких як вірус імунодефіциту людини (ВІЛ), вірус гепатиту В (ВГВ) і вірус гепатиту С (ВГС), а також щодо необолонкових вірусів, таких як вірус гепатиту А (ВГА). Заходи, яких вживають, можуть мати обмежену ефективність щодо необолонкових вірусів, таких як парвовірус В19. Інфікування парвовірусом В19 може бути серйозним для вагітних жінок (інфікування плода), а також для осіб з імунодефіцитом або підвищеним еритропоезом (наприклад, при гемолітичній анемії).
Слід розглянути питання проведення відповідної вакцинації (від гепатиту A та B) для пацієнтів, що регулярно отримують протромбіновий комплекс людини.
Застосування протромбінового комплексу людини пов’язане з підвищенням ризику дисемінованої інтраваскулярної коагуляції, тромбоемболічних ускладнень та інфаркту міокарда. Пацієнти, які отримують протромбіновий комплекс людини, повинні бути ретельно оглянуті на наявність симптомів дисемінованої інтраваскулярної коагуляції або тромбозів.
Через потенційний ризик розвитку тромбоемболічних ускладнень при введенні цього лікарського засобу слід ретельно спостерігати із проведенням необхідних біологічних досліджень за станом пацієнтів з коронарною хворобою серця або інфарктом міокарда в анамнезі, із захворюванням печінки, за станом постопераційних пацієнтів, новонароджених або пацієнтів з ризиком розвитку тромбоемболічних випадків або дисемінованої інтраваскулярної коагуляції для виявлення перших ознак тромботичних ускладнень та коагулопатії споживання. У кожному з цих випадків потенційна користь від лікування препаратом УМАН КОМПЛЕКС 500 МО/20 мл повинна переважати над ризиком зазначених ускладнень.
Дані щодо застосування препарату УМАН КОМПЛЕКС 500 МО/20 мл у разі перинатальної кровотечі через недостатність вітаміну К у новонароджених відсутні.
Діти
Специфічні дані щодо дітей відсутні.
Застосування у період вагітності або годування груддю.
Безпека застосування протромбінового комплексу людини у період вагітності не встановлена у контрольованих клінічних дослідженнях.
Дослідження на тваринах не прийнятні для оцінки безпеки препарату для репродуктивної функції, ембріонального/фетального розвитку, перебігу вагітності і пери- та постнатального розвитку людини.
Тому протромбіновий комплекс людини можна застосовувати під час вагітності та лактації тільки у разі безсумнівних показань.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Дослідження впливу на здатність керувати автотранспортом та працювати з іншими механізмами не проводилися.
Спосіб застосування та дози.
Дозування
Нижче наведено лише загальні рекомендації щодо дозування. Лікування слід розпочинати під наглядом спеціаліста з досвідом лікування розладів коагуляції. Дозування та тривалість замісної терапії залежать від тяжкості розладу, місця та ступеня кровотечі, а також від клінічного стану пацієнта.
Кількість та частота введення повинні бути розраховані індивідуально для кожного пацієнта.
Інтервали дозування повинні бути адаптовані до різних періодів напіввиведення різних факторів коагуляції протромбінового комплексу (див. розділ «Фармакокінетика»). Індивідуальні вимоги щодо дозування можуть визначатися тільки на підставі регулярних визначень індивідуальних рівнів досліджуваних факторів коагуляції в плазмі або на підставі глобальних тестів рівнів протромбінового комплексу (протромбіновий час, міжнародне нормалізоване відношення (INR)), а також постійного/безперервного моніторингу клінічного стану пацієнта.
У разі обширних хірургічних втручань важливо проводити точний моніторинг замісної терапії за допомогою аналізів крові на гемостаз (визначення специфічного фактора коагуляції та/або глобальні тести рівнів протромбінового комплексу).
Кровотечі та періопераційна профілактика кровотеч під час лікування антагоністами вітаміну К
Доза залежатиме від початкового (перед лікуванням) та цільового значення міжнародного нормалізованого відношення (INR). Корекція порушень гемостазу, спричинених антагоністами вітаміну К, зберігається упродовж приблизно 6-8 годин. Однак вплив вітаміну К при одночасному застосуванні зазвичай досягається протягом 4-6 годин. Таким чином, після введення вітаміну К повторне лікування протромбіновим комплексом людини зазвичай не потрібне.
Оскільки ці рекомендації емпіричні, а також у зв’язку з тим, що одужання та тривалість ефекту можуть варіювати, моніторинг INR під час лікування є обов’язковим.
Кровотечі та періопераційна профілактика при вродженій недостатності будь-якого залежного від вітаміну К фактора коагуляції, коли відсутній препарат специфічного фактора коагуляції
Необхідна доза для лікування розраховується на підставі емпіричних даних, що приблизно 1 МО фактора ІХ на 1 кг маси тіла збільшує активність фактора ІХ у плазмі на 0,01 МО/мл; 1 МО фактора ІІ або фактора Х на 1 кг маси тіла збільшує активність фактора ІІ або фактора Х у плазмі на 0,02 та 0,017 МО/мл відповідно.
Доза введеного специфічного фактора виражається в міжнародних одиницях (МО) відповідно до діючого стандарту ВООЗ для кожного фактора. Активність специфічного фактора коагуляції у плазмі виражається у відсотках (по відношенню до нормальної плазми) або у міжнародних одиницях (по відношенню до міжнародного стандарту для специфічного фактора коагуляції).
Одна міжнародна одиниця (МО) активності фактора коагуляції еквівалентна кількості фактора у 1 мл нормальної плазми людини.
Наприклад, розрахунок необхідної дози фактора Х базується на емпіричних даних, що 1 міжнародна одиниця (МО) фактора Х на 1 кг маси тіла підвищує активність фактора Х у плазмі на 0,017 МО/мл.
Необхідна доза розраховується за такою формулою:
Необхідна кількість одиниць (МО) = маса тіла (кг)× бажане збільшення фактора Х (МО/мл)× 60,
де
60 (мл/кг) - зворотна величина передбачуваного одужання (нормалізації).
Якщо індивідуальна нормалізація відома, цю величину використовують для розрахунку.
Спосіб введення
Розчиняють препарат, як це описано нижче. Препарат УМАН КОМПЛЕКС 500 МО/20 мл потрібно вводити внутрішньовенно шляхом ін’єкції або повільної інфузії.
Рекомендовано вводити не більше 100 МО/кг маси тіла на день.
Відновлення порошку розчинником
1. Флакон з порошком та флакон з розчинником слід довести до кімнатної температури.
2. Кімнатну температуру слід підтримувати протягом всього процесу відновлення (розчинення) (максимум 10 хвилин).
3. Зніміть захисні ковпачки з флакона з порошком та флакона з розчинником.
4. Обробіть етиловим спиртом поверхні пробок обох флаконів.
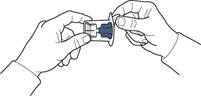
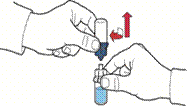
5. Відкрийте упаковку пристрою, як зазначено на рис. А, не торкаючись при цьому внутрішньої частини упаковки (рис. А).
6. Не виймайте пристрій з упаковки.
7. Переверніть упаковку з пристроєм та проколіть пластиковим шипом пристрою пробку флакона з розчинником, щоб синя частина пристрою з’єдналася із флаконом з розчинником (рис. Б).
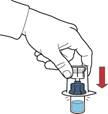
8. Утримуючи за край упаковку пристрою, видаліть її, не торкаючись при цьому самого пристрою (рис. В).
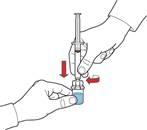
9. Переконайтеся, що флакон з порошком поміщено на безпечну поверхню; переверніть флакон з розчинником із під’єднаним пристроєм, щоб флакон з розчинником був над пристроєм; натисніть на прозорий адаптер на пробці флакона з порошком, щоб пластиковий шип проколов пробку флакона з порошком; розчинник автоматично почне перетікати до флакона з порошком (рис. Г).
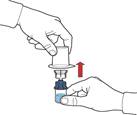
10. Після перенесення розчинника відкрутіть синю частину системи, до якої під’єднаний флакон розчинника, та видаліть її (рис. Д).
11. Обережно струсіть флакон до повного розчинення порошку. Не струшуйте флакон енергійно, щоб уникнути піноутворення (рис. Е).
Для уникнення зменшення активності лікарського засобу переконайтеся, що порошок повністю розчинився у флаконі.
Рис.А | Рис.Б |
|
|
Рис. В | Рис. Г |
|
|
Рис. Д | Рис. Е |
|
|
Введення розчину
Утворений розчин має бути прозорим або ледь опалесцентним.
Перед введенням розчин слід візуально перевірити на наявність часток або зміну кольору. Не використовувати розчин при помутнінні або при наявності у ньому осаду.
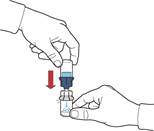
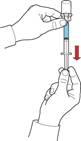
1. Наберіть у шприц повітря, відтягнувши поршень; під’єднайте шприц до пристрою та введіть повітря з шприца у флакон з відновленим розчином (рис. Є).
2. Утримуючи поршень, переверніть систему, щоб флакон з відновленим розчином знаходився над пристроєм. Відтягуючи повільно поршень, наберіть концентрат у шприц (рис. Ж).
3. Від’єднайте шприц, обертаючи його проти годинникової стрілки.
4. Візуально перевірте розчин у шприці, який повинен бути прозорим або ледь опалесцентним та не повинен містити часток.
5. Під’єднайте до шприца голку-метелик та введіть препарат внутрішньовенно.
Рис.Є | Рис.Ж |
|
|
Після відкриття вміст флакона має бути використаний негайно.
Відновлений розчин, наповнений у шприц, має бути використаний негайно.
Невикористаний лікарський засіб або відходи, які залишаються після його використання, слід знищити відповідно до місцевих вимог.
Діти.
Безпека та ефективність застосування препарату УМАН КОМПЛЕКС 500 МО/20 мл дітям не встановлені.
Передозування.
Введення високих доз препаратів протромбінового комплексу людини було пов’язане з випадками інфаркту міокарда, дисемінованої інтраваскулярної коагуляції, венозних тромбозів і тромбоемболії легенів. Таким чином, у разі передозування ризик розвитку тромбоемболічних ускладнень або дисемінованої інтраваскулярної коагуляції посилюється.
Діти
Специфічні дані щодо дітей відсутні.
Побічні реакції.
Короткий опис профілю безпеки
Рідко спостерігалися алергічні реакції або реакції анафілактичного типу.
Замісна терапія протромбіновим комплексом людини може зрідка призводити до формування циркулюючих антитіл, що інгібують один або кілька факторів протромбінового комплексу людини. Якщо такі інгібітори виникають, це проявлятиметься у вигляді слабкої клінічної відповіді.
У рідкісних випадках спостерігається лихоманка.
Існує потенційний ризик розвитку тромбоемболічних реакцій після введення протромбінового комплексу людини, таких як емболія та тромбоз, внутрішньосудинна дисемінована коагуляція та інфаркт міокарда (див. розділ «Особливості застосування»).
Інформацію з безпеки щодо трансмісивних агентів див. у розділі «Особливості застосування».
Перелік побічних реакцій у вигляді таблиці
Побічні ефекти, які можуть виникати при застосуванні протромбінового комплексу людини, представлено у таблиці нижче відповідно до класифікації систем органів за MedDRA [Медичний словник для регуляторної діяльності] та термінів переважного використання.
Частота оцінювалася за такими умовними категоріями: дуже часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); рідко (≥1/10000 до <1/1000); дуже рідко (<1/10000), частота невідома (неможливо оцінити за наявними даними).
Клас системи органів за MedDRA | Побічні реакції (MedDRA, термін переважного використання) | Частота |
Розлади з боку імунної системи | Гіперчутливість | Невідома |
Анафілактичні реакції | Невідома | |
Судинні розлади | Емболія | Невідома |
Тромбози | Невідома | |
Дисемінована інтраваскулярна коагуляція | Невідома | |
Інфаркт міокарда | Невідома | |
Загальні розлади та реакції у місці введення | Пірексія | Невідома |
Діагностичні дослідження | Інгібуючі антитіла | Невідома |
Діти
Специфічні дані щодо дітей відсутні.
Повідомлення про підозрювані побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності.
3 роки.
Умови зберігання.
Зберігати у холодильнику при температурі від 2 до 8 ºС.
Зберігати флакон у оригінальній картонній коробці з метою захисту від світла.
Не заморожувати.
Несумісність.
Концентрат протромбінового комплексу людини не можна змішувати з іншими лікарськими засобами.
Слід використовувати тільки набір для ін’єкцій/інфузій, що додається, оскільки невдале лікування може бути наслідком адсорбції факторів коагуляції на внутрішніх поверхнях деяких наборів для ін’єкцій/інфузій.
Упаковка.
1 флакон з порошком (500 МО) разом з 1 флаконом з розчинником (вода для ін’єкцій, 20 мл) та набором для розчинення і введення у картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
КЕДРІОН С.П.А.
Місцезнаходження виробника та адреса місця провадження його діяльності.
ВІА ПРОВІНСІАЛЕ (лок. БОЛОГНАНА) - 55027 ГАЛЛІКАНО (ЛУ), Італія.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО