ЕВРІСДІ

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
Еврісді
(Evrysdi®)
Склад:
діюча речовина:рисдиплам (risdiplam);
1 пляшка містить 60 мг рисдипламу;
1 мл відновленого розчину містить 0,75 мг рисдипламу;
допоміжні речовини: маніт (E 421); ізомальт (Е 953); полуничний ароматизатор; кислота винна; натрію бензоат (E 211); поліетиленгліколь 6000; сахаралоза; кислота аскорбінова; динатрію едетат, дигідрат.
Лікарська форма Порошок для орального розчину.
Основні фізико-хімічні властивості: порошок або порошок з грудочками або порошкова маса світло-жовтого або жовтого, або сірувато-жовтого, або зеленувато-жовтого, або світло-зеленого кольору. Відновлений розчин від зеленувато-жовтого до жовтого кольору.
Фармакотерапевтична група
Засоби, що впливають на опорно-руховий апарат. Інші засоби, що застосовуються у разі патології опорно-рухового апарату.Код АТС M09A X10.
Фармакологічні властивості
Механізм дії
Рисдиплам є модифікатором cплайсингу попередника матричної РНК (прe-мРНК) гена виживання мотонейронів 2 (SMN2), розробленим для лікування СМА, спричиненої мутаціями хромосоми 5q, що призводять до дефіциту білка SMN. Функціональний дефіцит білка SMN є патофізіологічним механізмом СMA усіх типів. Рисдиплам коригує сплайсинг SMN2, змінюючи баланс з виключення екзону 7 на включення екзону 7 в транскрипт мРНК, у результаті чого збільшується вироблення функціонального та стабільного білка SMN. Таким чином, рисдиплам лікує СМA завдяки підвищенню та утриманню функціонального рівня білка SMN.
Рисдиплам рівномірно розподіляється по всіх частинах тіла, у тому числі в центральну нервову систему, проникаючи через гематоенцефалічний бар’єр, і таким чином збільшуючи рівень білка SMN в ЦНС та усьому організмі. Концентрація рисдипламу в плазмі крові та білка SMN в крові відображає розподіл та фармакодинамічні ефекти рисдипламу в таких тканинах, як головний мозок та м’язи.
В усіх клінічних дослідженнях рисдиплам призводив до послідовного та тривалого збільшення визначеного у крові рівня білка SMN із зміною медіани більше ніж удвічі від вихідного рівня протягом 4 тижнів після початку лікування. Таке збільшення рівня білка SMN зберігалось протягом усього лікування впродовж періоду до 2 років у пацієнтів із інфантильним початком СМА та у пацієнтів із пізнім початком СМА (див. підрозділ «Клінічна ефективність»).
Клінічна ефективність
Ефективність препарату Еврісді у лікуванні пацієнтів з інфантильною формою СMA та із формою СМА з пізнім початком була оцінена в 2 базових клінічних дослідженнях, FIREFISH та SUNFISH, та підтверджена додатковими даними з дослідження JEWELFISH.
В клінічних дослідженнях була продемонстрована довгострокова ефективність впродовж періоду до 2 років лікування. Існують обмежені дані застосування препарату Еврісді протягом більше 2 років.
Інфантильна форма СMA
Дослідження BP39056 (FIREFISH) - відкрите дослідження, що складається з 2 частин, з вивчення ефективності, безпеки, фармакокінетики та фармакодинаміки препарату Eврісді за участю пацієнтів із СМА 1 типу та наявними симптомами (усі пацієнти мали генетично підтверджене захворювання із наявними 2 копіями гена SMN2). Частина 1 дослідження FIREFISH була розроблена як частина дослідження з пошуку дози. У підтверджувальній частині 2 дослідження FIREFISH оцінювалась ефективність препарату Еврісді в терапевтичних дозах, обраних на підставі результатів, отриманих в частині 1 (див. розділ «Спосіб застосування та дози»). Пацієнти з частини 1 не брали участі в частині 2.
У частинах 1 і 2 ключовою кінцевою точкою ефективності була здатність сидіти без підтримки протягом щонайменше 5 секунд, як визначено у пункті 22 шкали розвитку немовлят та дітей раннього віку Бейлі - ІІІ видання (BSID-III) для оцінки загальної моторики, через 12 місяців лікування препаратом Еврісді.
FIREFISH, частина 2
У частину 2 дослідження FIREFISH було включно 41 пацієнта із СMA 1 типу. Медіана віку виникнення клінічних ознак та симптомів СМА 1 типу становила 1,5 місяця (1-3 місяці); 54% були жіночої статі; 54% європеоїдної раси і 34% - азіатами. Медіана віку на момент включення в дослідження становила 5,3 місяця (2,2-6,9 місяця) і медіана часу між появою симптомів та прийомом першої дози становила 3,4 місяця (1-6 місяців). На початку дослідження медіанний показник CHOP-INTEND становив 22 бали (8,0-37) і медіанний показник HINE-2 становив 1 (0-5).
Первинною кінцевою точкою була частка пацієнтів, здатних сидіти без підтримки протягом щонайменше 5 секунд, як визначено у пункті 22 шкали BSID-III для оцінки загальної моторики, через 12 місяців лікування. Кінцеві точки ефективності порівнювались у пацієнтів, які отримували лікування препаратом Еврісді, та у подібних когорт нелікованих пацієнтів із природнім перебігом захворювання (визначені як критерії ефективності), див. таблицю 1.
Таблиця 1
Резюме ключових результатів ефективності через 12 місяців (FIREFISH, частина 2)
Кінцеві точки ефективності | Частка пацієнтів N = 41 (90 % ДI) |
Етапи моторного розвитку та рухова функція | |
BSID-III: сидіння без підтримки протягом щонайменше 5 секунд, значення p на основі критеріїв ефективності, визначених як 5%a | 29,3% (17,8%; 43,1%) <0,0001 |
CHOP-INTEND: кількість балів 40 або вище, значення p на основі критеріїв ефективності, визначених як 17%a | 56,1% (42,1%; 69,4%) <0,0001 |
CHOP-INTEND: збільшення на ≥4 бали від вихідного рівня, значення p на основі критеріїв ефективності, визначених як 17%a | 90,2% (79,1%; 96,6%) <0,0001 |
HINE-2: пацієнти, які відповіли відповідно до критеріїв розвитку моторної функціїb, значення p на основі критеріїв ефективності, визначених як 12%a | 78,0% (64,8%; 88,0%) <0,0001 |
Виживаність та виживаність без подій | |
Виживаність без подійc, значення p на основі критеріїв ефективності, визначених як 42%a | 85,4% (73,4%; 92,2%) <0,0001 |
Виживаність, значення p на основі критеріїв ефективності, визначених як 60%a | 92,7% (82,2%; 97,1%) 0,0005 |
Годування | |
Здатність отримували пероральне харчуванняd | 82,9% (70,3%; 91,7%) |
CHOP-INTEND - тест дитячої лікарні Філадельфії для оцінки рухових функцій при нейром’язових захворюваннях у немовлят; HINE-2 - модуль 2 неврологічного обстеження немовлят за Хаммерсмітом.
a Значення p для виживаності та виживаності без подій ґрунтується на Z-критерії; значення p для усіх інших кінцевих точок (BSID-III, CHOP-INTEND, HINE-2) ґрунтується на точному біномінальному критерії. Показник виживаності обчислений за допомогою методики Каплана - Meйєра.
b Відповідно до HINE-2: відповідь у цьому аналізі визначена як збільшення ≥2 бали (або найбільший можливий показник) здатності сукати ніжками АБО збільшення ≥1 бал таких етапів розвитку моторної функції, як контроль утримання голови, перевертання, сидіння, повзання, стояння чи хода, ТА покращення в більшому числі категорій розвитку моторної функції, ніж погіршення.
c Явище, що відповідає кінцевій точці постійної вентиляції, визначене як трахеостомія, або ≥16 годин неінвазивної вентиляції легень на день, або інтубація протягом > 21 дня послідовно при відсутності або після зняття гострого оборотного явища. Три пацієнти відповідали критеріям кінцевої точки постійної вентиляції до 12 місяця. Усі три пацієнти досягли збільшення даного показника щонайменше на 4 бали за шкалою CHOP-INTEND порівняно з вихідним рівнем.
d Включаючи пацієнтів, які отримували виключно пероральне харчування (загалом 28 пацієнтів), і тих пацієнтів, які отримували пероральне харчування у комбінації із зондом для штучного годування (загалом 6 пацієнтів) через 12 місяців.
Після 12 місяців лікування препаратом Еврісді 29% пацієнтів (12/41) відповідали критеріям сидіння без підтримки (BSID-III, пункт 22), 93% пацієнтів (38/41) були живі і 85% пацієнтів (35/41) були живі та не мали подій (без постійної вентиляції). Ці результати свідчать про клінічно значиме відхилення від природного перебігу захворювання у нелікованих пацієнтів із інфантильним початком СМА. Неліковані пацієнти із інфантильним початком СМА ніколи не зможуть сидіти без підтримки і лише 25% виживуть без постійної вентиляції до віку понад 14 місяців.
FIREFISH, частина 1
Ефективність препарату Еврісді у пацієнтів із СМА 1 типу також підтримується результатами частини 1 дослідження FIREFISH. У 21 пацієнта із частини 1 вихідні характеристики були аналогічні таким у пацієнтів із СМА 1 типу та наявними симптомами. Медіана віку на момент включення в дослідження становила 6,7 місяця (3,3-6,9 місяця) і медіана часу між появою симптомів та прийомом першої дози становила 4 місяці (2-5,8 місяця).
Загалом 17 пацієнтів отримали терапевтичну дозу препарату Еврісді (доза, обрана для частини 2). Через 12 місяців лікування 41% цих пацієнтів (7/17) могли сидіти самостійно протягом щонайменше 5 секунд (BSID-III, пункт 22). Через 24 місяці лікування ще 3 пацієнти, які отримували терапевтичну дозу, змогли сидіти самостійно протягом щонайменше 5 секунд і сумарно 10 пацієнтів (59%) досягли цього етапу розвитку моторної функції.
Через 12 місяців лікування 90% пацієнтів (19/21) були живі, не мали подій (без постійної вентиляції) і досягли віку 15 місяців або більше. Через мінімум 24 місяці лікування 81% пацієнтів (17/21) були живі, не мали подій і досягли віку 28 місяців або більше (медіана віку 32 місяці, діапазон від 28 до 45 місяців), див. рисунок 1. Три пацієнта померли під час лікування і один пацієнт помер через 3,5 місяця після припинення лікування.
СMA із пізнім перебігом
Дослідження BP39055 (SUNFISH) - багатоцентрове дослідження, що складається з 2 частин, з вивчення ефективності, безпеки, фармакокінетики та фармакодинаміки препарату Eврісді у пацієнтів з діагнозом СMA 2 або 3 типу віком від 2 до 25 років. Частина 1 була дослідницькою частиною з визначення дози і частина 2 - рандомізованою подвійно сліпою плацебо-контрольованою підтверджувальною частиною. Пацієнти з частини 1 не брали участі в частині 2.
Первинна кінцева точка оцінювалась як зміна показника рухової функції (MFM32) до 12 місяця порівняно з вихідним рівнем. MFM32 має змогу оцінити широкий діапазон рухових функцій для широкого кола пацієнтів із СМА. Загальний показник MFM32 виражається у відсотках (діапазон: від 0 дo 100) максимального можливого показника, при цьому вищий показник свідчить про більшу рухову функцію. MFM32 визначає здатність до рухової функції, яка стосується важливих щоденних функцій. Незначні зміни рухової функції можуть призвести до значущого покращення або втрати щоденної функції(-й).
SUNFISH, частина 2
Частина 2 SUNFISH - це рандомізована подвійно сліпа плацебо-контрольована частина дослідження за участю 180пацієнтів, які не здатні ходити, зі СМА 2(71 %) або 3 типу (29 %). Пацієнти були рандомізовані у співвідношенні 2:1 для отримання препарату Еврісді в терапевтичній дозі (див. розділ «Спосіб застосування та дози») або плацебо. Рандомізація була стратифікована залежно від віку (від 2 до 5 років, від 6 до 11 років, від 12 до 17 років, від 18 дo 25 років).
Середній вік пацієнтів на момент початку лікування становив 9 років (діапазон 2-25 років), медіана часу від появи симптомів СМА до першого лікування становила 102,6 (1-275) місяця. Серед учасників дослідження 51 % пацієнтів були жіночої статі, 67 % були європеоїдної раси, 19 % - азіатського походження. На момент початку дослідження 67 % пацієнтів мали сколіоз (32 % з них мали тяжкий сколіоз). Пацієнти мали середній вихідний показник МFM32 46,1 і показник RULM 20,1. Загалом вихідні демографічні характеристики були добре збалансованими між групами прийому препарату Еврісді та плацебо, за винятком невідповідності кількості пацієнтів зі сколіозом (63,3 % пацієнтів в групі препарату Еврісді та 73,3 % пацієнтів у групі плацебо-контролю).
Результати первинного аналізу частини 2 дослідження SUNFISH щодо зміни вихідного загального показника MFM32 через 12 місяців продемонстрували клінічно значущу та статистично достовірну різницю між групами пацієнтів, які отримували лікування препаратом Еврісді та плацебо. Результати первинного аналізу та основні вторинні кінцеві точки наведено в таблиці 2 та на рисунку 1.
Таблиця 2
Резюме результатів ефективності у пацієнтів із СМА із пізнім початком через 12 місяців лікування (частина 2 дослідження SUNFISH)
Кінцева точка | Eврісді (N=120) | Плацебо (N=60) |
Первинна кінцева точка: | ||
Зміна загального показника MFM321 через 12місяців порівняно з вихідним рівнем, середньоквадратичне середнє значення (95%, ДI) | 1,36 (0,61; 2,11) | -0,19 (-1,22; 0,84) |
Різниця порівняно з плацебо (95% ДI), показник p2 | 1,55 (0,30; 2,81) 0,0156 | |
Вторинні кінцеві точки | ||
Частка пацієнтів із зміною загального показника MFM321 на 3 або більше через 12місяців порівняно з вихідним рівнем (95% ДI) | 38,3% (28,9; 47,6) | 23,7% (12,0; 35,4) |
Відношення шансів загальної відповіді (95% ДI), скориговане (нескориговане) значення p3,4 | 2,35 (1,01; 5,44) 0,0469 (0,0469) | |
Зміна загального показника RULM5 через 12місяців порівняно з вихідним рівнем, середньоквадратичне середнє значення (95% ДI) | 1,61 (1,00; 2,22) | 0,02 (-0,8; 0,87) |
Різниця порівняно з плацебо (95% ДI), скориговане (нескориговане) значення p2,4 | 1,59 (0,55; 2,62) 0,0469 (0,0028) | |
1 На підставі правила відсутніх даних щодо MFM326 пацієнтів були виключені з аналізу (Eрісді, n=115; група плацебо-контролю, n=59).
2 Дані проаналізовано за допомогою змішаної моделі із повторним вимірюванням із вихідним загальним показником, лікуванням, візитом, віковою групою, ефектом фактору лікування в залежності від візиту і вихідним в залежності від візиту.
3 Дані аналізувались за допомогою логістичної регресії для вихідного загального показника, групи лікування та вікової групи.
4 Скориговане значення p отримано для кінцевих точок, включених в ієрархічне тестування, і обчислено на підставі усіх значень р для кінцевих точок у порядку ієрархії до поточної кінцевої точки. Нескориговане значення p тестувалось із 5% рівнем значимості.
5 На підставі правила відсутніх даних щодо RULM3 пацієнти були виключені з аналізу (Eврісді, n=119; група плацебо-контролю, n=58).
Після завершення 12 місяців лікування 117 пацієнтів продовжили отримувати препарат Еврісді. На момент проведення аналізу через 24 місяціпацієнти, які отримували лікування протягом 24 місяців, досягли подальшого покращення моторної функції в період між 12 і 24 місяцями терапії. Середня зміна вихідного показника MFM32 порівняно з вихідним рівнем становила 1,83 (ДI: 0,74-2,92), а RULM - 2,79 (ДI: 1,94-3,64).
Зміна середньоквадратичного середнього значення загального показника MFM32 |
|
Місяці |
![]() Еврісді
Еврісді ![]() Плацебо
Плацебо
* Планка погрішностей означає 95% довірчий інтервал.
† Загальний показник МFM був обчислений за допомогою керівництва для користувача, виражений як відсоток максимального можливого показника для шкали (тобто суму балів для 32 пунктів ділили на 96 та множили на 100).
Рис. 1. Середня зміна (LS) загального показника MFM32 від вихідного рівня через 12 місяців в частині 2 дослідження SUNFISH.
SUNFISH, частина 1
Ефективність препарату Еврісді у пацієнтів із СМА із пізнім початком також підтверджується результатами частини 1 дослідження SUNFISH з визначення дози. У частину 1 було включено 51 пацієнта із СMA 2 та 3 типу (зокрема 7 пацієнтів, які здатні ходити) віком 2-25 років. Через один рік лікування терапевтичною дозою (дозою, обраною для частини 2) спостерігалось клінічно значиме покращення моторної функції за результатами MFM32 із середньою зміною від вихідного рівня 2,7 бала (95% ДI: 1,5; 3,8). Покращення MFM32 підтримувалось протягом періоду до 2 років лікування препаратом Еврісді (середня зміна 2,7 бала (95% ДI: 1,2; 4,2)).
У пошуковому аналізі рухова функція, оцінена за допомогою MFM, порівнювалась у частині 1 SUNFISH та історичному контролі із природним прогресуванням захворювання (зваженим на основі основних прогностичних факторів). Зміна загального показника MFM порівняно з вихідним рівнем через 1 і 2 роки була більшою у пацієнтів, які отримували Еврісді, порівняно з когортою природного перебігу (через 1 рік: різниця в 2,7 бала; p< 0,0001; через два роки; різниця в 4 бали; p< 0,0001). У когорті природного перебігу спостерігалось зниження моторної функції, що очікується з огляду на природне прогресування СMA (середня зміна через 1 рік: -0,6 бала; через 2 роки: -2 бали).
Застосування раніше лікованим пацієнтам із СМА
Дослідження BP39054 (JEWELFISH) - одногрупове відкрите дослідженнябезпеки, переносимості, фармакокінетики та фармакодинаміки за участю пацієнтів із СМА віком від 6 місяців до 60 років, які отримували лікування з приводу СМА (у тому числі нусинерсен та онасемноген абепарвовек). На 31 липня 2020 року 173 пацієнти отримали препарат Еврісді, 76 пацієнтів отримували попереднє лікування нусинерсеном (9 пацієнтів із СMA 1 типу, 43 пацієнти із СМА 2 типу і 24 пацієнти із СMA 3 типу) і 14 пацієнтів раніше отримували лікування онасемногеном абепарвовеком (4 пацієнти із СМА 1 типу і 10 пацієнтів із СМА 2 типу).
У пацієнтів спостерігалось збільшення рівня білка SMN в середньому у 2 рази порівняно з вихідним рівнем після 4 тижнів лікування.
Фармакокінетичні параметри рисдипламу були охарактеризовані у здорових дорослих осіб та у пацієнтів із СMA.
Після прийому орального розчину препарату Еврісді у дозах від 0,6 до 18 мг фармакокінетика рисдипламу була приблизно лінійною. Фармакокінетика рисдипламу була найкраще описана за допомогою популяційної ФК моделі зі всмоктуванням з трикамерним транзитом, двокамерним розподілом та виведенням першого порядку. Було виявлено, що маса тіла та вік пацієнта мають суттєвий вплив на фармакокінетику препарату. Розрахункова експозиція (середня AUC0-24h) у пацієнтів з інфантильною формою СМА (віком 2-7 місяців на момент включення в дослідження) при рекомендованій дозі 0,2 мг/кг один раз на добу становила 1930 нг.год/мл. Розрахункова експозиція у пацієнтів з формою СМА з пізнім початком (віком 2-25 років на момент включення в дослідження) в дослідженні SUNFISH (частина 2) при терапевтичній дозі (0,25 мг/кг один раз на добу пацієнтам з масою тіла <20кг; 5 мг один раз в день пацієнтам із масою тіла ≥20 кг) становила 2010 нг.год/мл. Максимальна концентрація, що спостерігалася (середня Cmax), становила 194 нг/мл при дозуванні 0,2 мг/кг в дослідженні FIREFISH і 120 нг/мл в частині 2 дослідження SUNFISH.
Всмоктування
Рисдиплам швидко всмоктувався при пероральному прийомі натще, при цьому tmax в плазмі крові варіював від 1 дo 4 годин. У клінічних дослідженнях рисдиплам застосовували вранці з прийомом їжі або після годування груддю.
Розподіл
Розраховані популяційні фармакокінетичні показники становили: 98 л - очевидний центральний об’єм розподілу, 93 л - периферичний об’єм і 0,68 л/годину - міжкомпартментний кліренс.
Рисдиплам в основному зв’язується з альбумінами сироватки крові, не зв’язуючись з aльфа-1 кислими глікопротеїнами, при цьому вільна фракція становить 11 %.
Meтаболізм
Рисдиплам в основному метаболізується за допомогою флавін-монооксигенази 1 та 3 (FMO1 і FMO3), a також ізоферментами CYP 1A1, 2J2, 3A4 і 3A7. Вихідний лікарський засіб був основним компонентом, виявленим у плазмі, і становив у кровообігу 83 % речовини, пов’язаної з лікарським засобом. Фармакологічно неактивний метаболіт M1 був ідентифікований як основний циркулюючий метаболіт.
Виведення
Популяційний фармакокінетичний показник очевидного кліренсу (CL/F) рисдипламу становив 2,6 л/год. Ефективний період напіввиведення рисдипламу становив близько 50 годин у пацієнтів із СМА.
Приблизно 53% дози (14% у формі незміненого рисдипламу) виводилось з калом та 28% із сечею (8% у формі незміненого рисдипламу).
Особливі групи пацієнтів
Порушення функції печінки
Порушення функції печінки легкого та помірного ступеня не впливало на ФK рисдипламу. Після прийому 5 мг рисдипламу середні співвідношення Cmax та AUC становили 0,95 і 0,80 у осіб із легким (n=8) та 1,20 і 1,08 у пацієнтів з помірним порушенням функції печінки (n=8) порівняно із відповідними показниками у пацієнтів з нормальною функцією печінки (контрольна група, n=10). Безпека і ФК у пацієнтів із тяжким порушенням функції печінки на сьогодні не вивчались.
Порушення функції нирок
Дослідження ФК рисдипламу у пацієнтів із порушенням функції нирок не проводились. Виведення рисдипламу у вигляді незміненої речовини нирками є незначним (8%).
Пацієнти літнього віку
Спеціальні дослідження фармакокінетики препарату Еврісді у пацієнтів із СМА віком понад 60років не проводились. Пацієнти із СМА віком до 60 років були включені в дослідження JEWELFISH. Пацієнти без СМА віком до 69 років були включені в клінічні дослідження ФК.
Діти
Маса тіла та вік пацієнта були ідентифіковані як коваріати в популяційному ФК аналізі. Тому дозу коригують залежно від віку (менше та більше 2років) та маси тіла (до 20кг) з метою отримання подібної експозиції в різних вікових групах та вагових категоріях. Стосовно пацієнтів віком до 2місяців дані відсутні.
Етнічна приналежність
Фармакокінетика рисдипламу не відрізняється у японців та пацієнтів європеоїдної раси.
Клінічні характеристики
Показання.
Лікування 5q-aсоційованої спінальної м’язової атрофії (СMA) у пацієнтів віком від 2 місяців.
Протипоказання.
Відома підвищена чутливість до рисдипламу або будь-якої з допоміжних речовин, зазначених у розділі «Склад».
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Вплив E в рісді на інші лікарські засоби
In vitro рисдиплам та його основний циркулюючий метаболіт M1 не індукували CYP1A2, 2B6, 2C8, 2C9, 2C19 та 3A4.In vitro рисдиплам та M1 не пригнічували (оборотне або залежне від часу пригнічення) будь-який з ферментів CYP, що досліджувалися (CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6), за винятком CYP3A.
Препарат Еврісді є слабким інгібітором CYP3A. У здорових дорослих осіб прийом препарату Еврісді один раз на добу протягом 2 тижнів дещо підвищував експозицію мідазоламу, високочутливого субстрату CYP3A (AUC 11 %; Cmax 16 %). Така взаємодія не вважається клінічно значимою, тому корекція дози субстратів CYP3A не потрібна.
З огляду на результати застосування фармакокінетичної моделі на основі фізіології (PBPK), подібний ефект очікується у дітей та немовлят віком від 2 місяців.
Дослідження іn vitro продемонстрували, що рисдиплам та його основний метаболіт не є суттєвими інгібіторами MDR1 людини, поліпептиду-транспортера органічних аніонів (OATP)1B1, OATP1B3, транспортера органічних аніонів 1 та 3 (OAT 1 та 3). Однак рисдиплам та його метаболітin vitro є інгібіторами поліпептиду-транспортера органічних катіонів 2 (OCT2) людини і транспортерів білків множинної резистентності та виведення токсинів (MATE)1 та транспортерів MATE2-K. У разі застосування в терапевтичних концентраціях взаємодія лікарського засобу з субстратами OCT2 не очікується. Вплив супутнього застосування рисдипламу на фармакокінетику субстратів MATE1 та MATE2-K у людини невідомий. На підставі данихin vitro, препарат Еврісді може збільшувати плазмову концентрацію лікарських засобів, які виводяться за допомогою MATE1 або MATE2-K, наприклад метформіну (див. розділ «Фармакокінетика»). Якщо неможливо уникнути супутнього застосування, слід здійснювати моніторинг щодо пов’язаної з лікарським засобом токсичності і розглянути питання про зменшення дози іншого одночасно застосовуваного препарату у разі необхідності.
Вплив інших лікарських засобів на Еврісді
Рисдиплам метаболізується в основному за участю флавін-монооксигенази 1 та 3 (FMO1 та 3), а також за допомогою CYPs 1A1, 2J2, 3A4 і 3A7. Рисдиплам не є субстратом білка множинної резистентності 1 людини (MDR1).
При одночасному застосуванні сильного інгібітору CYP3A ітраконазолу у дозі 200 мг двічі на добу та рисдипламу у дозі 6 мг одноразово перорально не спостерігалося клінічно значущого впливу на фармакокінетику (ФK) рисдипламу (збільшення AUC на 11 %, зниження Cmax на 9 %). При одночасному застосуванні з інгібітором CYP3A корекція дози препарату Еврісді не потрібна.
Не очікується взаємодії з іншими лікарськими засобами через FMO1- та FMO3-опосередковані шляхи передачі сигналу.
Особливості застосування.
Загальні
У дослідженнях на тваринах спостерігались зміни з боку сітківки, епітелію, особливо з боку шкіри та шлунково-кишкового тракту, та ознаки токсичності з боку кісткового мозку (зміни в клінічному аналізі крові). На сьогодні ризик таких змін у людей не можна остаточно оцінити через обмежені довгострокові дані про безпеку.
Ембріофетальна токсичність
У дослідженнях на тваринах спостерігалася ембріофетальна токсичність. Пацієнтів репродуктивного віку слід проінформувати про ризики. Необхідно застосовувати високоефективні методи контрацепції під час лікування та щонайменше протягом 1 місяця після прийому останньої дози препарату Еврісді жінками та протягом 4 місяців після прийому останньої дози препарату Еврісді чоловіками (див. розділ «Спосіб застосування та дози»).
Потенційний вплив на фертильність чоловіків
З огляду на оборотні ефекти препарату Еврісді на чоловічу фертильність, що спостерігалися у дослідженнях на тваринах, пацієнтам-чоловікам не слід бути донорами сперми під час лікування та протягом 4 місяців після прийому останньої дози препарату Еврісді (див. розділ «Фармакокінетика»).
Слід уникати контакту порошку та відновленого орального розчину зі шкірою. При потраплянні лікарського засобу (порошку або розчину) на шкіру уражену ділянку необхідно промити водою з милом.
Допоміжні речовини .
Цей лікарський засіб містить 0,38 мг натрію бензоату в 1 мл. Цей препарат містить менше 1ммоль натрію (23 мг) на дозу, тобто вважається вільним від натрію.
Цей лікарський засіб містить iзoмальт. Пацієнтам із рідкісною вродженою непереносимістю фруктози не слід застосовувати цей лікарський засіб.
Застосування у період вагітності або годування груддю.
З огляду на результати доклінічних досліджень, фертильність чоловіків може порушуватися під час лікування препаратом Еврісді. У репродуктивних органах щурів та мавп спостерігалися дегенерація сперми та зменшення кількості сперматозоїдів.
З пацієнтами чоловічої статі перед початком лікування препаратом Еврісді необхідно обговорити стратегії збереження фертильності. Пацієнти чоловічої статі можуть розглянути можливість збереження сперми до початку лікування або після періоду без лікування протягом не менше 4 місяців (див. розділ «Особливості застосування»).
З огляду на результати доклінічних досліджень, впливу препарату Еврісді на фертильність жінок не очікується.
Жінок репродуктивного віку слід обстежити щодо вагітності до початку лікування препаратом Еврісді.
Пацієнтам чоловічої та жіночої статі репродуктивного віку слід дотримуватися таких вимог щодо контрацепції:
• Пацієнтам чоловічої статі та їхнім партнеркам репродуктивного віку слід застосовувати високоефективну контрацепцію під час лікування препаратом Еврісді та протягом щонайменше 4 місяців після прийому останньої дози препарату.
• Пацієнтам жіночої статі репродуктивного віку слід застосовувати високоефективну контрацепцію під час лікування препаратом Еврісді та протягом щонайменше 1 місяця після прийому останньої дози препарату.
Вагітність
Відсутні клінічні дані щодо застосування препарату Еврісді вагітним. Рисдиплам продемонстрував ембріофетотоксичну та тератогенну дію у тварин. З огляду на дані, отримані в дослідженнях на тваринах, рисдиплам проникає через плацентарний бар’єр і може спричиняти ураження плода.
Препарат Еврісді не слід застосовувати під час вагітності, якщо тільки у цьому немає чіткої необхідності. Якщо вагітна жінка потребує лікування препаратом Еврісді, їй необхідно чітко пояснити потенційний ризик для плода.
Годування груддю
Невідомо, чи екскретується препарат Еврісді в грудне молоко людини. Дослідження на щурах показали, що рисдиплам екскретується в грудне молоко. Оскільки потенціал нанесення шкоди немовляті, який знаходиться на грудному вигодовуванні, невідомий, лікуючий лікар повинен прийняти рішення щодо подальшої терапії пацієнта. Під час лікування препаратом Еврісді годування груддю не рекомендується.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Вплив препарату Еврісді на швидкість реакції при керуванні автотранспортом або іншими механізмами не вивчався у відповідних дослідженнях.
Спосіб застосування та дози.
Оральний розчин препарату Еврісді повинен готувати медичний фахівець (тобто лікар або фармацевт) перед відпуском пацієнту.
Медичному працівнику необхідно перед застосуванням першої дози обговорити з пацієнтом або особою, яка доглядає за пацієнтом, як приготувати та прийняти призначену добову дозу (див. нижче «Інструкції щодо поводження»).
Починати та контролювати лікування препаратом Еврісді повинні лікарі, які мають досвід діагностики та лікування пацієнтів зі спінальною м’язовою атрофією.
Програма клінічної розробки не включає пацієнтів із СМА IV типу.
Рекомендоване дозування
Лікарський засіб Еврісді приймають перорально один раз на добу, приблизно в один і той же час щодня, використовуючи шприци для орального прийому для повторного використання, що надаються в упаковці. Рекомендована доза препарату Еврісді для лікування СМА визначається залежно від віку та маси тіла пацієнта (див. таблицю 3).
Taблиця 3
Режим дозування залежно від віку та маси тіла
Вік та маса тіла | Рекомендована добова доза |
від 2місяців до <2років | 0,20мг/кг |
≥2років та маса тіла <20кг | 0,25мг/кг |
≥2років та маса тіла ≥20кг | 5мг |
Зміну дози необхідно здійснювати під наглядом медичного працівника. Лікування добовою дозою вище 5мг дотепер не вивчалось. Немає даних щодо застосування немовлятам віком до 2 місяців.
Пацієнти з порушенням функції печінки
Пацієнтам із легким чи помірним порушенням функції печінки корекція дози не потрібна. Не вивчалося застосування препарату Eврісді пацієнтам із тяжким порушенням функції печінки (див. розділ «Фармакокінетика»).
Пацієнти з порушенням функції нирок
Безпека та ефективність застосування препарату Еврісді пацієнтам із порушенням функції нирок не вивчались. Не очікується необхідності корекції дози пацієнтам із порушенням функції нирок (див. розділ «Фармакокінетика»).
Пацієнти літнього віку
Клінічні дослідження препарату Еврісді не включали пацієнтів віком від 65 років, тому не було встановлено різниці між їхньою відповіддю на лікування та відповіддю молодших пацієнтів.
Діти
Безпека та ефективність застосування Еврісді дітям віком до 2 місяців не встановлені (див. розділ «Фармакокінетика»).
Відкладений прийом
Лікарський засіб Еврісді приймають перорально один раз на добу приблизно в один і той же час щодня. Якщо прийом дози препарату Еврісді пропущено, препарат Еврісді слід прийняти якомога швидше, якщо затримка становить не більше 6 годин від запланованого прийому, і звичайний режим дозування можна відновити наступного дня. В іншому випадку не слід приймати пропущену дозу та прийняти наступну дозу в запланований час наступного дня.
Якщо доза не проковтнулася повністю або виникло блювання після прийому препарату Еврісді, не слід приймати іншу дозу, щоб компенсувати втрачену дозу. Слід зачекати наступного дня для прийому наступної дози в запланований час.
Спосіб застосування
Для прийому добової дози Еврісді необхідно використовувати оральний шприц для багаторазового застосування, що надається в картонній упаковці разом із лікарським засобом (див. таблицю 4).
Таблиця 4
Вибір відповідного орального шприца для багаторазового застосування для прийому призначеної добової дози Еврісді
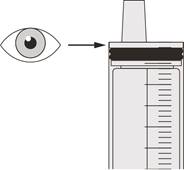
Розмір шприца | Об’єм дозування | Ціна поділки шприца |
6 мл | від 1 до 6 мл | 0,1 мл |
12 мл | від 6,2 до 6,6 мл | 0,2 мл |
Для розрахунку об’єму дозування також необхідно врахувати ціну поділки шприца. Округляйте об’єм дози в бік збільшення або зменшення до найближчої ціни поділки, позначеної на вибраному оральному шприці (наприклад, з 6,3 мл до 6,4 мл, з 3,03 мл до 3 мл і з 1,05 до 1,1 мл).
Лікарський засіб Еврісді у вигляді розчину необхідно прийняти відразу після його набору в оральний шприц для багаторазового використання. Якщо вміст шприца не прийнятий протягом 5 хвилин, слід звільнити оральний шприц від препарату (див. нижче «Утилізація невикористаного лікарського засобу/лікарського засобу, термін придатності якого минув») і приготувати нову дозу.
Лікарський засіб Еврісді необхідно приймати після їди. Пацієнту необхідно випити води після прийому Еврісді, щоб переконатися, що препарат повністю проковтнувся. Якщо пацієнт не може ковтати і йому встановлено назогастральний зонд або гастростомічну трубку, Еврісді можна вводити через зонд/трубку. Після введення препарату зонд/трубку слід промити водою (див. нижче «Інструкції щодо поводження»).
Інструкції щодо поводження
Інструкції, яких необхідно дотримуватися до, під час та після приготування орального розчину:
• Розчин завжди повинен готувати медичний фахівець (тобто лікар або фармацевт).
• Слід уникати вдихання порошку препарату Еврісді. Зверніть увагу на місцеві норми та використовуйте відповідне обладнання для приготування розчину Еврісді.
• Одягайте рукавички.
• Не використовуйте порошок, якщо термін придатності минув. Термін придатності порошку надрукований на етикетці пляшки та картонній коробці.
• Не видавайте відновлений розчин, якщо термін придатності готового до вживання орального розчину - дата, зазначена на етикетці пляшки та картонній коробці, - перевищує початковий термін придатності порошку.
• Уникайте контакту лікарського засобу зі шкірою. Якщо лікарський засіб (порошок або розчин) потрапляє на шкіру, промийте ділянку водою з милом.
• Не використовуйте лікарський засіб, якщо будь-який вміст упаковки пошкоджений або відсутній.
• Для приготування розчину використовуйте очищену воду або воду для ін’єкцій.
• Не використовуйте оральні шприци, крім тих, що вкладені в картонну коробку разом із лікарським засобом.
• Не змішуйте Еврісді з їжею чи рідинами (наприклад з молоком або молочною сумішшю).
• Не змішуйте Eврісді з нової пляшки з препаратом з пляшки, яку ви зараз використовуєте.
Пацієнт або особа, що доглядає за пацієнтом, повинні бути проінструктовані медичним працівником, як слід готувати та приймати призначену добову дозу перед доставкою приготовленого розчину.
Приготування орального розчину
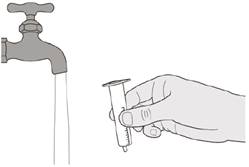
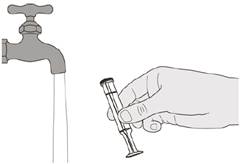
Наливають 79 мл очищеної води або води для ін’єкцій в пляшку із лікарським засобом.
Вставляють втискний адаптер для пляшки в отвір пляшки, протискуючи його вниз.
Після повного закриття пляшки струшуйте протягом 15 секунд.
Через 10 хвилин повинен бути отриманий прозорий розчин. Якщо розчин не став прозорим, його слід струсити ще протягом 15 секунд.
Необхідно вирахувати 64 дні після приготування розчину. День приготування розчину вважається днем 0. Розраховану дату слід зазначити на етикетці пляшки та картонній коробці у полі: Відновлений оральний розчин ВИКИНУТИ ПІСЛЯ: (день/місяць/рік).
Утилізація невикористаного лікарського засобу/лікарського засобу, термін придатності якого минув
Потрапляння лікарських засобів в навколишнє середовище має бути зведено до мінімуму. Не можна утилізувати лікарські засоби через стічні води, а також слід уникати утилізації з побутовими відходами.
Невикористаний препарат/препарат із терміном дії, що закінчився, повинен бути утилізований професійно в місці видачі лікарського засобу (лікарем або фармацевтом).
Інструкція з приготування розчину (ЛИШЕ ДЛЯ МЕДИЧНИХ ПРАЦІВНИКІВ, ЗОКРЕМА ЛІКАРІВ АБО ФАРМАЦЕВТІВ)
Оральний розчин Еврісді повинен бути приготований медичним працівником перед відпуском пацієнту.
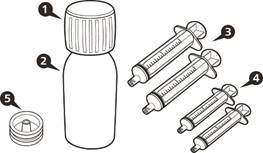
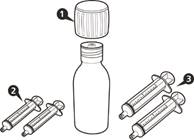
Одна упаковка препарату Еврісді містить (див. рисунок A): 1)1 кришка 2)1 пляшка з препаратом Еврісді 3)2 оральні шприци для багаторазового застосування по 12 мл (у пакетиках) 4)2 оральні шприци для багаторазового застосування по 6 мл (у пакетиках) 5)1 втискний адаптер для пляшки 6)1 інструкція для медичного застосування лікарського засобу (не показана) |
Рисунок A |
Важлива інформація про препарат Еврісді
• Розчин завжди повинен готуватись медичним працівником (лікарем або фармацевтом).
• Уникати вдихання порошку препарату Еврісді. Дотримуватись локальних вимог та використовувати відповідне обладнання для приготування розчину Еврісді.
• Носити рукавички.
• Не використовувати цей препарат після завершення терміну придатності. Дата завершення терміну придатності зазначена на етикетці пляшки та картонній коробці.
• Уникати будь-якого контакту цього препарату зі шкірою. Якщо такий контакт відбувся (з порошком або розчином), необхідно вимити ділянку контакту водою з милом.
• Не використовувати цей препарат, якщо будь-який компонент упаковки пошкоджений або відсутній.
• Для приготування розчину використовувати очищену воду або воду для ін’єкцій.
• Не використовувати оральні шприци для багаторазового застосування, крім тих, які надаються в упаковці.
• Не відпускати приготований розчин, якщо термін придатності готового до вживання орального розчину - дата, зазначена на етикетці пляшки та картонній коробці, - перевищує дату завершення терміну придатності порошку.
• Перед відпуском приготованого розчину медичному працівнику необхідно проінструктувати пацієнта або опікуна, яким чином приготувати та приймати добову дозу.
Як зберігати препарат Еврісді
● Зберігати порошок (лікарський засіб, ще не приготований як розчин) у картонній коробці при кімнатній температурі не вище 25°C з метою захисту від світла та вологи.
● Зберігати розчин (лікарський засіб, приготований як розчин) у вертикальному положенні в холодильнику при температурі 2-8°C у картонній коробці для захисту вмісту від світла.
● Зберігати оральний розчин в оригінальній пляшціу вертикальному положенні та зі щільно закритою кришкою.
Приготування розчину
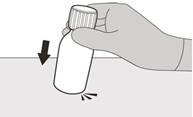
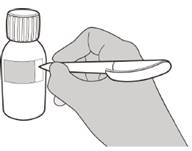
Рисунок В | Крок 1 Обережно постукати по дну пляшки, щоб розпушити порошок (див. рисунок B). |
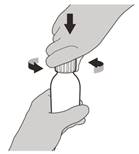
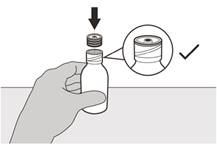
Рисунок С | Крок 2 Зняти кришку, натиснувши на неї вниз, а потім скручуючи вліво (проти годинникової стрілки) (див. рисунок C). Не викидати кришку. |
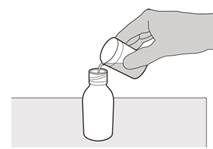
Рисунок D | Крок 3 Обережно додати 79 мл води очищеної чи води для ін’єкцій у пляшку з препаратом (див. рисунок D). |
Рисунок Е | Крок 4 Тримати пляшку з препаратом однією рукою на столі. Вставити втискний адаптер для пляшки в отвір пляшки, натискаючи на нього донизу іншою рукою доки адаптер не буде повністю притиснутий до краю отвору пляшки (див. рисунок E). |
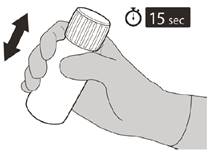
Рисунок F | Крок 5 Надіти кришку назад на пляшку. Повернути кришку вправо (за годинниковою стрілкою), щоб закрити пляшку. Переконатись, що пляшка повністю закрита, а потім добре струшувати протягом 15 секунд (див. рисунок F). Зачекати 10 хвилин. Ви повинні отримати прозорий розчин. Якщо ні, ще раз добре струшувати протягом 15 секунд. |
Рисунок G | Крок 6 Визначити дату«ВИКИНУТИ ПІСЛЯ: (день/місяць/рік)», вирахувавши 64 дні після приготування розчину (примітка: день приготування обчислюється як день 0. Наприклад, якщо Ви приготували розчин 1 квітня, датою «ВИКИНУТИ ПІСЛЯ» буде 4червня). Зазначитицю дату у відповідному полі на етикетці пляшки (див. рисунок G) та картонній коробці: Відновлений оральний розчин ВИКИНУТИ ПІСЛЯ: (день/місяць/рік). Помістити пляшку назад у картонну коробку разом зі шприцами (у пакетиках) та інструкцією для медичного застосування. Все зберігати в холодильнику, тримаючи пляшку у вертикальному положенні. |
ІНСТРУКЦІЯ
ДЛЯ ЗАСТОСУВАННЯ ОРАЛЬНОГО РОЗЧИНУ
Необхідно прочитати та зрозуміти інструкцію для медичного застосування перед початком прийому Еврісді. Вона містить інформацію про те, як приготувати та ввести дозу Еврісді за допомогою багаторазового орального шприца через рот, гастростомічний зонд (зонд ПЕГ) або назогастральний зонд (шлунковий зонд). Якщо у вас виникли запитання щодо використання Eврісді, зверніться до свого лікаря або фармацевта. Перед відпуском оральний розчин Eврісді повинен приготувати медичний працівник, такий як лікар або фармацевт.
Ви повинні отримати препарат Eврісді у вигляді рідини в пляшці. Не використовуйте, якщо ліки у флаконі - це порошок, і зверніться до свого лікаря або фармацевта, якщо це так.
Перед тим, як приймати/давати першу дозу, медичний працівник повинен проінструктувати вас, як саме готувати та приймати/давати добову дозу.
• Попросіть свого лікаря або фармацевта показати вам, який за розміром із оральних шприців, що містяться в упаковці, слід використовувати для введення та як визначити добову дозу.
• Два шприци кожного розміру надаються на випадок, якщо один загубиться або пошкодиться. Зверніться до свого лікаря або фармацевта, якщо обидва шприци загублені або пошкоджені. Він порадить вам, як продовжувати приймати препарат.
• Для вимірювання встановленої добової дози завжди використовуйте шприц правильного розміру, який можна використовувати повторно.
• Опис підходящого для вас шприца, який можна повторно використовувати, також міститься в таблиці 4: «Вибір відповідного орального шприца для багаторазового застосування для прийому призначеної добової дози Еврісді». Попросіть свого лікаря або фармацевта, якщо у вас є питання щодо того, як правильно вибрати шприц.
• Якщо адаптера для пляшки немає у пляшці, не використовуйте Eврісді та зверніться до свого лікаря або фармацевта.
• Не використовуйте Eврісді після дати «Відновлений оральний розчин ВИКИНУТИ ПІСЛЯ: (день/місяць/рік)», зазначеної на етикетці пляшки та картонній коробці. Якщо на етикетці пляшки або картонній коробці немає дати «Відновлений оральний розчин ВИКИНУТИ ПІСЛЯ: (день/місяць/рік)», запитайте дату у свого лікаря або фармацевта.
• Не змішуйте Eврісді з їжею або рідинами (наприклад з молоком або молочною сумішшю).
• Не використовуйте Eврісді, якщо пляшка або оральний шприц пошкоджені.
• Уникайте контакту Eврісді зі шкірою. Якщо Eврісді потрапляє на вашу шкіру, промийте ділянку водою з милом.
• Якщо ви пролили Еврісді, протріть місце сухою паперовою серветкою, а потім очистіть її водою з милом. Викиньте паперовий рушник у відходи і добре вимийте руки водою з милом.
• Якщо в пляшці недостатньо препарату Еврісді для встановленої дози, слід повернути пляшку та використані оральні шприци в місце видачі (лікарю або фармацевту) для належної утилізації. Використовуйте нову пляшку Еврісді, щоб відібрати призначену дозу. Не змішуйте Еврісді з нової пляшки з препаратом з пляшки, якою ви раніше користувались.
Кожна коробка препарату Еврісді містить (див. рисунок A):
1) 1 пляшка з адаптером для пляшки та кришкою 2) 2 оральні шприци по 6 мл для багаторазового застосування (в пакетиках) 3) 2 оральні шприци по 12 мл для багаторазового застосування (в пакетиках) 4) 1 інструкція для медичного застосування лікарського засобу (не показана) |
|
Рисунок A
A) Приготування та набирання правильного об’єму дозування
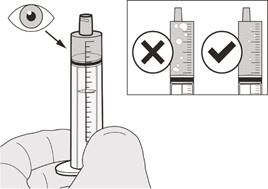
Як вибрати відповідний оральний шприц для призначеної дози препарату Еврісді
• Якщо Ваша щоденна призначена доза препарату Еврісді становить від 1 мл до 6 мл, застосовують шприц по 6 мл (сіра етикетка). |
|
• Якщо Ваша щоденна призначена доза препарату Еврісді становить 6,2 мл або більше, застосовують шприц по 12 мл (коричнева етикетка). |
|
Як приготувати вашу дозу препарату Еврісді
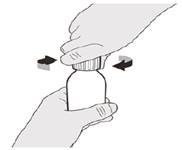
Рисунок В | Крок A1 Зніміть кришку, натиснувши на неї вниз, а потім скручуючи вліво (проти годинникової стрілки) (див. рисунок В). Не викидайте кришку. | ||||||
Рисунок С | Крок A2 Натисніть на поршень орального шприца повністю донизу, щоб видалити повітря із орального шприца (див. рисунок C). | ||||||
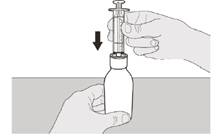
Рисунок D | Крок А3 Утримуючи пляшку у вертикальному положенні, вставте наконечник шприца в адаптер для пляшки (див. рисунок D). | ||||||
Рисунок Е | Крок A4 Обережно переверніть пляшку догори дном із наконечником шприца, міцно вставленим в адаптер пляшки (див. рисунок E). | ||||||
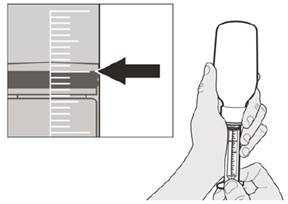
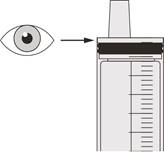
Рисунок F | Крок A5 Повільно відтягніть поршень щоб відібрати призначену вам дозу препарату Еврісді з пляшки. Верхню частину чорного обмежувача ходу поршня потрібно вирівняти із позначенням мілілітрів на шприці для перорального введення, що відповідає призначеній вам добовій дозі (див. рисунок F). Після відбору правильної дозиутримуйте поршень на місці, щоб поршень не рухався. | ||||||
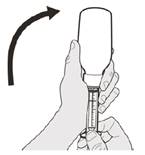
Рисунок G | Крок A6 Продовжуйте утримувати поршень на місці, щоб поршень не рухався. Залиште оральний шприц в адаптері для пляшки і поверніть пляшку у вертикальне положення. Поставте пляшку на рівну поверхню. Вийміть оральний шприц з адаптера для пляшки, обережно потягнувши його догори, тримаючи поршень на місці (див. рисунок G). | ||||||
Рисунок Н | Крок A7 Тримайте оральний шприц так, щоб кінчик шприца був спрямований вгору. Перевірте препарат Еврісді в оральному шприці.Якщов оральному шприці спостерігаються великі бульбашки повітря (див. рисунок H) або якщови відібрали неправильну дозу препарату Еврісді, щільно вставте наконечник шприца в адаптер для пляшки. Натисніть на поршень донизу так, щоб препарат Еврісді перетік назад в пляшку і повторіть кроки A4-A7. Прийміть або дайте препарат Еврісді одразу після набору препарату в оральний шприц. Якщо препарат не прийнятопротягом 5 хвилин, видаліть та утилізуйте препарат Еврісді з орального шприца і наберіть нову дозу. | ||||||
Рисунок І | Крок A8 Залишить адаптер пляшки на пляшці. Надіньте кришку назад на пляшку. Поверніть кришку вправо (за годинниковою стрілкою), щоб щільно закрити пляшку (див. рисунок І). | ||||||
Якщо ви приймаєте дозу препарату Еврісді перорально, дотримуйтесь інструкцій у розділі«B) Як приймати дозу препарату Еврісді перорально».
Якщо ви приймаєте дозу препарату Еврісді через гастростомічну трубку, дотримуйтесь інструкцій у розділі «C) Як вводити дозу препарату Еврісді через гастростомічну трубку».
Якщо ви приймаєте дозу препарату Еврісді через назогастральний зонд, дотримуйтесь інструкцій у розділі «D) Як вводити дозу препарату Еврісді через назогастральний зонд».
B) Як приймати дозу препарату Еврісді перорально
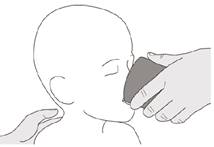
Будьте у вертикальному положенні (бажано сидячи), приймаючи дозу Еврісді через рот.
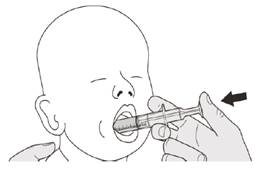
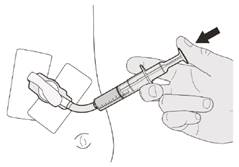
Рисунок J | Крок B1 Покладіть оральний шприц в роткінчиком уздовж будь-якої щоки. Повільнонатисніть на поршень до кінця, щоб ввести повну дозу препарату Еврісді (див. рисунок J). Потрапляння препарату Еврісді в горло або занадто швидке введення може спричинити задуху. |
Рисунок К | Крок B2 Перевірте, чи не залишилося препарату Еврісді в оральному шприці (див. рисунок К). |
Рисунок L | Крок B3 Випийтетрохи води відразу після прийому призначеної дози препарату Еврісді (див. рисунок L). Див. крок E щодо інформації про очищення шприца. |
C) Як вводити дозу препарату Еврісді через гастростомічну трубку
Якщо ви вводите препарат Еврісді через гастростомічну трубку, попросіть вашого лікаря показати вам, яким чином оглядати гастростомічну трубку перед введенням препарату Еврісді.
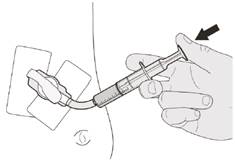
Рисунок М | Крок C1 Помістіть наконечник орального шприца в гастростомічну трубку. Повільно натисніть поршень до кінця для введення повної дози препарату Еврісді (див. рисунок M). |
Рисунок N | Крок C2 Перевірте, чи не залишилося препарату Еврісді в оральному шприці (див. рисунок N). |
Рисунок Q | Крок C3 Промийте гастростомічну трубку 10-20 мл води відразу після введення призначеної дози препарату Еврісді (див. рисунок O). Див. крок E щодо інформації про очищення шприца. |
D) Як вводити дозу препарату Еврісді через назогастральний зонд
Якщо ви вводите препарат Еврісді через назогастральний зонд, попросіть вашого лікаря показати вам, яким чином оглядати назогастральний зонд перед введенням препарату Еврісді.
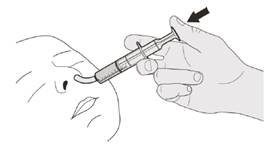
Рисунок Р | Крок D1 Помістіть наконечник орального шприца в назогастральний зонд. Повільно натисніть поршень до кінця для введення повної дози препарату Еврісді (див. рисунок P). |
Рисунок Q | Крок D2 Перевірте, чи не залишилося препарату Еврісді в оральному шприці (див. рисунок Q). |
Рисунок R | Крок D3 Промийте назогастральний зонд 10-20 мл води відразу після введення призначеної дози препарату Еврісді (див. рисунок R). Див. крок E щодо інформації про очищення шприца. |
Е) Яким чином очистити шприц для перорального введення після застосування
Рисунок S | Крок E1 Витягніть поршень (проти опору) зі шприца. Добре промийте циліндр орального шприца під чистою проточною водою (див. рисунок S). |
Рисунок Т | Крок E2 Добре промийте поршень під чистою проточною водою (див. рисунок T). |
Рисунок U | Крок E3 Перевірте, що циліндр та поршень орального шприца чисті. Покладіть циліндр та поршень орального шприца на чисту поверхню в безпечне місце для висихання (див. рисунок U). Вимийте руки. Після того, як циліндр і поршень орального шприца висохнуть, помістіть поршень назад в циліндр орального шприца та зберігайте шприц до наступного застосування. |
Діти.
Безпека та ефективність препарату Еврісді у пацієнтів віком до 2 місяців не встановлені (див. розділ «Фармакокінетика»).
Передозування.
Відсутній досвід передозування препаратом Еврісді в клінічних дослідженнях. Відсутній відомий антидот при передозуванні препаратом Еврісді. При передозуванні слід ретельно спостерігати за станом пацієнта та розпочати підтримувальну терапію.
Побічні реакції.
Класифікація частоти виникнення побічних реакцій лікарського засобу: дуже часто (≥1/10), часто (від ≥1/100 до <1/10), нечасто (від ≥1/1 000 до <1/100), рідко (від ≥1/10 000 до <1/1000), дуже рідко (<1/10 000); частота невідома (не можна розрахувати на основі наявних даних).
Коротка характеристика профілю безпеки
У пацієнтів із СМА із інфантильним початком найбільш поширеними побічними реакціями, що спостерігались в клінічних дослідженнях препарату Еврісді, були підвищення температури тіла (48,4%), висипання (27,4%) та діарея (16,1%). У пацієнтів із СМА із більш пізнім початком найбільш поширеними побічними реакціями, що спостерігались в клінічних дослідженнях препарату Еврісді, були підвищення температури тіла (21,7%), діарея (16,7%) і висипання (16,7%).
Зазначені вище побічні реакції виникали без ідентифікованих клінічних особливостей або характеру зв’язку із часом і загалом зникали без припинення лікування у пацієнтів із СМА з інфантильним початком та пізнім початком.
Таблиця3
Резюме побічних реакцій у пацієнтів із СМА з інфантильним початком та пізнім початком, що спостерігались в клінічних дослідженнях препарату Еврісді
Клас системи органів | СMA з інфантильним початком2 (тип 1) | СMA із пізнім початком3 (тип 2 та 3) | |
Шлунково-кишкові розлади | |||
Діарея | Дуже часто | Дуже часто | |
Виразки на слизовій оболонці ротової порожнини та афтозні виразки | Часто | Часто | |
Порушення з боку шкіри та підшкірної клітковини | |||
Висипання1 | Дуже часто | Дуже часто | |
Загальні порушення та реакції в місці введення | |||
Підвищення температури тіла (включаючи гіперпірексію) | Дуже часто | Дуже часто | |
Інфекції та інвазії | |||
Інфекція сечовивідних шляхів (включаючи цистит) | Часто | Часто | |
Порушення з боку кістково-м’язової системи та сполучної тканини | |||
Артралгія | Не застосовно | Часто | |
1 Включає висипання, макулопапульозне висипання, еритему, дерматит, алергічний дерматит, папульозний висип, фолікуліт.
2 У пацієнтів із СМА з інфантильним початком (FIREFISH, частини 1 та 2) побічні реакції визначено як явища, які відбулись у 2% пацієнтів або більше іпричинний зв’язок яких із препаратом Еврісді є можливим.
3 У пацієнтів із СМА із пізнім початком (SUNFISH, частина 2) побічні реакції визначено як явища, які відбулись щонайменше на 2% частіше у пацієнтів, які отримували лікування препаратом Еврісді, порівняно з такими у групі плацебо під час подвійно контрольованого сліпого періоду іпричинний зв’язок яких із препаратом Еврісді є можливим.
Наявні дані з безпеки обмежені стосовно числа пацієнтів, які отримували препарат Еврісді, та тривалості експозиції. Можуть спостерігатись потенційні відносно рідкісні та потенційно серйозні побічні реакції (ПР), які не були виявлені під час програми дослідження.
Профіль безпеки у пацієнтів, які раніше отримували лікування з приводу СМА
Профіль безпеки препарату Еврісді у раніше лікованих пацієнтів в дослідженні JEWELFISH збігається із профілем безпеки при лікуванні раніше не лікованих пацієнтів із СМА, які отримували препарат Еврісді в дослідженні FIREFISH (частини 1 і 2) та SUNFISH (частини 1 і 2). У дослідження JEWELFISH були включені 76 пацієнтів, які раніше отримували лікування нусинерсеном, і 14 пацієнтів, які раніше отримували лікування онасeмногеном aбeпaрвoвeком (див. підрозділ «Клінічна ефективність»).
Доклінічні ефекти
Доклінічні ефекти стосовно структури сітківки, епітеліальної тканини та гематологічних параметрів, описані у розділі «Доклінічні дані», на сьогодні не спостерігались в клінічних дослідженнях препарату Еврісді при СМА.
Подовження QT
Aналіз фармакокінетики/фармакодинаміки показав відсутність ознак подовження QTc в результаті застосування препарату Еврісді із експозицією в терапевтичному діапазоні, однак немає відповідних даних при застосуванні препарату Еврісді при експозиції, що перевищує терапевтичні рівні.
Термін придатності.
2 роки.
Після відновлення готовий до використання оральний розчин стабільний протягом 64 днів при зберіганні в холодильнику при температурі 2-8 ºС.
Умови зберігання.
Зберігати порошок для орального розчину при температурі не вище 25 ºС в оригінальній упаковці з метою захисту від світла та вологи. Зберігати у недоступному для дітей місці.
Зберігати готовий до використання оральний розчин в холодильнику при температурі 2-8ºС в оригінальній упаковці з метою захисту від світла. Тримати пляшку щільно закритою та завжди зберігати у вертикальному положенні.
Несумісність.
Не спостерігалось несумісності між препаратом Еврісді та рекомендованими шприцами для багаторазового використання для орального введення препарату.
Упаковка.
Скляна пляшка об’ємом 100 мл бурштинового кольору (клас ІІІ відповідно до Фарм. США та Євр. Фарм.) з кришкою білого кольору із функцією захисту від розкриття дітьми (зовнішня оболонка із поліетилену високої щільності; внутрішня оболонка із гомополімеру поліпропілену) з кільцем контролю першого розкриття та вкладкою з поліетилену та полівініліденхлориду у комплекті з 1 втискним адаптером для пляшки, 2 оральними шприцами для багаторазового використання об’ємом 6 мл (кожний у поліетиленовому пакетику) та 2 оральними шприцами для багаторазового використання об’ємом 12 мл (кожний у поліетиленовому пакетику), які вміщені у поліетиленовий пакет. По 1 пляшці та 1комплекту у картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
Ф.Хоффманн-Ля Рош Лтд
Місцезнаходження виробника та адреса місця провадження його діяльності.
Вурмісвег, 4303 Кайсераугст, Швейцарія

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО