ПНЕВМОСИЛ/PNEUMOSIL ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ ПНЕВМОКОКОВОЇ ІНФЕКЦІЇ, ПОЛІСАХАРИДНА, КОН'ЮГОВАНА (10-ВАЛЕНТНА, АДСОРБОВАНА)
 від 2 °С до 8 °С
від 2 °С до 8 °С
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ПНЕВМОСИЛ
PNEUMOSIL
Вакцина для профілактики пневмококової інфекції, полісахаридна, кон’югована
(10-валентна, адсорбована)
Склад:
діючі речовини: Пневмококові полісахаридні очищені антигени кон’юговані;
1 доза (0,5 мл) містить:
сахариди серотипів 1*, 5*, 6A*, 7F*, 9V*, 14*, 19А*, 19F*, 23F* – по 2 мкг;
сахарид серотипу 6В* – 4 мкг;
*кон’югований з білком-носієм CRM197 19–48 мкг;
допоміжні речовини: алюміній (у вигляді алюмінію фосфату), L-гістидин, бурштинова кислота, натрію хлорид, полісорбат-20, вода для ін’єкцій.
Лікарська формаСуспензія для ін’єкцій.
Основні фізико-хімічні властивості: білувата суспензія, яка при зберіганні утворює осад і не містить сторонніх частинок/флокул.
Фармакотерапевтична група
Антиінфекційні засоби для системного застосування. Бактеріальні вакцини. Пневмококовий полісахаридний очищений антиген кон’югований. Код АТС J07A L02.Імунологічні і біологічні властивості.
Вакцина ПНЕВМОСИЛ містить сахариди капсульних антигенівStreptococcus pneumoniae серотипів 1, 5, 6A, 6B, 7F, 9V, 14, 19A, 19F і 23F, індивідуально кон’югованих на нетоксичний дифтерійний білок CRM197. Полісахариди хімічно активуються, а потім ковалентно зв’язуються з білком-носієм CRM197 з утворенням глікокон’югату.
Для отримання вакцини ПНЕВМОСИЛ індивідуальні кон’югати змішують, потім додають полісорбат-20 та алюмінію фосфат. Ефективність вакцини визначається кількістю сахаридних антигенів та співвідношенням сахаридів і білка у окремих глікокон’югатах. Вакцина ПНЕВМОСИЛ відповідає вимогам Всесвітньої організації охорони здоров’я (ВООЗ), Індійській фармакопеї (ІР) та Британській фармакопеї (ВР) за результатами випробувань, проведених за методиками, викладеними у ВООЗ TRS 977, ІР та ВР.
Оцінка фармакокінетичних властивостей не є обов’язковою для вакцин.
Клінічні характеристики
Показання.
Для активної імунізації немовлят та дітей віком від 6 тижнів до 2 років з метою попередження інвазивних захворювань, пневмонії та гострого середнього отиту, викликанихStreptococcus pneumoniae серотипів 1, 5, 6A, 6B, 7F, 9V, 14, 19A, 19F та 23F.
Застосування вакцини ПНЕВМОСИЛ має базуватись на офіційних рекомендаціях із урахуванням ризику захворювань у різних вікових групах, а також епідеміологічних даних у різних географічних зонах.
При проведенні імунізації на території України щодо схем імунізації, протипоказань та взаємодії з іншими медичними препаратами слід керуватися діючими нормативними документами МОЗ України.
Протипоказання.
Підвищена чутливість до діючих та допоміжних речовин або будь-якого компонента вакцини, включаючи дифтерійний анатоксин.
Як і при застосуванні інших вакцин, призначення вакцини ПНЕВМОСИЛ повинно бути відкладене для осіб з гострими захворюваннями, що супроводжуються лихоманкою. Однак наявність легких незначних проявів інфекційних захворювань, таких як застуда, не є підставою для відкладання вакцинації.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Вакцину ПНЕВМОСИЛ можна застосовувати одночасно з іншими вакцинами, як моновалентними, так і комбінованими, що містять антигени дифтерії, правця, кашлюку (цільноклітинний компонент),Haemophilus influenzae типу b(Hib), поліомієліту (ІПВ або ОПВ), ротавірусу, жовтої лихоманки, гепатитуВ, кору та краснухи. Клінічні дослідження показали, що імунні відповіді на введені вакцини і їхні профілі безпеки при одночасному застосуванні не змінилися. Дослідження з іншими пневмококовими кон’югованими вакцинами, що застосовувались одночасно з вакцинами проти паротиту, вітряної віспи, менінгококової інфекції серогруп A, C, W та Y і ротавірусної вакцини, продемонстрували, що імунні відповіді на пневмококові кон’юговані вакцини та вакцини, що були введені одночасно, не змінились. У клінічних випробуваннях інших пневмококових кон’югованих вакцин, що застосовувались одночасно з ротавірусною вакциною або вакциною проти гепатиту А, але вводились в іншу ділянку тіла/ іншим способом, змін у профілі безпеки для немовлят не спостерігалося.
Різні вакцини слід завжди вводити в різні ін’єкційні ділянки.
Дослідження вакцини ПНЕВМОСИЛ були проведені в Індії і Гамбії за участю немовлят та дітей молодшого віку. У клінічному дослідженні фази 1/2, проведеному в Гамбії, не спостерігалось впливу вакцини ПНЕВМОСИЛ на імунну відповідь на будь-який компонент пентавалентної вакцини при одночасному введені.
У клінічному дослідженні фази 3 в Гамбії при одночасному застосуванні вакцини ПНЕВМОСИЛ з вакцинами РПІ, що вводились одночасно під час 3-дозової схеми первинної вакцинації (у віці 6, 10 та 14 тижнів), а саме: пентавалентна вакцина (з цільноклітинним кашлюковим компонентом) (DTwP-HepB-Hib), вакцина проти поліомієліту (ОПВ, ІПВ) та пероральна вакцина проти ротавірусу, – не менша ефективність імунних відповідей, викликаних вакцинами РПІ, була продемонстрована для всіх вакцин РПІ.
Бустерну дозу вакцини ПНЕВМОСИЛ вводили одночасно зі стандартними вакцинами РПІ в Гамбії (вакцина проти кору і краснухи та вакцина проти вірусу жовтої лихоманки). Введення бустерної дози не вплинуло на ефективність імунних відповідей на одночасно введені вакцини РПІ. Високий рівень серологічної відповіді на вакцину проти вірусу жовтої лихоманки в групі вакцинованих препаратом ПНЕВМОСИЛ вказує на те, що вакцина ПНЕВМОСИЛ не перешкоджає імунній відповіді на вакцину проти вірусу жовтої лихоманки. Немає відомих опублікованих даних щодо одночасного введення іншої пневмококової кон’югованої вакцини з вакциною проти вірусу жовтої лихоманки.
Особливості застосування.
Рекомендовано перед щепленням збирати анамнез щодо виникнення будь-яких симптомів та побічних реакцій після попереднього щеплення.
Вакцину ПНЕВМОСИЛ не можна застосовувати внутрішньосудинно та не можна вводити в ділянку сідниць.
Вакцину ПНЕВМОСИЛ не можна вводити внутрішньовенно, підшкірно або внутрішньошкірно, оскільки безпека та імуногенність цих способів введення не оцінювались.
Як і для всіх ін’єкційних вакцин, відповідна допомога та медичний нагляд завжди повинні бути легкодоступними у разі виникнення рідкісних анафілактичних реакцій після введення вакцини. Тому пацієнти повинні бути під медичним наглядом не менше 30 хвилин після вакцинації.
Як і у разі застосування всіх ін’єкційних вакцин, відповідне медичне лікування та нагляд за пацієнтом завжди повинні бути у доступі у разі виникнення рідкісної анафілактичної реакції після введення вакцини.
НЕГАЙНЕ ВВЕДЕННЯ АДРЕНАЛІНУ (1:1000) ПРИ ВИНИКНЕННІ ГОСТРОЇ АНАФІЛАКТИЧНОЇ РЕАКЦІЇ НА БУДЬ-ЯКИЙ КОМПОНЕНТ ВАКЦИНИ. При тяжкій анафілаксії внутрішньом’язово чи підшкірно вводиться первинна доза адреналіну, що становить 0,1–0,5 мг (0,1–0,5 мл ін’єкції 1:1000). Разова доза не повинна перевищувати 1 мг (1мл). Для дітей, у т. ч. немовлят, рекомендована доза адреналіну становить 0,01 мг/кг (0,01мл/кг ін’єкції 1:1000). Разова доза для дітей не повинна перевищувати 0,5 мг (0,5 мл). Основою лікування тяжкої анафілаксії є негайне введення адреналіну, що може врятувати життя. Адреналін слід застосовувати при перших підозрах на виникнення анафілаксії.
Як і при застосуванні інших вакцин, призначення препарату ПНЕВМОСИЛ повинно бути відкладене для осіб з гострими захворюваннями, що супроводжуються лихоманкою. Однак наявність легких незначних проявів інфекційних захворювань, таких як застуда, не є підставою для відкладання вакцинації.
Як і при внутрішньом’язовому застосуванні інших ін’єкційних вакцин, ПНЕВМОСИЛ слід призначати з обережністю особам з тромбоцитопенією або порушеннями зсідання крові, а також тим, хто отримує антикоагулянтну терапію.
ПНЕВМОСИЛ не застосовується для лікування активної інфекції.
Як і при застосуванні будь-якої іншої вакцини, захисна імунна відповідь може бути не досягнута у вакцинованих осіб.
Синкопе (непритомність) може виникнути під час або раніше будь-якої ін’єкційної вакцинації як психогенна реакція на голку. Вакцинацію необхідно проводити тільки в положенні вакцинованого сидячи або лежачи та залишити його в тому ж положенні (сидячи або лежачи) протягом 15 хвилин після вакцинації для попередження ризику його травмування.
При призначенні первинної імунізації дуже передчасно народженим немовлятам (≤ 28 тижнів гестації) слід мати на увазі потенційний ризик розвитку у них апное та необхідність контролю за дихальною функцією протягом 48–72 годин після вакцинації, особливо у разі, коли немовля має в анамнезі недорозвиток дихальної системи. Оскільки користь вакцинації для цієї групи немовлят є високою, від вакцинації не слід відмовлятись або затримувати її.
Недоступні дані з безпеки та імуногенності вакцини ПНЕВМОСИЛ для дітей певних груп з високим ризиком інвазивного пневмококового захворювання (наприклад, діти з вродженою чи набутою дисфункцією селезінки, ВІЛ-інфекцією, злоякісними новоутвореннями, нефротичним синдромом). У дітей із зазначених груп може бути знижена імунна відповідь на активну імунізацію внаслідок порушення імунної реактивності. Обмежені дані продемонстрували, що інші пневмококові кон’юговані вакцини викликають імунну відповідь у дітей з ВІЛ, серпоподібноклітинною анемією та у недоношених дітей з профілем безпеки, аналогічним такому у групах з невисоким ризиком. Застосування вакцини ПНЕВМОСИЛ пацієнтам груп високого ризику слід розглядати індивідуально.
Застосування у період вагітності або годування груддю.
Дані щодо застосування вакцини ПНЕВМОСИЛ у період вагітності або годування груддю відсутні.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Не стосується цієї групи.
Спосіб застосування та дози.
Вакцину слід вводити внутрішньом’язово.
Переважним місцем введення є передньолатеральна ділянка стегна для немовлят або дельтоподібний м’яз плеча для дітей молодшого віку.
Одна доза вакцини становить 0,5 мл.
Перед застосуванням вакцину ПНЕВМОСИЛ слід:
- візуально оглянути на наявність будь-яких сторонніх часток та/або змін фізичних властивостей. У разі наявності будь-яких сторонніх домішок і/або при зміні зовнішнього вигляду вакцини такий флакон з препаратом слід утилізувати;
- струсити, щоб гомогенізувати суспензію (отримати однорідну білувату каламутну суспензію), оскільки під час зберігання може утворюватися білий осад з прозорою надосадовою рідиною.
Якщо вакцина була заморожена, її необхідно утилізувати.
ФЛАКОННИЙ ТЕРМОІНДИКАТОР
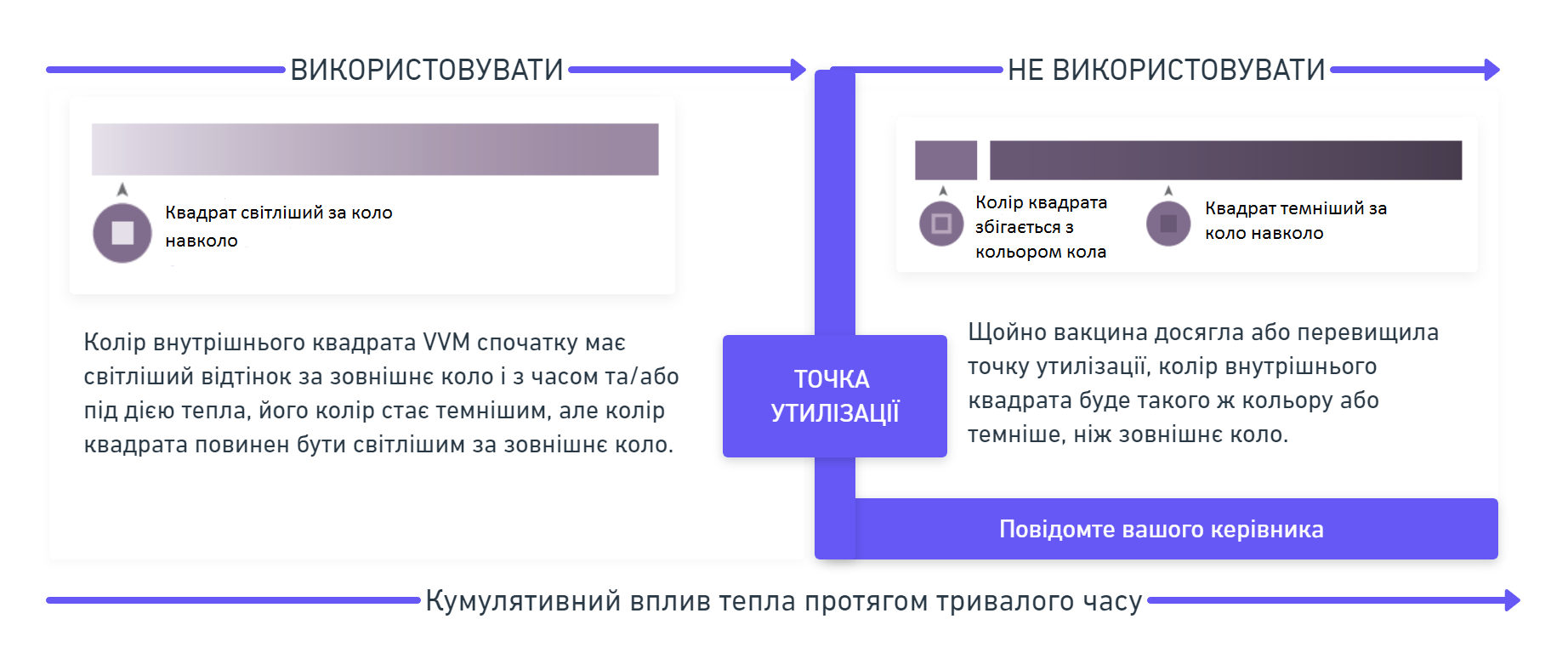
Флаконні термоіндикатори (VVM) розташовані на кришках флаконів вакцини ПНЕВМОСИЛ виробництва Серум Інститут Індії Пвт. Лтд., Індія. Це точка залежності температури від часу показує кумулятивний вплив тепла, якому піддавався флакон з вакциною. Індикатор попереджає кінцевого споживача про погіршення якості вакцини у результаті впливу тепла.
Інтерпретація індикатора VVM проста: основним фактором є колір внутрішнього квадрата, який змінюється з часом. Якщо колір квадрата світліший за коло навколо, вакцину можна використовувати. Якщо колір квадрата та зовнішнього кола став однаковим або темніше кольору зовнішнього кола, вакцину використовувати не можна, її необхідно утилізувати.
Схема імунізації
Схема імунізації вакциною ПНЕВМОСИЛ має базуватися на офіційних рекомендаціях.
Первинна схема вакцинації для немовлят передбачає введення 3-х доз у віці 6, 10 та 14 тижнів або у віці 2, 3 та 4 місяці, або у віці 2, 4 та 6 місяців із введенням бустерної дози у віці 9–10 місяців чи 12–15 місяців або без введення бустерної дози залежно від рекомендованої схеми.
Мінімальний інтервал між дозами становить 4 тижні. Бустерну дозу рекомендується вводити щонайменше через 6 місяців після введення останньої дози первинної схеми вакцинації.
Таблиця 1
Схема вакцинації для немовлят та дітей віком від 6 тижнів до 6 місяців
Схема застосування | Доза 1a,b | Доза 2b | Доза 3b | Доза 4с |
3 дози + 1 | 6 тижнів | 10 тижнів | 14 тижнів | 9–10 місяців або |
3 дози + 0 | 6 тижнів | 10 тижнів | 14 тижнів | - |
a Дозу 1 можна вводити у віці 6 тижнів або у віці 2 місяців.
b Рекомендований інтервал між введеннями – 4–8 тижнів.
c Бустерна (четверта) доза рекомендується щонайменше через 6 місяців після останньої дози первинної схеми вакцинації та може вводитись у віці з 9 місяців та пізніше (бажано у віці 12–15 місяців).
Схема вакцинації для дітей віком від 7 місяців до 2 років, що раніше не були вакциновані вакциною ПНЕВМОСИЛ.
Таблиця 2
Схема вакцинації для невакцинованих дітей віком від 7 місяців до 2 років
Вік при введенні першої дози | Загальна кількість доз по 0,5мл |
7–11 місяців | 3а |
12–24 місяці | 2b |
а Схема вакцинації включає дві дози по 0,5 мл з інтервалом між введеннями не менше 1 місяця. Бустерну (третю) дозу рекомендується вводити на другому році життя з інтервалом не менше 2 місяців після останньої дози первинної вакцинації. b Схема вакцинації включає дві дози по 0,5 мл з інтервалом між введеннями не менше 2 місяців. | |
Діти.
ПНЕВМОСИЛ показаний до застосування дітям віком від 6 тижнів до 2 років (див. розділи «Показання», «Спосіб застосування та дози»). Безпека та ефективність застосування дітям віком до 6 тижнів не встановлені.
Передозування.
Не зафіксовано жодного випадку передозування.
Побічні реакції.
Оцінка безпеки вакцини ПНЕВМОСИЛ базувалась на клінічних дослідженнях із залученням 1 828 здорових дітей для проведення первинної схеми вакцинації, яким було введено 5416 доз. Крім того, 428 дітей після первинної схеми вакцинації отримали бустерну дозу вакцини ПНЕВМОСИЛ. В усіх дослідженнях вакцина ПНЕВМОСИЛ застосовувалася у разі необхідності одночасно з іншими вакцинами, рекомендованими для дітей.
Також безпеку оцінювали у 57 дітей другого року життя, які раніше не були вакциновані; всі діти отримали по 2 дози вакцини.
Вакцину ПНЕВМОСИЛ також було застосовано для бустерної вакцинації 56 дітей, які отримали іншу пневмококову кон’юговану вакцину при первинній схемі вакцинації.
Переважна більшість реакцій, що спостерігалися після вакцинації, були легкого або середнього ступеня тяжкості та короткотривалими.
У більшості досліджень у немовлят після первинної схеми вакцинації спостерігалися такі побічні реакції: біль у місці ін’єкції, лихоманка та дратівливість, – про які повідомлялось приблизно у 49 %, 52 % та 32 % від усіх вакцинованих немовлят відповідно. Після введення подальших доз первинної схеми вакцинації збільшення частоти виникнення або ступеня тяжкості не спостерігалось. Після введення бустерної дози найбільш частою побічною реакцією був біль у місці ін’єкції, який спостерігався приблизно у 8 % від усіх вакцинованих.
У клінічному дослідженні фази 3, проведеному в Індії, у немовлят аналогічно спостерігались біль у місці ін’єкції, лихоманка та дратівливість як найпоширеніші побічні реакції, що виникали під час первинної схеми вакцинації без змін частоти виникнення та ступеня тяжкості після введення наступних доз первинної схеми вакцинації. Більшість побічних реакцій, що спостерігались, були від легкої до помірної інтенсивності та повністю зникли.
Реакції у місці введення і системні реакції після турової вакцинації або бустерної вакцинації на другому році життя були схожими з реакціями, що спостерігалися після первинної схеми вакцинації.
У порівняльних дослідженнях частота та тяжкість місцевих та загальних побічних реакцій, про які повідомлялось протягом 7 днів після вакцинації, були подібними до таких після вакцинації іншими пневмококовими кон’югованими вакцинами.
Побічні реакції (тобто події, які вважаються пов’язаними з вакцинацією) класифікували за частотою для всіх вікових груп. Частоту визначають за такими категоріями:
Дуже часто: ³ 1/10
Часто: ³ 1/100 та < 1/10
Нечасто: ³ 1/1000 та < 1/100
Рідко: ³ 1/10000 та < 1/1000
Дуже рідко: < 1/10000
Невідомо: не можна встановити за наявними даними.
Перелік побічних реакцій наведено у таблиці 3.
Таблиця 3
Клас системи органів | Частота | Побічні явища |
Розлади з боку шлунково-кишкового тракту | Нечасто | Діарея |
Загальні розлади та реакції в місці ін’єкції | Дуже часто | Біль, лихоманка ³ 37,5 °C (аксилярна) |
Часто | Еритема, набряк/ущільнення | |
Нечасто | Лихоманка > 39 °C (аксилярна) | |
Порушення з боку травлення та метаболізму | Часто | Зниження апетиту |
Розлади з боку нервової системи | Часто | Сонливість |
Психічні розлади | Дуже часто | Дратівливість |
Розлади з боку шкіри та підшкірних тканин | Часто | Висип |
Термін придатності.
36 місяців.
Умови зберігання.
Зберігати при температурі від 2 до 8°C.
НЕ ЗАМОРОЖУВАТИ.
Зберігати в недоступному для дітей місці.
Несумісність.
Вакцину ПНЕВМОСИЛ не можна змішувати з іншими вакцинами/ лікарськими засобами в одному шприці.
Упаковка.
По 1 дозі (0,5 мл) суспензії для ін’єкцій у флаконі (ємністю 2 мл); по 50 флаконів в картонній коробці.
По 1 дозі (0,5 мл) суспензії для ін’єкцій у флаконі (ємністю 4 мл); по 50 флаконів в картонній коробці.
Категорія відпуску. За рецептом.
Виробник. Серум Інститут Індії Пвт. Лтд., Індія
Serum Institute of India Pvt. Ltd., India
Місцезнаходження виробника та адреса місця провадження його діяльності.
212/2, Хадапсар, Пуне – 411028, Індія
212/2, Hadapsar, Pune – 411028, India
Заявник.ТОВ «Фарма Лайф», Україна.
Місцезнаходження заявника.
Україна, 79040, м. Львів, вул. Д. Апостола, 2, тел. (032) 297-16-88.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО

