ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ КОРУ, ЕПІДЕМІЧНОГО ПАРОТИТУ ТА КРАСНУХИ, ЖИВА, АТЕНУЙОВАНА (ЛІОФІЛІЗОВАНА)
 від 2 °С до 8 °С. Не заморожувати
від 2 °С до 8 °С. Не заморожувати 

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
Вакцина для профілактики кору, епідемічного паротиту та краснухи, жива атенуйована (ліофілізована)
Склад:
діючі речовини: Measles , Mumps , Rubella vaccine
0,5 мл (1 доза) відновленої вакцини містить:
живий атенуйований вірус кору1 (штам Edmonston-Zagreb) - не менше 1000 CCID50;
живий атенуйований вірус епідемічного паротиту2 (штам Leningrad-Zagreb (L-Z)) - не менше 5000 ССID50;
живий атенуйований вірус краснухи1 (штам Wistar RA27/3) - не менше 1000 CCID50;
1 вирощений на диплоїдних клітинах людини (ДКЛ);
2 вирощений на фібробластах курей, отриманих з яєць, вільних від специфічної патогенної мікрофлори;
допоміжні речовини: желатин (частково гідролізований) - 2,5 %, сорбітол - 5 %,
L-гістидин - 0,21 %, L-аланін - 0,1 %, трицин - 0,3 %, L-аргініну гідрохлорид - 1,6 %, гідролізат лактальбуміну - 0,35 %, мінімальне живильне середовище - достатня кількість;
розчинник (вода для ін’єкцій) - 0,5 мл.
Вакцина може містити слідові кількості неоміцину.
Лікарська формаЛіофілізат для розчину для ін’єкцій з розчинником.
Основні фізико-хімічні властивості:жовтувато-біла крихка маса. Після відновлення розчинником - прозора рідина від світло-жовтого до жовтуватого кольору.
Розчинник - прозора, безбарвна рідина, вільна від видимих часток.
Фармакотерапевтична група. Код АТС .
Комбінована вакцина для профілактики кору, епідемічного паротиту та краснухи, жива атенуйована. Код АТС J07B D52.
Імунологічні і біологічні властивості.
Вакцина для профілактики кору, епідемічного паротиту та краснухи, жива атенуйована (ліофілізована) - жива комбінована вакцина для профілактики кору, епідемічного паротиту та краснухи, що є ліофілізованим комбінованим препаратом атенуйованих вірусів кору (штам Edmonston-Zagreb), епідемічного паротиту (штам Leningrad-Zagreb (L-Z)) та краснухи (штам Wistar RA27/3), одержаних шляхом розмноження в диплоїдних клітинах людини (ДКЛ) (віруси краснухи та кору), на фібробластах курей, отриманих з яєць, вільних від специфічної патогенної мікрофлори (віруси епідемічного паротиту).
Вакцина являє собою суміш живих атенуйованих вірусів кору, епідемічного паротиту та краснухи, стимулює процес виділення антитіл IgG, специфічного до кору, епідемічного паротиту та краснухи, для забезпечення активної імунізації проти цих захворювань.
Клінічні дослідження показують, що вакцина для профілактики кору, епідемічного паротиту та краснухи, жива атенуйована (ліофілізована), є високоімуногенною та загалом добре переноситься.
Оцінка фармакокінетичних властивостей не є обов’язковою для вакцин.
Клінічні характеристики
Показання.
Вакцина для профілактики кору, епідемічного паротиту та краснухи, жива атенуйована (ліофілізована), показана для активної імунізації дітей віком від 12 місяців з метою профілактики кору, епідемічного паротиту та краснухи, а також для ревакцинації. Ревакцинація проводиться з метою досягнення сероконверсії у разі неефективності при первинній вакцинації або підвищення титрів антитіл у осіб, що раніше були вакциновані і показники титрів яких були низькими.
При проведенні імунізації на території України щодо схем імунізації, протипоказань та взаємодії з іншими медичними препаратами слід керуватися діючими нормативними документами МОЗ України.
Протипоказання.
Вакцина для профілактики кору, епідемічного паротиту та краснухи, жива атенуйована (ліофілізована), протипоказана:
- особам, які мають підвищену чутливість до будь-якого з компонентів вакцини (діючої або допоміжних речовин);
- особам з наявністю в анамнезі анафілактичної реакції на попередню дозу даної вакцини;
- особам з анафілактичними чи анафілактоїдними реакціями на неоміцин (вакцина може містити слідові кількості неоміцину) та/або на яєчний білок (гіперчутливість до яєчного білка) в анамнезі;
- особам з надзвичайно рідкісними випадками гіперчутливості на коров’яче молоко;
- вагітним жінкам. Слід уникати вагітності щонайменше протягом 1-го місяця після вакцинації (див. розділ «Застосування у період вагітності або годування груддю»);
- особам з тяжкою імунною недостатністю внаслідок вродженого захворювання, з ВІЛ-інфекцією, тяжкою формою лейкемії чи лімфоми, злоякісною пухлиною, а також тим, хто отримує лікування великими дозами стероїдів, алкілувальними агентами чи антиметаболітами або проходить імунодепресивне терапевтичне опромінення;
- при гострих інфекційних захворюваннях, лейкемії, тяжкій формі анемії та інших тяжких захворюваннях кровоносної системи, тяжких порушеннях функції нирок, декомпенсованих захворюваннях серця;
- за наявності фебрильних станів.
Субфебрильна температура тіла, легкі респіраторні інфекції чи діарея, а також інші несерйозні захворювання не повинні вважатися протипоказаннями.
Імунодефіцит
Вакцина для профілактики кору, епідемічного паротиту та краснухи, жива атенуйована (ліофілізована), не застосовується дітям, матері яких є ВІЛ-інфікованими, до уточнення ВІЛ-статусу дитини, при клінічних стадіях ІІІ та IV ВІЛ-інфекції та помірній або тяжкій імуносупресії.
Після використання всі залишки вакцини та флакони необхідно утилізувати безпечним способом згідно з діючими вимогами щодо утилізації біологічних відходів відповідно до чинних нормативних документів МОЗ України.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
У осіб, які приймають кортикостероїди, інші імунодепресанти або проходять радіотерапію, може не розвинутись оптимальна імунна реакція.
Вакцинацію осіб, які отримували гамма-глобуліни людини чи переливання крові, потрібно відкласти не менш ніж на 3 місяці через імовірну відсутність імунної відповіді внаслідок наявності пасивних антитіл до вірусу кору, епідемічного паротиту та краснухи.
При необхідності отримання туберкулінової проби її потрібно провести до вакцинації або одночасно з нею, оскільки застосування живих атенуйованих вакцин для профілактики кору, епідемічного паротиту та краснухи може спричинити тимчасове пригнічення реакції шкіри на туберкулін. З цієї причини туберкулінову пробу можна проводити не раніше ніж через 4-6тижнів після вакцинації для уникнення хибно негативного результату.
Вакцину для профілактики кору, епідемічного паротиту та краснухи, живу атенуйовану (ліофілізовану), можна вводити одночасно з вакциною для профілактики дифтерії, правця, кашлюку (з цільноклітинним/ацелюлярним компонентом), вакциною для профілактики дифтерії та правця, вакциною для профілактики поліомієліту (ОПВ та ІПВ), вакциною для профілактикиHaemophilus influenzae типу B, вакциною для профілактики гепатиту В.
У разі неможливості одночасного введення вакцини для профілактики кору, епідемічного паротиту та краснухи, живої атенуйованої (ліофілізованої), та інших живих вакцин інтервал між вакцинацією повинен становити щонайменше один місяць.
Якщо вакцина для профілактики кору, епідемічного паротиту та краснухи застосовується одночасно з іншими вакцинами, її необхідно вводити окремо від інших вакцин. Вакцини слід вводити в різні ділянки тіла, різні кінцівки, якщо це не порушує схему імунізації, рекомендовану державними уповноваженими органами охорони здоров’я.
Особливості застосування.
Перш ніж робити ін’єкцію, потрібно зачекати, доки з поверхні шкіри повністю випарується спирт або інші дезінфікуючі засоби, оскільки вони можуть призвести до інактивації ослаблених вірусів, які містяться у вакцині.
Будь ласка, переконайтеся, що вакцина вводиться лише підшкірно.
Внутрішньовенне введення вакцини не допускається за жодних обставин.
Синкопе (непритомність) може виникнути під час або до будь-якої ін’єкційної вакцинації як психогенна реакція на голку. Вакцинацію необхідно проводити тільки в положенні вакцинованого сидячи або лежачи та залишити його в тому ж положенні (сидячи або лежачи) протягом 15 хвилин після вакцинації для попередження ризику його травматизації.
Як і при будь-яких інших щепленнях, особи, яким була введена вакцина, повинні перебувати під наглядом впродовж щонайменше 30 хвилин на випадок розвитку негайної або ранньої алергічної реакції. Окрім обладнання для надання невідкладної допомоги, наприклад подачі кисню, в наявності повинні бути гідрокортизон та антигістамінні препарати. У рідкісних випадках у чутливих осіб може виникнути анафілактичний шок. Початкова доза адреналіну для терапії тяжкої анафілаксії становить 0,1-0,5 мг підшкірно або внутрішньом’язово (0,1-0,5мл розчину, розведеного 1:1000).
Не перевищувати разову дозу 1 мг (1 мл). Рекомендована разова доза адреналіну для дітей, у т. ч. немовлят, становить 0,01 мг/кг маси тіла (0,01 мл/кг маси тіла розчину, розведеного 1:1000). Не перевищувати разову дозу для дітей, яка становить 0,5 мг (0,5 мл).
У разі тяжкої анафілаксії негайне введення адреналіну є надзвичайно важливим і може мати вирішальне значення для збереження життя. Адреналін необхідно вводити при виникненні перших підозр на анафілаксію.
Пацієнтам зі встановленою непереносимістю деяких цукрів необхідно проконсультуватися з лікарем, перш ніж бути щепленими вакциною для профілактики кору, епідемічного паротиту та краснухи, живою атенуйованою (ліофілізованою), оскільки вакцина в своєму складі містить сорбітол.
У осіб, у яких виникла тромбоцитопенія після введення першої дози вакцини, можливі випадки загострення або повторного виникнення тромбоцитопенії після щеплення вакциною для профілактики кору, епідемічного паротиту та краснухи, живою атенуйованою (ліофілізованою). У таких випадках слід добре зважити співвідношення ризику та користі від вакцинації.
Як і у разі введення будь-якої вакцини, достатній рівень імунної відповіді може бути досягнутий не у всіх вакцинованих осіб.
Застосування у період вагітності або годування груддю.
Вакцину для профілактики кору, епідемічного паротиту та краснухи, живу атенуйовану (ліофілізовану), не можна вводити вагітним жінкам.
Існує лише теоретичний ризик ураження плода/дитини (тератогенний ефект) через наявність вірусу краснухи у комбінованій вакцині для профілактики кору, епідемічного паротиту та краснухи, живій атенуйованій (ліофілізованій). Жодного випадку ураження плода/дитини не було зафіксовано при застосуванні вакцини для профілактики кору, епідемічного паротиту та краснухи, живої атенуйованої (ліофілізованої).
Планування вагітності можливе не раніше ніж через один місяць після вакцинації.
В іншому разі вакцинація проводиться після закінчення вагітності.
Випадкова вакцинація вакциною для профілактики кору, епідемічного паротиту та краснухи, живою атенуйованою (ліофілізованою), вагітної не є підставою для переривання вагітності.
Жоден випадок синдрому вродженої краснухи не був зафіксований у вагітних жінок, які випадково були щеплені вакциною, що містить вірус краснухи, на ранніх термінах вагітності.
Дослідження для осіб, які годують груддю, не проводились.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Дослідження впливу на здатність керувати автотранспортом та працювати з іншими механізмами не проводилися.
Спосіб застосування та дози.
При проведенні імунізації на території України щодо схем імунізації, протипоказань та взаємодії з іншими медичними препаратами слід керуватися діючими нормативними документами МОЗ України.
Вакцину для профілактики кору, епідемічного паротиту та краснухи, живу атенуйовану (ліофілізовану), слід вводити глибоко підшкірно у передньо-бокову верхню частину стегна дітям раннього віку (віком від 1 до 3 років) та у передпліччя дітям старшого віку, підліткам та дорослим.
Одна доза відновленої вакцини становить 0,5 мл незалежно від віку пацієнта.
Перша вакцинація рекомендована у віці 12 місяців.
Другу дозу вакцини для профілактики кору, епідемічного паротиту та краснухи, живої атенуйованої (ліофілізованої), зазвичай рекомендується вводити у будь-який час до 6-річного віку (4-6років). Консультативний комітет з методики вакцинації (АСІР) рекомендує вводити першу дозу вакцини для профілактики кору, епідемічного паротиту та краснухи, живої атенуйованої (ліофілізованої), у віці 12-15 місяців, другу - у віці 4-6 років.
Перед застосуванням вакцину необхідно відновити (розчинити) шляхом додавання всього вмісту ампули розчинника, що додається, у флакон з ліофілізатом. Розчинник, що постачається з вакциною, спеціально розроблено для використання з цією вакциною. Для розчинення вакцини слід застосовувати виключно розчинник, який поставляється з вакциною для профілактики кору, епідемічного паротиту та краснухи, живою атенуйованою (ліофілізованою). Воду для ін’єкцій, розчинники для інших типів вакцин або розчинник для вакцини для профілактики кору, епідемічного паротиту та краснухи іншого виробника НЕМОЖНА використовувати з цією метою. Використання неналежного розчинника може призвести до псування вакцини та/або розвитку серйозних реакцій у осіб, яким буде введено цю вакцину.
Перед введенням розчинник (воду для ін’єкцій) та відновлену вакцину необхідно оглянути на наявність будь-яких сторонніх часток та/або зміни фізичних властивостей. У разі наявності будь-яких відхилень, утилізуйте розчинник чи відновлену вакцину.
Вакцину слід ввести відразу після відновлення. Якщо відновлена вакцина не була використана негайно, її необхідно зберігати у темному місці при температурі від 2 до 8 °C та можна використовувати лише протягом 6 годин з моменту відновлення.
Невикористаний розчин необхідно утилізувати.
Флаконний термоіндикатор слід утилізувати після відновлення вакцини.
Важливо застосовувати окремий стерильний шприц та голку для кожного пацієнта.
Інструкція щодо відновлення вакцини розчинником
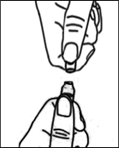
(А) Відломлювати верхню частину ампули можна лише в точці відлому.
1. Лівою рукою тримайте ампулу за нижню частину так, щоб кольорова цятка на ампулі була перед вами. |
|
2. Правою рукою затисніть верхню частину ампули між великим пальцем і зігнутим вказівним пальцем. |
|
3. Кольорова цятка при цьому повинна бути закрита великим пальцем. |
|
4. Тепер ампулу можна відкрити, відламавши шийку у напрямку вказівного пальця а саме: великим пальцем правої руки прикласти силу до верхньої частини ампули, одночасно надаючи протидію вказівним пальцем лівої руки, переломити ампулу в напрямку від себе. Прикладена сила повинна бути постійною та пропорційною, щоб не роздавити ампулу. |
|
(B) Відновлення ліофілізату у флаконі.
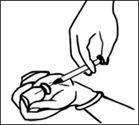
1. Наберіть розчинник із ампули у шприц, пробийте голкою пробку флакона і повільно введіть розчинник у флакон. |
|
2. Від’єднайте шприц, залишивши при цьому голку у пробці флакона. Через 15 секунд вийміть голку. |
|
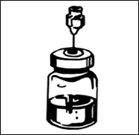
3. Плавно покрутіть флакон між долонями поки матеріал в ньому не розчиниться. Не струшуйте флакон, оскільки це призводить до утворення піни. |
|
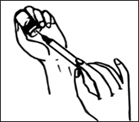
4. Наберіть відновлений вміст флакона у шприц. Вакцина готова для введення підшкірно. |
|
Діти.
Вакцину для профілактики кору, епідемічного паротиту та краснухи, живу атенуйовану (ліофілізовану), рекомендовано до застосування у педіатричній практиці для імунізації дітей віком від 12 місяців (див. розділи «Показання» та «Спосіб застосування та дози»).
Передозування.
Не зафіксовано жодного випадку передозування.
Побічні реакції.
Тип та інтенсивність тяжких побічних реакцій не відрізняються значно від реакцій на вакцину для профілактики кору, епідемічного паротиту та краснухи, що описані окремо.
Побічні реакції, що пов’язані з наявністю компонента кору
Протягом 24годин після вакцинації може виникнути помірний біль та набряк у місці ін’єкції. У більшості випадків вони самостійно зникають за два-три дні без додаткової медичної допомоги. Легка лихоманка може виникнути після щеплення у 5-15 % випадків через 7-12днів після введення вакцини. Вона триває від 1 до 2 днів. Висипання виникає приблизно у 2 % вакцинованих осіб, зазвичай через 7-10 днів після вакцинації, та триває 2 дні. Легкі побічні реакції виникають рідше після введення другої дози вакцини, що містить вірус кору. Здебільшого вони виникають лише у осіб, в яких не виробився захист після введення першої дози вакцини. Про випадки енцефаліту після вакцинації проти кору повідомлялось з частотою приблизно один випадок на мільйон введених доз, хоча причинно-наслідковий зв’язок не доведений.
Побічні реакції, що пов’язані з наявністю компонента епідемічного паротиту.
Компонент епідемічного паротиту може викликати паротит та субфебрильну температуру тіла. Також можуть виникати фебрильні судоми та орхіт. Однак помірна лихоманка виникає рідко, а асептичний менінгіт - дуже рідко. Асоційований з вакциною менінгіт минає менш ніж за 1 тиждень без жодних наслідків. Дебют асептичного менінгіту відстрочений, що може обмежити здатність виявляти такі випадки пасивним спостереженням. Асоційований з вакциною менінгіт спостерігається на 15-35 день після імунізації.
Побічні реакції, що пов’язані з наявністю компонента краснухи.
Компонент краснухи може викликати набір симптомів у вигляді артралгії (25 %) та артриту (10 %) у підлітків і дорослих жіночої статі. Симптоми зазвичай тривають від декількох днів до 2тижнів. Але такі побічні реакції дуже рідко спостерігаються у дітей та чоловіків, яким було введено вакцину для профілактики кору, епідемічного паротиту та краснухи, живу атенуйовану (ліофілізовану) (0-3 %). Симптоми зазвичай з’являються через 1-3 тижні після вакцинації та тривають від 1 дня до 2 тижнів. Часто реєструються субфебрильна температура тіла та висипання, лімфаденопатія, міалгія та парестезія. Тромбоцитопенія є рідкісним явищем: менше ніж 1випадок на 30000введених доз вакцини. Анафілактичні реакції також рідко трапляються. У чутливих осіб вакцина зрідка може викликати алергічну реакцію (кропив’янка, свербіж та алергічне висипання) протягом 24годин після вакцинації. В клінічній практиці зафіксовано виключні випадки не пов’язаних з вакциною реакцій, що впливали на ЦНС. Водночас такі більш серйозні реакції не були безпосередньо пов’язані з вакцинацією.
Також після вакцинації вакциною для профілактики кору, епідемічного паротиту та краснухи, живою атенуйованою (ліофілізованою), можливі такі побічні реакції: головний біль, дратівливість, сонливість, катаральні явища.
Побічні реакції класифікуються за частотою таким чином:
Дуже часто: ³1/10
Часто: ³1/100 та <1/10
Нечасто: ³1/1000 та <1/100
Рідко: ³1/10000 та <1/1000
Дуже рідко: <1/10000
Невідомо: не можна приблизно підрахувати за наявними даними.
Клас системи органів | Частота | Побічні явища |
Побічні реакції, що пов’язані з наявністю компонента кору | ||
Загальні розлади та реакції в місці ін’єкції | Дуже часто | Лихоманка |
Невідомо | Біль та набряк у місці ін’єкції | |
Порушення з боку шкіри і підшкірної клітковини | Часто | Висипання |
Порушення з боку нервової системи | Дуже рідко | Енцефаліт |
Побічні реакції, що пов’язані з наявністю компонента епідемічного паротиту | ||
Інфекції та інвазії | Дуже рідко | Асептичний менінгіт |
Невідомо | Паротит | |
Невідомо | Орхіт | |
Загальні розлади та реакції в місці ін’єкції | Рідко | Лихоманка |
Рідко | Субфебрильна температура тіла | |
Порушення з боку нервової системи | Невідомо | Фебрильні судоми |
Побічні реакції, що пов’язані з наявністю компонента краснухи | ||
Порушення з боку скелетно-м’язової та сполучної тканини | Дуже часто | Артралгія (підлітки та дорослі жіночої статі) |
Часто | Артрит (підлітки та дорослі жіночої статі) | |
Часто | Міалгія | |
Часто | Парестезія | |
Дуже рідко | Артралгія та артрит (діти та чоловіки) | |
Загальні розлади та реакції в місці ін’єкції | Часто | Субфебрильна температура тіла |
Порушення з боку шкіри і підшкірної клітковини | Часто | Висипання |
Порушення з боку кровоносної та лімфатичної систем | Часто | Лімфаденопатія |
Дуже рідко | Тромбоцитопенія | |
Порушення з боку імунної системи | Рідко | Анафілактичні реакції |
Рідко | Кропив’янка | |
Порушення з боку шкіри та підшкірної клітковини | Рідко | Висипання |
Рідко | Свербіж | |
Порушення з боку нервової системи | Невідомо | Головний біль, дратівливість, сонливість |
Порушення з боку органів дихання | Невідомо | Катаральні явища |
Термін придатності.
Для вакцини (ліофілізат для розчину для ін’єкцій) - 30 місяців.
Для розчинника (вода для ін’єкцій) - 5 років.
Відновлену вакцину слід використати негайно. Якщо відновлена вакцина не була використана негайно, її необхідно зберігати у темному місці при температурі від 2 до 8 °C та можна використовувати лише протягом 6 годин з моменту відновлення.
Невикористаний розчин необхідно утилізувати.
Умови зберігання.
Зберігати у захищеному від світла місці при температурі від 2 до 8 °C.
Розчинник (вода для ін’єкцій) можна зберігати в холодильнику або при кімнатній температурі, не заморожувати.
Несумісність.
За відсутності досліджень сумісного використання вакцину не слід змішувати з іншими лікарськими засобами.
Упаковка.
Ліофілізат для розчину для ін’єкцій у флаконах з темного скла, USP типу 1, ємністю 5 мл, закритих пробками з бромбутилкаучуку та алюмінієвими кришками flip-off. Розчинник в ампулах скляних з прозорого, безбарвного скла, USP типу 1, ємністю 1 мл, 3 мл або 5 мл.
По 1 дозі ліофілізату для розчину для ін’єкцій у флаконі в комплекті з розчинником (вода для ін’єкцій) по 0,5 мл в ампулі, або по 2 дози ліофілізату для розчину для ін’єкцій у флаконі в комплекті з розчинником (вода для ін’єкцій) по 1 мл в ампулі, або по 5 доз ліофілізату для розчину для ін’єкцій у флаконі в комплекті з розчинником (вода для ін’єкцій) по 2,5 мл в ампулі, або по 10 доз ліофілізату для розчину для ін’єкцій у флаконі в комплекті з розчинником (вода для ін’єкцій) по 5 мл в ампулі;
1 флакон з ліофілізатом для розчину для ін’єкцій та 1 ампула з розчинником (вода для ін’єкцій) в картонній коробці;
10 флаконів з ліофілізатом для розчину для ін’єкцій в картонній коробці та 10 ампул з розчинником (вода для ін’єкцій) в контурній чарунковій упаковці в окремій картонній коробці.
ФЛАКОННИЙ ТЕРМОІНДИКАТОР
| Внутрішній квадрат світліший за зовнішнє коло. Якщокінцева дата терміну придатності ще не настала,ВИКОРИСТОВУЙТЕ вакцину. |
| Пізніше, внутрішній квадрат все ще світліший за зовнішнє коло.Якщо кінцева дата терміну придатності ще не настала,ВИКОРИСТОВУЙТЕ вакцину. |
| Термін утилізації: внутрішній квадрат за кольором збігається з зовнішнім колом. НЕ використовуйте вакцину. |
| Після настання терміну утилізації: Внутрішній квадрат темніший за зовнішнє коло. НЕ використовуйте вакцину. |
Флаконні термоіндикатори (VVM) розташовані на кришках вакцини для профілактики кору, епідемічного паротиту та краснухи, живої атенуйованої (ліофілізованої), що постачається компанією ТОВ«Фарма Лайф» (пакування із форми in bulk фірми-виробника Серум Інститут Індії Пвт. Лтд., Індія), Україна. Флаконні термоіндикатори чутливі до часу та температури й показують результат кумулятивного теплового впливу, якому піддавався флакон з вакциною. Вони попереджають кінцевого користувача про те, що флакон з вакциною міг піддаватися такому тепловому впливові, який міг погіршити якість вакцини до неприйнятного рівня.
Інтерпретувати покази флаконних термоіндикаторів дуже просто. Сфокусуйтесь на квадраті в центрі. Його колір поступово змінюватиметься. Коли колір цього квадрата світліший за колір кола навколо, вакцину можна використовувати. Якщо колір квадрата у центрі збігається з кольором кола навколо або темніший, флакон з вакциною необхідно утилізувати.
Категорія відпуску. За рецептом.
Виробник. ТОВ «Фарма Лайф» (пакування із формиin bulk фірми-виробника Серум Інститут Індії Пвт. Лтд., Індія), Україна.
Заявник.ТОВ «Фарма Лайф», Україна.
Місцезнаходження виробника/заявника та адреса місця провадження його діяльності.Україна, 79040, м. Львів, вул. Д. Апостола, 2, тел. (032) 297-16-88.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО