ІМФІНЗІ
 від 2 °С до 8 °С. Не заморожувати
від 2 °С до 8 °С. Не заморожувати 

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ІМФІНЗІ
(IMFINZI®)
Склад:
діюча речовина: дурвалумаб;
1 мл концентрату для розчину для інфузій містить 50 мг дурвалумабу;
1 флакон з 2,4 мл концентрату для розчину для інфузій містить 120 мг дурвалумабу;
1 флакон з 10 мл концентрату для розчину для інфузій містить 500 мг дурвалумабу;
допоміжні речовини: L-гістидин, L-гістидину гідрохлориду моногідрат, α,α-трегалози дигідрат, полісорбат 80, вода для ін’єкцій.
Лікарська формаКонцентрат для розчину для інфузій.
Основні фізико-хімічні властивості:розчин від прозорого до опалесцентного, від безбарвного до світло-жовтого кольору, вільний або практично вільний від видимих часток.
Фармакотерапевтична група
Антинеопластичні засоби, моноклональні антитіла. Код АТС L01X C28.
Фармакологічні властивості
Механізми дії
Експресія ліганду запрограмованої смерті клітин 1-го типу (PD-L1) індукується запальними сигналами (наприклад гамма-інтерферонами) та може відбуватися як на пухлинних клітинах, так і на пухлиноасоційованих імунних клітинах із мікрооточення пухлини. PD-L1 блокує функції й активацію Т-клітин за рахунок взаємодії з рецепторами PD-1 і CD80 (B7.1). Зв’язуючись з цими рецепторами, PD-L1 зменшує цитотоксичну активність Т-клітин, проліферацію та вироблення цитокінів.
Дурвалумаб— це людський імуноглобулін G1 каппа (IgG1K), моноклональне антитіло, яке зв’язується з PD-L1 і блокує взаємодію PD-L1 з PD-1 або CD80 (В7.1). Блокада взаємодій PD-L1/PD-1 і PD-L1/CD80 припиняє пригнічення імунних реакцій і при цьому не індукує антитілозалежну клітиноопосередковану цитотоксичність (АЗКЦ).
Блокада дурвалумабом PD-L1 призводила до посилення активації Т-клітин у дослідженняхin vitro, а також зменшувала розміри пухлини в мишей із пересадженою від людини пухлиною та на моделях із імуноклітинними ксенотрансплантатами.
Значення AUC, Ctrough, та Cmax у рівноважному стані в пацієнтів, яким вводили 1500мг кожні 4 тижні, були, відповідно, на 6% вище, 19% нижче та 55% вище, ніж відповідні показники в пацієнтів, яким вводили 10мг/кг кожні 2 тижні. З огляду на моделювання даних фармакокінетики та впливу на безпеку, немає прогнозованих клінічно значущих відмінностей в ефективності та безпеці при застосуванні доз 1500мг кожні 4 тижні та 10мг/кг кожні 2 тижні в пацієнтів із масою тіла >30кг, які хворіють на НДРЛ.
Клінічні дослідження
Недрібноклітинний рак легень (НДРЛ)
Ефективність ІМФІНЗІ оцінювали в дослідженні PACIFIC (NCT02125461)— багатоцентровому, рандомізованому, подвійно сліпому плацебо-контрольованому дослідженні за участю пацієнтів із нерезектабельним НДРЛ IIIстадії, які завершили щонайменше 2 цикли конкурентної платиновмісної хіміотерапії та дефінітивної променевої терапіїв межах 42днів до початку застосування досліджуваного лікарського засобу та мали 0 або 1бал за шкалою ВООЗ для оцінки загального стану. У це дослідження не включали пацієнтів із прогресуванням захворювання після конкурентної хіміопроменевої терапії, з активним або задокументованим перенесеним протягом 2років перед початком дослідження аутоімунним захворюванням або із захворюваннями, які потребували терапії системними імуносупресорами. Перед рандомізацією пацієнтів стратифікували за статтю, віком (<65років і ≥65років) і анамнезом куріння (курці та некурці). Пацієнти були рандомізовані у співвідношенні 2:1 для отримання або лікарського засобу ІМФІНЗІ в дозі 10мг/кг, або плацебо внутрішньовенно кожні 2тижні протягом 12місяців або до появи ознак неприйнятної токсичності чи підтвердження прогресування захворювання за критеріями RECIST1.1. Стан пухлини оцінювали кожні 8тижнів. Основними показниками ефективності були: виживаність без прогресування (ВБП), оцінена BICR за критеріями RECIST1.1, та загальна виживаність (ЗВ). Додатковими показниками ефективності були ЗЧВ і ТВ, оцінені BICR.
Всього було рандомізовано 713 пацієнтів: 476— у групу ІМФІНЗІ та 237— у групу плацебо. Характеристики вибірки пацієнтів були такими: середній вік— 64роки (діапазон від 23 до 90 років); 70%— чоловіки; 69%— представники європеоїдної раси, 27%— азіати; 16%— активні курці, 75%— колишні курці, 9%— ніколи не курили; 51% мали 1 бал за шкалою ВООЗ для оцінки загального стану; 53% мали стадію IIIA, а 45%— стадію IIIB; 46%— плоскоклітинний і 54%— неплоскоклітинний рак. Усі пацієнти пройшли дефінітивну променеву терапію згідно з протоколом, 92% з них отримали загальну дозу опромінення від 54 до 66Гр; 99% пацієнтів паралельно отримували хіміотерапію на основі препаратів платини (55% на основі цисплатину, 42% на основі карбоплатину, а 2% змінили цисплатин на карбоплатин).
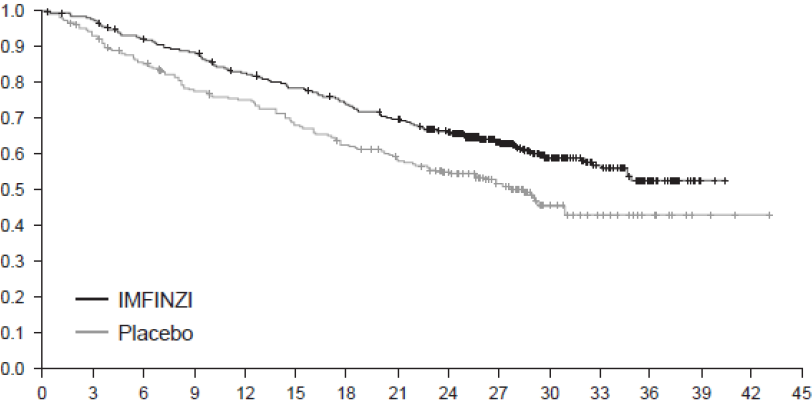
Попередньо встановлений проміжний аналіз ЗВ, що охоплював 299 подій (61% від усієї запланованої кількості подій), продемонстрував статистично значуще покращення ЗВ у пацієнтів, рандомізованих у групу ІМФІНЗІ, в порівнянні з групою плацебо. Попередньо встановлений проміжний аналіз ВБП, що охоплював 371 подію (81% від усієї запланованої кількості подій), продемонстрував статистично значуще покращення ВБП у пацієнтів, рандомізованих у групу ІМФІНЗІ, в порівнянні з групою плацебо. У таблиці1 і на рисунку узагальнено результати ефективності, отримані в дослідженні PACIFIC.
Таблиця1
Результати ефективності, отримані в дослідженні PACIFIC
Кінцева точка | ІМФІНЗІ (N=476)1 | Плацебо (N=237)1 |
Загальна виживаність (ЗВ)2 | ||
Кількість смертей | 183 (38%) | 116 (49%) |
Медіана, місяці (95% ДІ) | NR (34,7-NR) | 28,7 (22,9-NR) |
Відношення ризиків (95% ДІ)3 | 0,68 (0,53-0,87) | |
p-значення3,4 | 0,0025 | |
Виживаність без прогресування (ВБП)5,6 | ||
Кількість (%) пацієнтів, у яких було зареєстровано прогресування захворювання | 214 (45%) | 157 (66%) |
Медіана, місяці (95% ДІ) | 16,8 (13,0-18,1) | 5,6 (4,6-7,8) |
Відношення ризиків (95% ДІ)3,7 | 0,52 (0,42-0,65) | |
p-значення3,8 | <0,0001 | |
1У вибірці з усіх пацієнтів, що потребували лікування (ІТТ), у 7% учасників із групи ІМФІНЗІ та в 10% учасників із групи плацебо BICR не виявили проявів захворювання згідно з критеріями RECIST1.1.
2Показники ЗВ базуються на результатах проміжного аналізу ЗВ, проведеного після того, як протягом 46місяців від початку дослідження було зареєстровано 299смертей пацієнтів.
3Двостороннє р-значення було розраховано на основі логарифмічного рангового критерію, стратифікованого за статтю, віком і анамнезом куріння.
4У порівнянні зі встановленим для проміжного аналізу значенням α=0,00274 (функція витрат Лан де Метса наближається до граничних критеріїв О’Брайєна— Флемінга).
5За оцінкою BICR, згідно з критеріями RECIST1.1.
6Показники ВБП базуються на результатах проміжного аналізу ВБП, проведеного після того, як протягом 33місяців від початку дослідження було зареєстровано 371випадок прогресування захворювання або смерті.
7Оцінка розподілу методом Пайка.
8У порівнянні зі встановленим для проміжного аналізу значенням α=0,011035 (функція витрат Лан де Метса наближається до граничних критеріїв О’Брайєна— Флемінга).
Рисунок 1. Криві загальної виживаності пацієнтів у дослідженні PACIFIC, отримані методом Каплана— Мейера.
Ймовірність ЗВ |
|
Час від рандомізації (місяці) |
IMFINZI - ІМФІНЗІ
Placebo - Плацебо
Кількість пацієнтів у групі ризику
Місяць | 0 | 3 | 6 | 9 | 12 | 15 | 18 | 21 | 24 | 27 | 30 | 33 | 36 | 39 | 42 | 45 |
ІМФІНЗІ | 476 | 464 | 431 | 415 | 385 | 364 | 343 | 319 | 274 | 210 | 115 | 57 | 23 | 2 | 0 | 0 |
Плацебо | 237 | 220 | 198 | 178 | 170 | 155 | 141 | 130 | 117 | 78 | 42 | 21 | 9 | 3 | 1 | 0 |
Дрібноклітинний рак легень (ДРЛ)
Ефективність застосування лікарського засобу ІМФІНЗІ в комбінації з етопозидом та карбоплатином або цисплатином у пацієнтів із поширеним ДРЛ (пДРЛ), які раніше не отримували лікування, оцінювали під час рандомізованого, багатоцентрового, контрольованого за активним лікарським засобом, відкритого дослідження CASPIAN (NCT03043872). Відбору підлягали пацієнти, які мали 0 або 1бал за шкалою ВООЗ для оцінки загального стану та підходили для отримання хіміотерапії препаратами платини як терапії першої лінії при лікуванні ДРЛ. У дослідження включали пацієнтів з асимптоматичними або пролікованими метастазами в головному мозку. Препарат платини дослідник обирав на свій розсуд, беручи до уваги розрахований кліренс креатиніну. У дослідження не включалися пацієнти, які раніше отримували променеву терапію пухлин органів грудної клітки; мали в анамнезі активний первинний імунодефіцит, аутоімунні захворювання, в тому числі паранеопластичний синдром, активні або перенесені задокументовані аутоімунні або запальні захворювання; отримували системні імуносупресори в 14-денний період до введення першої дози досліджуваного лікарського засобу, за винятком фізіологічної дози системних кортикостероїдів.
Рандомізацію стратифікували за запланованим препаратом платини в 1-му циклі лікування (карбоплатин або цисплатин).
Для оцінки ефективності при пДРЛ порівнювали такі схеми лікування:
· ІМФІНЗІ у дозі 1500мг та, за вибором дослідника, карбоплатин (AUC 5 чи 6мг/мл/хв) або цисплатин (75-80мг/м2) у день1, а також етопозид (80-100мг/м2) внутрішньовенно у дні1, 2 та 3 кожного 21-денного циклу протягом 4циклів, після чого вводили ІМФІНЗІ в дозі 1500мг кожні 4тижні до прогресування захворювання чи появи неприйнятних проявів токсичності, або,
· за вибором дослідника, карбоплатин (AUC 5 або 6мг/мл/хв) або цисплатин (75-80мг/м2) у день1, а також етопозид (80-100мг/м2) внутрішньовенно у дні1, 2 та 3 кожного 21-денного циклу протягом 6циклів. Після завершення хіміотерапії на розсуд дослідника застосовували профілактичне опромінення черепа (PCI).
Застосування лікарського засобу ІМФІНЗІ як монотерапії дозволялося й після прогресування захворювання, якщо клінічний стан був стабільним і пацієнт, на думку дослідника, отримував від цього клінічну користь.
Основним критерієм ефективності був показник загальної виживаності (ЗВ) при застосуванні лікарського засобу ІМФІНЗІ в комбінації з хіміотерапією порівняно з таким при застосуванні лише хіміотерапії. Додатковими критеріями ефективності були оцінювані дослідником показники виживаності без прогресування (ВБП) та частоти об’єктивної відповіді (ЧОВ) згідно з Критеріями оцінки відповіді солідних пухлин на лікування (RECIST) 1.1.
Характеристики вибірки пацієнтів були такими: середній вік— 63 роки (діапазон: 28-82); 40% — вік ≥65років; 70% — чоловіки; 84% — представники європеоїдної раси, 15% — монголоїдної та 0,9% — негроїдної; 65% — 1 бал за шкалою ВООЗ/ECOG для оцінки загального стану; 93% — колишні/активні курці. На вихідному рівні 90% пацієнтів мали захворювання IVстадії, а 10% — мали метастази в головному мозку. Загалом 25% пацієнтів отримували цисплатин, а 74% — карбоплатин. Із групи застосування лише хіміотерапії 57% пацієнтів пройшли 6циклів хіміотерапії, а 8% пацієнтів перенесли PCI.
Дані щодо ЗВ наведено в таблиці2 та на рисунку2.
Таблиця2
Дані щодо ЗВ в дослідженні CASPIAN
Кінцева точка | ІМФІНЗІ плюс етопозид та карбоплатин або цисплатин (n=268) | Етопозид та карбоплатин або цисплатин (n=269) |
Загальна виживаність (ЗВ) | ||
Кількість смертей (%)1 | 155 (58) | 181 (67) |
Медіана ЗВ (місяці) (95% ДІ) | 13,0 (11,5-14,8) | 10,3 (9,3-11,2) |
Відношення ризиків (95% ДІ)2 | 0,73 (0,59-0,91) | |
p-значення1 | 0,0047 | |
1 На момент планового проміжного аналізу було зареєстровано 336явищ ЗВ (79% від усієї запланованої кількості явищ), а граничне значення для декларування ефективності (0,0178) було встановлено на підставі альфа-витратної функції Лана - ДеМетса з граничними критеріями О’Браєна - Флемінга.
2 Аналіз проводили за допомогою стратифікованого логрангового критерію з поправкою на заплановану терапію препаратами платини в 1-му циклі (карбоплатин або цисплатин), а також із застосуванням коефіцієнта рангової кореляції.
Рисунок 2. Криві загальної виживаності пацієнтів у дослідженні CASPIAN, отримані методом Каплана - Мейера.

IMFINZI + chemotherapy - ІМФІНЗІ + хіміотерапія
chemotherapy - хіміотерапія
Censored - оцінено
Кількість пацієнтів в групі ризику | 0 | 3 | 6 | 9 | 12 | 15 | 18 | 21 | 24 |
ІМФІНЗІ + хіміотерапія | 268 | 244 | 214 | 177 | 116 | 57 | 25 | 5 | 0 |
хіміотерапія | 269 | 242 | 209 | 153 | 82 | 44 | 17 | 1 | 0 |
При оцінюванні ВБП дослідником (96% від усієї запланованої кількості явищ) відношення ризиків (ВР) становило 0,78 (95% ДІ: 0,65-0,94), медіана ВБП — 5,1місяця (95% ДІ: 4,7-6,2) у групі застосування ІМФІНЗІ в комбінації з хіміотерапією та 5,4 місяця (95% ДІ: 4,8-6,2) в групі застосування лише хіміотерапії. Оцінювана дослідником підтверджена ЧОВ становила 68% (95% ДІ: 62-73%) у групі застосування ІМФІНЗІ в комбінації з хіміотерапією та 58% (95% ДІ: 52-63%) в групі застосування лише хіміотерапії.
В дослідницькому підгруповому аналізі ЗВ залежно від запланованої хіміотерапії препаратами платини, застосованої в 1-му циклі, ВР становив 0,70 (95% ДІ 0,55-0,89) у пацієнтів, які отримували карбоплатин, та 0,88 (95% ДІ 0,55-1,41) у пацієнтів, які отримували цисплатин.
Фармакокінетику (ФК) дурвалумабу вивчали в 1902пацієнтів, при цьому дози варіювалися від 0,1мг/кг (що становить 0,01 від затвердженої рекомендованої дози) до 20мг/кг (що в 2 рази більше від затвердженої рекомендованої дози), а лікарський засіб вводили один раз кожні два, три або чотири тижні.
Фармакокінетична концентрація лікарського засобу в плазмі крові збільшувалася більш ніж пропорційно дозі при введенні доз <3мг/кг (що становить 0,3 від затвердженої рекомендованої дози) і пропорційно дозі при введенні доз ≥3мг/кг кожні два тижні. Рівноважна концентрація досягалася приблизно через 16тижнів.
Фармакокінетика дурвалумабу є аналогічною при оцінці під час застосуванні лікарського засобу як у монотерапії, так і в комбінації з хіміотерапією.
Розподіл
Середнє геометричне (% коефіцієнт варіації [CV %]) значення об’єму розподілу в рівноважному стані було 5,6л (18%).
Виведення
Кліренс дурвалумабу з часом зменшується, його середнє максимальне зниження (CV %) в порівнянні з вихідними значеннями становить приблизно 23% (57%), що призводить до середнього геометричного (CV %) кліренсу в рівноважному стані (CLss) 8,2мл/год (39%) на 365-й день терапії; зниження CLss не вважається клінічно значущим. Середнє геометричне (CV %) кінцевого періоду напіввиведення з урахуванням вихідних показників кліренсу становило приблизно 18 (24%) днів.
Фармакокінетика в особливих груп пацієнтів
Вік (19-96років), маса тіла (34-149кг), стать, концентрація альбуміну, активність лактатдегідрогенази (ЛДГ), концентрація креатиніну, концентрація розчинного PD-L1, тип пухлини, расова приналежність, ниркова недостатність легкого (кліренс креатиніну [КК] 60-89мл/хв) і середнього ступенів тяжкості (КК 30-59мл/хв), печінкова недостатність легкого ступеня тяжкості (білірубін ≤ВМН і ACT>ВМН або концентрація білірубіну >1-1,5 × ВМН при будь-якому рівні ACT) і загальний стан за шкалою Східної кооперативної онкологічної групи (ECOG)/ВООЗ не мали клінічно значущого впливу на фармакокінетику дурвалумабу.
Вплив ниркової недостатності тяжкого ступеня (КК 15-29мл/хв) або печінкової недостатності середнього (концентрація білірубіну >1,5-3 × ВМН при будь-якому рівні ACT) і тяжкого ступенів (концентрація білірубіну >3 × ВМН при будь-якому рівні ACT) на фармакокінетику дурвалумабу невідомий.
Клінічні характеристики
Показання.
Недрібноклітинний рак легень
ІМФІНЗІ показаний для лікування пацієнтів із нерезектабельним недрібноклітинним раком легень (НДРЛ) III стадії, якщо хвороба не прогресувала після проведення конкурентної хіміотерапії із застосуванням препаратів платини та променевої терапії.
Дрібноклітинний рак легень
ІМФІНЗІ у комбінації з етопозидом і карбоплатином або цисплатином показаний як перша лінія терапії поширеного дрібноклітинного раку легень (пДРЛ) у дорослих пацієнтів.
Протипоказання.
Гіперчутливість до діючої речовини або до будь-якої з допоміжних речовин, зазначених у розділі «Склад».
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Застосування системних кортикостероїдів чи імуносупресорів перед початком лікування дурвалумабом, за винятком фізіологічних доз системних кортикостероїдів (≤ 10 мг/добу преднізолону чи інших кортикостероїдів), не рекомендується через потенційний вплив на фармакодинамічну активність та ефективність дурвалумабу. Проте системні кортикостероїди чи інші імуносупресори можна застосовувати після початку терапії дурвалумабом для лікування імуноопосередкованих побічних реакцій (див. розділ «Особливості застосування»).
Офіційні фармакокінетичні дослідження лікарських взаємодій дурвалумабу не проводилися.
Оскільки основний шлях виведення дурвалумабу полягає у катаболізмі білка у ретикулоендотеліальній системи чи мішень-опосередкованому розподілі, лікарські взаємодії не очікуються під час метаболізму лікарського засобу.
Особливості застосування.
Імуноопосередковані побічні реакції
ІМФІНЗІ— це моноклональне антитіло, що належить до класу лікарських засобів, які зв’язуються з рецепторами запрограмованої смерті-1 (PD-1) чи з лігандом PD-1 (PD-L1), блокуючи шлях PD-1/PD-L1, таким чином усуваючи пригнічення імунної відповіді, що потенційно порушує периферичну толерантність та індукує імуноопосередковані побічні реакції. До важливих імуноопосередкованих побічних реакцій, перелічених у розділі «Особливості застосування», можуть бути внесені не всі можливі тяжкі та летальні імуноопосередковані побічні реакції. Імуноопосередковані побічні реакції, зокрема тяжкі або летальні, можуть розвиватися в будь-якій системі органів чи тканині. Імуноопосередковані побічні реакції можуть виникати в будь-який час з моменту початку лікування блокуючими антитілами до PD-1/PD-L1. Хоча зазвичай імуноопосередковані побічні реакції проявляються під час лікування блокуючими антитілами до PD-1/PD-L1, ці побічні реакції також можуть виникати після припинення застосування блокуючих антитіл до PD-1/PD-L1.
Раннє виявлення та лікування імуноопосередкованих побічних реакцій вкрай важливе для гарантування безпечного використання блокуючих антитіл до PD-1/PD-L1. Необхідний ретельний моніторинг симптомів та ознак, що можуть бути клінічними проявами імуноопосередкованих побічних реакцій. Слід оцінювати рівні печінкових ферментів, креатиніну та функцію щитовидної залози на вихідному рівні та періодично протягом лікування. Якщо є підозра на розвиток імуноопосередкованої побічної реакції, потрібно розпочати належне обстеження пацієнта, щоб виключити альтернативну причину, зокрема інфекцію. Необхідно своєчасно призначити лікування та у разі необхідності - консультації спеціалістів.
Тимчасово призупиняють або повністю припиняють застосовувати ІМФІНЗІ залежно від тяжкості побічної реакції (див. розділ «Спосіб застосування та дози»). Загалом, якщо необхідно призупинити чи припинити терапію лікарським засобом ІМФІНЗІ, призначають системні кортикостероїди (1-2мг/кг/добу преднізолону чи його еквівалента) до зменшення тяжкості проявів до 1 чи легшого ступеня тяжкості, після чого починають поступове зниження дози стероїду, яке продовжують принаймні протягом 1 місяця. Розглядають питання про призначення інших системних імуносупресорів пацієнтам, у яких імуноопосередковані побічні реакції не контролюються кортикостероїдами.
Клінічні рекомендації стосовно лікування побічних реакцій, що проявляються токсичністю, коли не обов’язково призначати системні стероїди (наприклад, ендокринопатії та дерматологічні реакції), обговорюються нижче.
Імуноопосередкований пневмоніт
Лікарський засіб ІМФІНЗІ може спричинити імуноопосередкований пневмоніт. Частота розвитку пневмоніту вища в пацієнтів, які попередньо отримували променеву терапію грудної клітки.
Пацієнти, які не щодавно не отримували променеву терапію
У пацієнтів, які отримували лікарський засіб ІМФІНЗІ в клінічних випробуваннях, де загалом не використовували променеву терапію безпосередньо перед початком терапії ІМФІНЗІ, частота розвитку імуноопосередкованого пневмоніту становила 2,4% (34/1414), включно з летальними побічними реакціями (<0,1 %) та побічними реакціями 3-4 ступеня тяжкості (0,4%). Побічні реакції минули в 15 з 28 пацієнтів і спричинили повну відміну лікарського засобу в 5 пацієнтів. Призначення системних кортикостероїдів потребували 19 пацієнтів (19/34) із пневмонітом, які не отримували хіміопроменеву терапію перед початком лікування ІМФІНЗІ.
Пацієнти, які отримували променеву терапію нещодавно
Частота розвитку пневмоніту (включно з променевим пневмонітом) у пацієнтів з нерезектабельним НДРЛ III стадії після дефінітивної хіміопроменевої терапії упродовж 42 днів перед початком лікування ІМФІНЗІ в дослідженні PACIFIC становила 18,3% (87/475) у пацієнтів, які отримували ІМФІНЗІ, та 12,8% (30/234) у пацієнтів, які отримували плацебо. У пацієнтів, які отримали ІМФІНЗІ (475), 1,1 % побічних реакцій були летальними і 2,7 % були побічними реакціями 3 ступеня тяжкості. Побічні реакції минули в 50 з 87 пацієнтів і спричинили повну відміну лікарського засобу в 27 пацієнтів.
Призначення системних кортикостероїдів потребували 64 пацієнти (64/87) із пневмонітом, які отримували хіміопроменеву терапію перед початком лікування ІМФІНЗІ, водночас 2 пацієнти потребували призначення інфліксимабу при застосуванні високих доз стероїдів.
Коли радикальну хіміопроменеву терапію не застосовували перед початком лікування ІМФІНЗІ, частота розвитку та ступінь тяжкості імуноопосередкованого пневмоніту були подібними у пацієнтів із різноманітними видами раку в об’єднаній вибірці даних, яким ІМФІНЗІ призначали як монотерапію, та у пацієнтів із пДРЛ при застосуванні у комбінації з хіміотерапією.
Імуноопосередкований коліт
Лікарський засіб ІМФІНЗІ може спричинити імуноопосередкований коліт, що часто асоціюється з діареєю. Про цитомегаловірусу (ЦМВ) інфекцію/реактивацію повідомляли в пацієнтів із імуноопосередкованим колітом, рефрактерним до лікуванням кортикостероїдами. У разі коліту, рефрактерного до лікуванням кортикостероїдами, варто розглянути питання про повторне обстеження інфекціоністом для виключення альтернативних причин.
Імуноопосередкований коліт виникав у 2% (37/1889) пацієнтів, які отримували ІМФІНЗІ, включно з побічними реакціями 4 (<0,1 %) та 3 (0,4 %) ступеня тяжкості. Побічні реакції минули в 27 з 37 пацієнтів і спричинили повну відміну лікарського засобу в 8 пацієнтів. Всі пацієнти з імуноопосередкованим колітом потребували призначення системних кортикостероїдів, водночас 2 пацієнти (2/37) потребували призначення інших імуносупресорів (наприклад інфліксимабу, мікофенолату).
Імуноопосередкований гепатит
Лікарський засіб ІМФІНЗІ може спричинити імуноопосередкований гепатит.
Імуноопосередкований гепатит виникав у 2,8% (52/1889) пацієнтів, які отримували ІМФІНЗІ, включно з летальними побічними реакціями (0,2%), побічними реакціями 4 ступеня (0,3%) та 3 ступеня тяжкості (1,4%) . Побічні реакції минули в 21 з 52 пацієнтів і спричинили повну відміну лікарського засобу ІМФІНЗІ в 6 пацієнтів. Призначення системних кортикостероїдів потребували всі пацієнти з імуноопосередкованим гепатитом, водночас 2 пацієнти (2/52) потребували призначення мікофенолату при високих дозах стероїдів.
Імуноопосередковані ендокринопатії
Наднирковозалозна недостатність
ІМФІНЗІ може спричиняти первинну чи вторинну недостатність кори надниркових залоз. У разі наднирковозалозної недостатності 2 ступеня чи вище потрібно розпочинати симптоматичну терапію, включно з замісною гормональною терапією, якщо до цього є клінічні показання. Тимчасово призупиняють або повністю припиняють застосовувати ІМФІНЗІ залежно від тяжкості побічної реакції (див. розділ «Спосіб застосування та дози»).
Iмуноопосередкована наднирковозалозна недостатність виникала у 0,5 % (9/1889) пацієнтів, які отримували ІМФІНЗІ, включно з побічними реакціями 3 ступеня тяжкості (<0,1 %). Наднирковозалозна недостатність минула у 1 з 9 пацієнтів і не спричинила повної відміни ІМФІНЗІ в жодного пацієнта. Всі пацієнти з недостатністю кори надниркових залоз потребували призначення системних кортикостероїдів. З них більшість продовжувала отримувати системні кортикостероїди.
Гіпофізит:
ІМФІНЗІ може спричинити імуноопосередкований гіпофізит. Гіпофізит може проявлятися асоційованою з мас-ефектом у порожнині черепа гострою симптоматикою, як-от головним болем, фотофобією чи випадінням полів зору. Гіпофізит може бути причиною гіпопітуїтаризму. Призначають симптоматичну терапію, включно з замісною гормональною терапією, якщо до цього є клінічні показання. Тимчасово призупиняють або повністю припиняють застосовувати ІМФІНЗІ залежно від тяжкості побічної реакції (див. розділ «Спосіб застосування та дози»).
Гіпофізит/гіпопітуїтаризм 3 ступеня виникав у <0,1 % (1/1889) пацієнтів, які отримували ІМФІНЗІ. Цим пацієнтам призначали системні кортикостероїди. Це явище не спричиняло повної відміни ІМФІНЗІ.
Порушення функції щитовидної залози.
ІМФІНЗІ може спричиняти імуноопосередковані порушення функції щитовидної залози. Тиреоїдит може маніфестувати з ендокринопатією чи без неї. Гіпотиреоз може розвиватися після гіпертиреозу. Призначають замісну гормональною терапією у разі гіпотиреозу чи розпочинають медикаментозну терапію гіпертиреозу, якщо до цього є клінічні показання. Тимчасово призупиняють або припиняють застосовувати ІМФІНЗІ залежно від тяжкості побічної реакції (див. розділ «Спосіб застосування та дози»).
Тиреоїдит. Імуноопосередкований тиреоїдит виникав у 0,5 % (9/1889) пацієнтів, які отримували ІМФІНЗІ, включаючи побічні реакції 3 ступеня тяжкості (<0,1%).
Побічні реакції минули в 4 із 9 пацієнтів і спричинили повну відміну лікарського засобу у 1 пацієнта. Призначення системних кортикостероїдів потребували 3 пацієнти (3/9) із імуноопосередкованим тиреоїдитом, водночас 8 пацієнтів (8/9) потребували ендокринної терапії.
Гіпертиреоз. Імуноопосередкований гіпертиреоз виникав у 2,1% (39/1889) пацієнтів, які отримували ІМФІНЗІ. Реакції минули у 30 з 39 пацієнтів та не призводили до відміни ІМФІНЗІ в жодного пацієнта. Призначення системних кортикостероїдів потребували 9 пацієнтів (9/39) із імуноопосередкованим гіпертиреозом, водночас 35 пацієнтів (35/39) потребували ендокринної терапії.
Гіпотиреоз. Імуноопосередкований гіпотиреоз виникав у 8,3% (156/1889) пацієнтів, які отримували ІМФІНЗІ, включно з побічними реакціями 3 ступеня тяжкості (<0,1%). Побічні реакції минули у 31 з 156 пацієнтів та не призводили до відміни ІМФІНЗІ в жодного пацієнта. Призначення системних кортикостероїдів потребували 11 пацієнтів (11/156), і більшість пацієнтів (152/156) потребували тривалої замісної терапії тиреоїдним гормоном.
Цукровий діабет 1 типу.
Цукровий діабет 1 типу, що може проявлятися діабетичним кетоацидозом. Необхідно контролювати пацієнтів для виявлення ознак гіперглікемії чи інших симптомів цукрового діабету. При наявності клінічних показань слід розпочати лікування інсуліном. Тимчасово призупиняють чи повністю припиняють лікування ІМФІНЗІ залежно від ступеня тяжкості симптомів цукрового діабету (див. розділ «Спосіб застосування та дози»).
Імуноопосередкований цукровий діабет 1 типу третього ступеня тяжкості виникав у <0,1% (1/1889) пацієнтів, які отримували ІМФІНЗІ. Цей пацієнт потребував тривалої інсулінотерапії і прийом лікарського засобу ІМФІНЗІ повністю припинили. Ще у двох пацієнтів (0,1%, 2/1889) спостерігалася гіперглікемія, що потребувала інсулінотерапії, та тривала в період репортування.
Імуноопосередкований нефрит із порушенням функції нирок
Лікарський засіб ІМФІНЗІ може спричинити імуноопосередкований нефрит.
Імуноопосередкований нефрит виникав у 0,5% (10/1889) пацієнтів, які отримували ІМФІНЗІ, включно з побічними реакціями 3 ступеня тяжкості (<0,1 %). Побічні реакції минули в 5 із 10 пацієнтів і спричинили повну відміну лікарського засобу в 3 пацієнтів. Всі пацієнти з імуноопосередкованим нефритом потребували призначення системних кортикостероїдів.
Імуноопосередковані дерматологічні реакції
Лікарський засіб ІМФІНЗІ може спричинити імуноопосередковані висипання чи дерматит (включаючи пемфінгоїд). У пацієнтів, які отримували блокуючі антитіла до PD-1/L-1, повідомлялося про появу ексфоліативного дерматиту, включно з синдромом Стівенса - Джонсона (ССД), лікарським висипом з еозинофілією та системними проявами (ЛВЕСП) та токсичним епідермальним некролізом (ТЕН). Топічні пом’якшувальні засоби та/або топічні кортикостероїди можуть бути прийнятними для лікування неексфоліативних висипань легкого чи середнього ступеня. Тимчасово призупиняють або повністю припиняють застосовувати ІМФІНЗІ залежно від тяжкості побічної реакції (див. розділ «Спосіб застосування та дози»).
Імуноопосередковані висипання чи дерматит виникали у 1,8% (34/1889) пацієнтів, які отримували ІМФІНЗІ, включно з побічними реакціями 3 ступеня тяжкості (0,4%). Побічні реакції минули в 19 із 34 пацієнтів і спричинили повну відміну лікарського засобу в 2 пацієнтів. Усі пацієнти з імуноопосередкованими висипаннями чи дерматитом потребували призначення системних кортикостероїдів.
Інші імуноопосередковані побічні реакції
Перелічені нижче клінічно значущі імуноопосередковані побічні реакції виникали з частотою менше 1 % у пацієнтів, які отримували ІМФІНЗІ, чи про них повідомляли у разі застосування інших блокуючих антитіл до PD-1/PD-L1.
З боку серцево-судинної системи: міокардит, перикардит, васкуліт.
З боку нервової системи: менінгіт, енцефаліт, мієліт та демієлінізація, міастенічний синдром/міастенія гравіс (включно з загостреннями), поперечний мієліт, синдром Гієна-Барре, парез нервів, аутоімунна нейропатія.
З боку органів зору: увеїт, ірит та інші токсичні прояви у вигляді запалення структур ока. Деякі випадки можуть бути пов’язані з відшаруванням сітківки. Може виникати порушення зору різного ступеня тяжкості, включно зі сліпотою. Якщо в поєднанні з іншими імуноопосередкованими побічними реакціями виникне увеїт, варто провести диференційну діагностику синдрому, подібного до синдрому Фогта-Коянагі-Харада, оскільки може виникнути потреба в лікуванні системними стероїдами для зменшення ризику необоротної втрати зору.
З боку шлунково-кишкового тракту: панкреатит, включно з підвищенням рівня амілази та ліпази в сироватці крові, гастрит, дуоденіт.
З боку опорно-рухового апарату та сполучної тканини: міозит/поліміозит, рабдомілоз та пов’язані з цим наслідки, включно з нирковою недостатністю, артрит, ревматична поліміалгія.
З боку ендокринної системи: гіпопаратиреоз.
Інше (з боку системи крові/ імунної системи): гемолітична анемія, апластична анемія, гемофагоцитарний лімфогістіоцитоз, синдром системної запальної відповіді (лімфаденіт Кікучі), саркоїдоз, імунна тромбоцитопенія, відторгнення трансплантата солідного органа.
Інфузійні реакції
Лікарський засіб ІМФІНЗІ може спричиняти тяжкі або небезпечні для життя інфузійні реакції.
Слід контролювати появу симптомів інфузійних реакцій. Необхідно тимчасово призупинити, зменшити швидкість введення або повністю припинити застосування ІМФІНЗІ залежно від ступеня тяжкості побічної реакції (див. розділ «Спосіб застосування і дози»). При появі інфузійних реакцій 1-го або 2-го ступеня тяжкості потрібно розглянути можливість проведення медикаментозної підготовки пацієнта з подальшим введенням дози ІМФІНЗІ.
Імуноопосередковані реакції виникали у 2,2 % (42/1889) пацієнтів, які отримували ІМФІНЗІ, включно з побічними реакціями 3 ступеня тяжкості (0,3 %).
Ускладнення алогенної ТГСК після лікування ІМФІНЗІ
У пацієнтів, яким проводять алогенну трансплантацію гемопоетичних стовбурових клітин (ТГСК) до чи після лікування блокуючими антитілами до PD-1/L-1, можуть розвиватися серйозні ускладнення, зокрема летальні. Ускладнення, пов’язані з трансплантатом, об’єднують надгостру реакцію «трансплантат проти хазяїна» (РТПХ), гостру РТПХ, хронічну РТПХ, венооклюзивне захворювання (ВОЗ) печінки після кондиціонування зниженої інтенсивності, а також фебрильний синдром, що потребує терапії стероїдами (без виявленого інфекційного збудника). Ці ускладнення можуть виникати попри проміжну терапію між блокатором PD-1/L-1 та алогенною ТГСК.
Потрібно ретельно спостерігати за станом пацієнта для виявлення ознак ускладнень, пов’язаних із трансплантатом, та негайно втрутитися у цей процес. Необхідно врахувати користь та ризик лікування блокуючими антитілами до PD-1/L-1 до чи після алогенної ТГСК.
Ембріофетальна токсичність
З огляду на механізм дії та дані досліджень на тваринах, лікарський засіб ІМФІНЗІ може шкідливо впливати на розвиток плода, якщо вагітна жінка буде його застосовувати. У дослідженнях репродуктивної функції на тваринах введення дурвалумабу яванським макакам від початку органогенезу до пологів включно призводило до збільшення частоти передчасних пологів, загибелі плода та смерті недоношених новонароджених. Обов’язково повідомте вагітним щодо потенційного ризику для плода. Жінкам репродуктивного віку рекомендується використовувати ефективні методи контрацепції під час лікування ІМФІНЗІ та принаймні протягом 3місяців після отримання останньої дози цього лікарського засобу (див. розділ «Застосування у період вагітності або годування груддю»).
Пацієнти літнього віку
Із 476 пацієнтів, які отримували лікування лікарським засобом ІМФІНЗІ в дослідженні PACIFIC, 45 % були віком ≥ 65 років, а 7,6 % — ≥ 75 років. Загалом, не було виявлено відмінностей у безпеці чи ефективності терапії між пацієнтами віком ≥ 65 років і молодшими пацієнтами. У дослідженні PACIFIC не було достатньої кількості пацієнтів віком ≥ 75 років, щоб можна було оцінити, чи по-іншому вони відповідають на терапію в порівнянні з молодшими пацієнтами.
Із 265пацієнтів із пДРЛ, які отримували лікарський засіб ІМФІНЗІ в комбінації з хіміотерапією, 101 (38 %) пацієнт був віком ≥65років, а 19 (7,2 %) пацієнтів— ≥75 років. Не було виявлено клінічно значущих відмінностей у безпеці або ефективності терапії між пацієнтами віком ≥65років та молодшими пацієнтами.
Застосування у період вагітності або годування груддю.
Вагітність
Короткий опис ризику
З огляду на механізм дії та дані досліджень на тваринах, лікарський засіб ІМФІНЗІ може шкідливо впливати на розвиток плода, якщо вагітна жінка буде його застосовувати (див. розділ «Фармакологічні властивості»). Дані про застосування лікарського засобу ІМФІНЗІ вагітними жінками відсутні.
У дослідженнях репродуктивної функції на тваринах введення дурвалумабу вагітним яванським макакам від моменту підтвердження вагітності до пологів включно призводило до збільшення частоти передчасних пологів, загибелі плода та смерті недоношених новонароджених (див. підпункт «Дані»). Відомо, що людський імуноглобулінG1 (IgG1) проходить плацентарний бар’єр, тому дурвалумаб може потрапляти від вагітної до плода, що розвивається. Слід обов’язково повідомити вагітних жінок про потенційні ризики для плода.
У загальній популяції США при клінічно підтверджених вагітностях прогнозований ризик виникнення тяжких вроджених вад розвитку та викиднів становить 2-4% і 15-20% відповідно.
Дані
Дані досліджень на тваринах
Як повідомляється в публікаціях, сигнальний шлях PD-1/PD-L1 відіграє головну роль у збереженні вагітності, оскільки підтримує імунологічну толерантність вагітної до плода. У мишей на алогенних моделях вагітності було показано, що порушення сигнального шляху PD-L1 призводить до збільшення частоти загибелі плода. Вплив дурвалумабу на пренатальний і постнатальний розвиток оцінювали в дослідженнях репродуктивної функції на яванських макаках. Дурвалумаб вводили від моменту підтвердження вагітності до пологів включно, при цьому концентрації препарату в плазмі крові були приблизно в 6-20разів вищими, ніж при введенні рекомендованої клінічної дози 10мг/кг (визначалися за площею під фармакокінетичною кривою, що описує залежність «концентрація-час» (AUC)). Введення дурвалумабу призводило до передчасних пологів, втрати плода (аборт і мертвонародження) та збільшення смертності новонароджених. Дурвалумаб виявлявся в плазмі крові немовлят у 1-й день післяпологового періоду, а це означає, що дурвалумаб може проходити крізь плаценту. Зважаючи на механізм дії препарату, вплив дурвалумабу на плід може збільшувати ризик розвитку імуноопосередкованих розладів або порушувати нормальну імунну відповідь і спричиняти імуноопосередковані розлади, які відмічалися в мишей із заблокованими генами синтезу PD-1.
Жінки, які годують груддю
Короткий опис ризику
Дотепер немає інформації про наявність дурвалумабу в грудному молоці людини, про його вплив на немовлят, що знаходяться на грудному вигодовуванні, або про вплив на вироблення молока. Людські IgG1 виділяються в грудне молоко людини. Дурвалумаб виявлявся в молоці яванських макак, що годували груддю, та був пов’язаний із передчасною смертю новонароджених (див. підпункт «Дані»).
Через потенційний ризик виникнення побічних реакцій у немовлят, що знаходяться на грудному вигодовуванні, жінкам слід порадити не годувати груддю під час терапії ІМФІНЗІ та принаймні протягом 3місяців після отримання останньої дози цього лікарського засобу.
Дані
У яванських макак, які годували груддю, після введення дурвалумабу від моменту підтвердження вагітності до пологів включно, його концентрація в грудному молоці становила 0,15% від концентрації в плазмі крові матері; при цьому концентрації препарату в плазмі були приблизно в 6-20разів вищими, ніж при введенні рекомендованої клінічної дози 10мг/кг (за AUC). Введення дурвалумабу призводило до передчасної смерті новонароджених.
Чоловіки та жінки репродуктивного віку
Контрацепція
Жінки
З огляду на механізм дії та дані досліджень на тваринах, лікарський засіб ІМФІНЗІ може шкідливо впливати на розвиток плода, якщо вагітна жінка буде його застосовувати (див. розділ «Вагітність»). Жінкам репродуктивного віку рекомендується використовувати ефективні методи контрацепції під час терапії ІМФІНЗІ та принаймні протягом 3місяців після отримання останньої дози цього лікарського засобу.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
З огляду на фармакодинамічні властивості, малоймовірно, що дурвалумаб вплине на здатність керувати автотранспортом або іншими механізмами. Однак у разі виникнення побічних реакцій, що впливають на здатність до концентрації та на швидкість реакції, пацієнтам слід порадити дотримуватися обережності під час керування автотранспортом або іншими механізмами.
Спосіб застосування та дози.
Лікарський засіб ІМФІНЗІ вводять шляхом внутрішньовенної інфузії тривалістю понад 60хвилин.
Рекомендовані дози для лікуваннянерезектабельного НДРЛ ІІІ стадії
Пацієнти з масою тіла 30кг та більше: 10мг/кг кожні 2 тижні чи 1500мг кожні 4 тижні. Пацієнти з масою тіла менше 30кг: 10мг/кг кожні 2 тижні.
Лікарський засіб застосовують до прогресування захворювання, появи неприйнятних проявів токсичності або протягом максимум 12місяців.
Рекомендовані дози для лікування пДРЛ
Пацієнти з масою тіла 30кг та більше: 1500мг у комбінації з хіміотерапією1 кожні 3 тижні (21 день) протягом 4 циклів, далі— 1500мг кожні 4 тижні як монотерапія.
Пацієнти з масою тіла менше 30кг: 20мг/кг у комбінації з хіміотерапією1 кожні 3 тижні (21 день) протягом 4 циклів, далі— 10мг/кг кожні 2 тижні як монотерапія.
Лікування необхідно продовжувати до прогресування захворювання або до появи неприйнятних проявів токсичності.
1ІМФІНЗІ вводять перед хіміотерапією в той самий день. Якщо ІМФІНЗІ застосовується в комбінації з хіміотерапією, див. дані щодо дозування етопозиду та карбоплатину або цисплатину в інструкціях для медичного застосування відповідних лікарських засобів
Коригування дози при виникненні побічних реакцій
Не рекомендується знижувати дозу лікарського засобу.
Загалом припиняють лікування ІМФІНЗІ в разі тяжких (3 ступеня) імуноопосередкованих побічних реакцій. Повністю припиняють лікування ІМФІНЗІ через загрозливі для життя (4 ступеня) імуноопосередковані побічні реакції, рецидивуючі тяжкі (3 ступеня) імуноопосередковані реакції, що потребують системного імуносупресивного лікування, чи у разі неможливості знизити дозу кортикостероїду до рівня 10мг на добу або менше (преднізолону або його еквіваленту) протягом 12 тижнів з моменту початку терапії кортикостероїдами.
Коригування дози ІМФІНЗІ у зв’язку з розвитком побічних реакцій, що потребують лікування, яке відрізняється від лікування в цих загальних клінічних рекомендаціях, описано в таблиці3.
Таблиця3
Рекомендовані коригування дози при виникненні побічних реакцій
Побічна реакція | Ступінь тяжкості1 | Коригування дози |
Імуноопосередковані побічні реакції (див. розділ «Особливості застосування») | ||
Пневмоніт | 2ступінь | Призупинення лікування2 |
3 або 4 ступінь | Повне припинення лікування. | |
Коліт | 2 чи 3 ступінь | Призупинення лікування2 |
4ступінь | Повне припинення лікування. | |
Підвищення рівня АЛТ чи АСТ від більше ніж 3 до 8 разів від ВМН чи підвищення рівня загального білірубіну від більше ніж 1,5 до 3 разів від ВМН. | Призупинення лікування2 | |
Гепатит без ураження печінки пухлиною | Підвищення рівня АЛТ чи АСТ більше ніж у 8 разів від ВМН чи підвищення рівня загального білірубіну більше ніж у 3 рази від ВМН. | Повне припинення лікування. |
Гепатит з ураженням печінки пухлиною3 | Рівень АСТ чи АЛТ від більше ніж 1 до 3 разів вищий від ВМН на вихідному рівні та підвищується від більше ніж 5 до 10 разів від ВМН або рівень АСТ чи АЛТ від більше ніж 3 до 5 разів вищий від ВМН на вихідному рівні та підвищується від більше ніж 8 до 10 разів від ВМН | Призупинення лікування2 |
Підвищення рівня АЛТ чи АСТ більше ніж у 10 разів від ВМН чи підвищення рівня загального білірубіну більше ніж у 3 рази від ВМН | Повне припинення лікування. | |
Ендокринопатії | 3 або 4 ступінь | Призупинити застосування лікарського засобу до стабілізації клінічного стану чи повне припинення лікування лікарським засобом залежно від ступеня тяжкості |
Нефрит із порушенням функції нирок | Підвищення рівня креатиніну в крові 2 або 3 ступеня | Призупинення лікування2 |
Підвищення рівня креатиніну в крові 4 ступеня | Повне припинення лікування. | |
Ексфоліативна дерматологічна патологія | Підозра на ССД, ТЕН чи ЛВЕСП | Призупинення лікування2 |
Підтверджений діагноз ССД, ТЕН чи ЛВЕСП | Повне припинення лікування. | |
Міокардит | 2, 3 або 4 ступінь | Повне припинення лікування. |
Неврологічна токсичність | 2ступінь | Призупинення лікування2 |
3 або 4 ступінь | Повне припинення лікування. | |
Імуноопосередкований поперечний мієліт | Будь-якого ступеня | Повне припинення лікування. |
Інші побічні реакції | ||
Інфузійні реакції (див. розділ «Особливості застосування») | 1 чи 2 ступінь | Призупинення введення або зменшення швидкості інфузії. |
3 або 4 ступінь | Повне припинення лікування. | |
АЛТ— аланінамінотрансфераза; АСТ— аспартатамінотрансфераза; ЛРЕСП— лікарський висип з еозинофілією та системними проявами; ССД— синдром Стівенса - Джонсона; ТЕН— токсичний епідермальний некроліз; ВМН— верхня межа норми.
1 Загальні критерії термінології для позначення побічних явищ (СТСАЕ) Національного інституту онкології (NCI) США, версія4.03.
2 Повернення до лікування пацієнтів із повною чи частковою регресією (0—1 ступінь) після поступового зниження дози кортикостероїдів. Повне припинення терапії лікарським засобом, якщо не відбувається повна чи часткова регресія упродовж 12 тижнів з початку лікування стероїдами або неможливо знизити дозу преднізолону (або його еквіваленту) до 10мг на добу чи нижче упродовж 12 тижнів з початку лікування стероїдами.
3 Якщо рівень АСТ або АЛТ менше чи дорівнює ВМН на вихідному рівні у пацієнтів із ураженням печінки, потрібно призупинити чи повністю припинити лікування ІМФІНЗІ, спираючись на рекомендації стосовно гепатиту без ураження печінки.
Приготування та введення розчину
Приготування
• Перед введенням візуально перевірте лікарський засіб на наявність механічних включень і зміни кольору, якщо розчин і упаковка дозволяють це зробити. Утилізуйте флакон, якщо розчин мутний або змінив колір, або в ньому помітні видимі частки.
• Не струшуйте флакон.
• Наберіть із флакона(-ів) необхідний об’єм лікарського засобу ІМФІНЗІ та додайте його у ємність для внутрішньовенних інфузій, що містить 0,9% розчин хлориду натрію або 5% розчин декстрози. Змішайте отриманий розведений розчин шляхом обережного перевертання ємності. Не струшуйте цей розчин. Остаточна концентрація розведеного розчину повинна бути від 1мг/мл до 15мг/мл.
• Утилізуйте частково використані або порожні флакони з-під лікарського засобу ІМФІНЗІ.
Зберігання розчину для інфузій
• ІМФІНЗІ не містить консервантів.
• Розчин для інфузій потрібно вводити відразу після приготування. Якщо розчин для інфузій не буде вводитися відразу та його потрібно зберігати, то загальний час від моменту приготування не повинен перевищувати:
o 28 днів у разі зберігання у холодильнику при температурі від 2° до 8°C;
o 8 годин у разі зберігання при кімнатній температурі до 25°C.
• Не заморожувати.
• Не струшувати.
Введення
• Розчин для інфузій вводять внутрішньовенно тривалістю понад 60хвилин через інфузійну систему, що містить стерильний фільтр із діаметром пор 0,2 або 0,22мкм для зв’язування низькомолекулярних білків.
• Не можна вводити інші лікарські засоби через ту саму інфузійну систему.
Діти.
Дотепер не встановлено безпеку й ефективність застосування ІМФІНЗІ у дітей.
Передозування.
Інформація про передозування лікарським засобом ІМФІНЗІ відсутня.
Побічні реакції.
Наведені нижче побічні реакції детальніше описані в розділі «Особливості застосування» цієї інструкції для медичного застосування:
- Імуноопосередковані побічні реакції;
- Інфузійні реакції.
Досвід застосування в клінічнихдослідженнях
Оскільки клінічні дослідження проводяться в різних умовах, то частоту побічних реакцій в клінічних дослідженнях конкретного лікарського засобу не можна безпосередньо порівняти з частотою виникнення побічних реакцій в клінічних дослідженнях інших лікарських засобів, тому отримані показники можуть не відображати реальну частоту побічних реакцій, що спостерігається в клінічній практиці.
Дані, описані в розділі «Особливості застосування», відображають застосування лікарського засобу ІМФІНЗІ в 1889пацієнтів із дослідження PACIFIC (рандомізоване, плацебо-контрольоване дослідження, що включало 475пацієнтів із НДРЛ IIIстадії), дослідження Study1108 (відкрите, неконтрольоване, багатокогортне дослідження, що включало 970 пацієнтів з розповсюдженими солідними пухлинами) та з додаткового відкритого неконтрольованого дослідження, що включало 444 пацієнти з метастатичним раком легень, для лікування якого дурвалумаб поки що не зареєстрований. У всіх цих дослідженнях лікарський засіб ІМФІНЗІ вводили в дозі 10мг/кг внутрішньовенно кожні 2тижні. Із 1889пацієнтів 38% лікувалися протягом ≥6 місяців, а 18%— протягом ≥12 місяців. Дані також відображають застосування лікарського засобу ІМФІНЗІ в комбінації з хіміотерапією 265пацієнтам у дослідженніCASPIAN (рандомізоване, відкрите дослідження за участю пацієнтів із пДРЛ). У дослідженні CASPIAN лікарський засіб ІМФІНЗІ вводили в дозі 1500мг кожні 3 або 4тижні.
Дані, описані в цьому розділі, відображають застосування лікарського засобу ІМФІНЗІ пацієнтам із III стадією НДРЛ, які брали участь у дослідженні PACIFIC, та пацієнтам із пДРЛ, які брали участь у дослідженні CASPIAN.
Недрібноклітинний рак легень
Безпеку застосування ІМФІНЗІ пацієнтам із IIIстадією НДРЛ, які пройшли дефінітивну хіміопроменеву терапію протягом 42 днів перед початком дослідження лікарського засобу, оцінювали в багатоцентровому, рандомізованому, подвійно сліпому, плацебо-контрольованому дослідженні PACIFIC. Всього 475пацієнтів отримували ІМФІНЗІ в дозі 10мг/кг внутрішньовенно кожні 2тижні. У це дослідження не включали пацієнтів із прогресуванням захворювання після хіміопроменевої терапії, з активним або перенесеним протягом 2років перед початком дослідження аутоімунним захворюванням або із захворюваннями, які потребували терапії системними імуносупресорами (див. розділ «Фармакодинаміка». Клінічні дослідження).
Характеристики вибірки пацієнтів були такими: середній вік— 64роки (діапазон від 23 до 90років), 45%— віком ≥65 років, 70%— чоловіки, 69%— представники європеоїдної раси, 27%— азіати, 75%— колишні курці, 16%— активні курці, 51% мали 1 бал за шкалою ВООЗ для оцінки загального стану. Усі пацієнти пройшли дефінітивну променеву терапію згідно з протоколом, 92% з них отримали загальну дозу опромінення від 54 до 66Гр. Медіана тривалості лікування лікарським засобом ІМФІНЗІ становила 10 місяців (діапазон 0,2-12,6).
15% пацієнтів припинили застосовувати ІМФІНЗІ через побічні реакції. Найчастішими побічними реакціями, що призводили до припинення терапії лікарським засобом ІМФІНЗІ, були пневмоніт або радіаційний пневмоніт— у 6% пацієнтів. Серйозні побічні реакції виникли у 29% пацієнтів, що отримували ІМФІНЗІ. Найчастішими серйозними побічними реакціями, які відмічалися щонайменше у 2% пацієнтів, були пневмоніт або радіаційний пневмоніт (7%) і пневмонія (6%). Пневмоніт/радіаційний пневмоніт і пневмонія з летальним наслідком були зареєстровані в <2% пацієнтів, і ця частота була схожою в усіх групах дослідження. Найчастішими побічними реакціями (виникали в ≥20% пацієнтів) були кашель, втома, пневмоніт або радіаційний пневмоніт, інфекції верхніх дихальних шляхів, задишка та висипання.
У таблиці4 узагальнено побічні реакції, що виникали щонайменше в 10% пацієнтів, які отримували ІМФІНЗІ.
Таблиця4
Побічні реакції, що виникали в ≥10% пацієнтів, які брали участь у дослідженні PACIFIC
Побічна реакція | ІМФІНЗІ | Плацебо1 | ||
N=475 | N=234 | |||
Будь-якого ступеня | 3-4-го ступеня | Будь-якого ступеня | 3-4-го ступеня | |
З боку дихальної системи, органів грудної клітки та середостіння | ||||
Кашель/ продуктивний кашель | 40 | 0,6 | 30 | 0,4 |
Пневмоніт2/ радіаційний пневмоніт | 34 | 3,4 | 25 | 3,0 |
Задишка3 | 25 | 1,5 | 25 | 2,6 |
З боку шлунково-кишкового тракту | ||||
Діарея | 18 | 0,6 | 19 | 1,3 |
Біль у животі4 | 10 | 0,4 | 6 | 0,4 |
З боку ендокринної системи | ||||
Гіпотиреоз5 | 12 | 0,2 | 1,7 | 0 |
З боку шкіри і підшкірних тканин | ||||
Висипання6 | 23 | 0,6 | 12 | 0 |
Свербіж7 | 12 | 0 | 6 | 0 |
Загальні розлади | ||||
Втома8 | 34 | 0,8 | 32 | 1,3 |
Лихоманка | 15 | 0,2 | 9 | 0 |
Інфекції | ||||
Інфекції верхніх дихальних шляхів9 | 26 | 0,4 | 19 | 0 |
Пневмонія10 | 17 | 7 | 12 | 6 |
1Дизайн дослідження PACIFIC не розрахований на те, щоб продемонструвати статистично значущу різницю в частоті будь-яких конкретних побічних реакцій, перелічених у таблиці5, що виникали при застосуванні ІМФІНЗІ, в порівнянні з групою плацебо.
2Включає гостру інтерстиціальну пневмонію, інтерстиціальне захворювання легень, пневмоніт, фіброз легень.
3Включає задишку та задишку при фізичному навантаженні.
4Включає біль у животі, біль внизу живота, біль у верхній частині живота та біль у боці.
5Включає аутоімунний гіпотиреоз і гіпотиреоз.
6Включає еритематозні, генералізовані, макулярні, макуло-папульозні, папульозні, сверблячі, пустульозні висипання, еритему, екзему, висипання та дерматит.
7Включає генералізований і локальний свербіж.
8Включає астенію та втому.
9Включає ларингіт, назофарингіт, паратонзилярний абсцес, фарингіт, риніт, синусит, тонзиліт, трахеобронхіт та інфекцію верхніх дихальних шляхів.
10Включає інфекційні захворювання легень, пневмоцистну, аденовірусну, бактеріальну, цитомегаловірусну, гемофільну, клебсієльну, некротизуючу, пневмококову та стрептококову пневмонії.
Іншими побічними реакціями, що виникали менш ніж у 10% пацієнтів, які отримували препарат ІМФІНЗІ, були: дисфонія, дизурія, нічна пітливість, периферичні набряки та підвищена чутливість до інфекційних захворювань. З постмаркетингових даних повідомлялося про випадки поперечного мієліту з частотою «Невідомо».
У таблиці5 узагальнено відхилення від норми лабораторних показників, що відмічалися щонайменше в 20% пацієнтів, які отримували ІМФІНЗІ.
Таблиця5
Відхилення від норми лабораторних показників, що в порівнянні з вихідним рівнем погіршилися в ≥20% пацієнтів із дослідження PACIFIC
Відхилення лабораторних показників від норми | ІМФІНЗІ | Плацебо | ||
Будь-якого ступеня1 | 3-го або 4-го ступеня | Будь-якого ступеня1 | 3-го або 4-го ступеня | |
Біохімічний аналіз крові | ||||
Гіперглікемія | 52 | 8 | 51 | 8 |
Гіпокальціємія | 46 | 0,2 | 41 | 0 |
Підвищення рівня АЛТ | 39 | 2,3 | 22 | 0,4 |
Підвищення рівня АСТ | 36 | 2,8 | 21 | 0,4 |
Гіпонатріємія | 33 | 3,6 | 30 | 3,1 |
Гіперкаліємія | 32 | 1,1 | 29 | 1,8 |
Підвищення рівня гамма-глутамілтрансферази (ГГТ) | 24 | 3,4 | 22 | 1,7 |
Загальний аналіз крові | ||||
Лімфопенія | 43 | 17 | 39 | 18 |
1Класифіковано згідно з Загальними термінологічними критеріями для побічних реакцій (СТСАЕ) Національного інституту онкології (NCI) США, версією4.0.
2При кожній оцінці частоти враховували кількість пацієнтів, у яких були результати лабораторних аналізів, зроблених перед початком дослідження та принаймні один раз під час дослідження: у групі ІМФІНЗІ (діапазон: 464-470) і групі плацебо (діапазон: 224-228).
Дрібноклітинний рак легень
Безпеку застосування лікарського засобу ІМФІНЗІ в комбінації з етопозидом і карбоплатином або цисплатином пацієнтам із пДРЛ, які раніше не отримували лікування, оцінювали під час рандомізованого, відкритого, багатоцентрового, контрольованого за активним лікарським засобом дослідження CASPIAN. Усього 265пацієнтів отримували ІМФІНЗІ в дозі 1500мг у комбінації з хіміотерапією кожні 3тижні протягом 4циклів, після чого застосовували ІМФІНЗІ в дозі 1500мг кожні 4тижні до прогресування захворювання або до появи неприйнятних проявів токсичності. У дослідження не включалися пацієнти з активним або перенесеним аутоімунним захворюванням або із захворюваннями, які потребують лікування системними кортикостероїдами чи імуносупресорами (див. розділ «Клінічні дослідження»).
Із 265пацієнтів, які отримували лікарський засіб ІМФІНЗІ, 49 % лікувалися протягом ≥6місяців, а 19 %— протягом ≥12місяців.
Із 266пацієнтів, які отримували лише хіміотерапію, 57% пройшли 6циклів хіміотерапії, а 8% після хіміотерапії перенесли профілактичне опромінення черепа (PCI).
У групі лікування ІМФІНЗІ в комбінації з хіміотерапією 7% пацієнтів припинили застосовувати ІМФІНЗІ через побічні реакції, які включали пневмоніт, гепатотоксичність, нейротоксичність, сепсис, діабетичний кетоацидоз та панцитопенію (кожна з реакцій виникала не більше ніж в 1пацієнта). Серйозні побічні реакції виникли у 31% пацієнтів, що отримували ІМФІНЗІ в комбінації з хіміотерапією. Найчастішими серйозними побічними реакціями, які відзначалися щонайменше в 1% пацієнтів, були фебрильна нейтропенія (4,5%), пневмонія (2,3%), анемія (1,9%), панцитопенія (1,5%), пневмоніт (1,1%) та хронічне обструктивне захворювання легень (ХОЗЛ) (1,1%). Фатальні побічні реакції виникли у 4,9% пацієнтів, які отримували ІМФІНЗІ в комбінації з хіміотерапією. Вони включали панцитопенію, сепсис, септичний шок, тромбоз легеневої артерії, легеневу емболію та гепатит (кожна з реакцій виникала не більше ніж в 1пацієнта), а також раптову смерть (2пацієнти). Найчастішими побічними реакціями (що виникали у ≥ 20% пацієнтів) були нудота, втома/астенія та алопеція.
У таблиці6 наведено побічні реакції, що виникали в пацієнтів, які отримували ІМФІНЗІ в комбінації з хіміотерапією.
Таблиця 6
Побічні реакції, що виникали в ≥10% пацієнтів, які брали участь у дослідженні CASPIAN
ІМФІНЗІ з етопозидом і карбоплатином або цисплатином N=265 | Етопозид і карбоплатин або цисплатин N=266 | |||
Побічна реакція | Будь-якого ступеня (%) | 3-4 ступеня | Будь-якого ступеня (%) | 3-4 ступеня |
З боку органів дихання, грудної клітки та середостіння | ||||
Кашель/ продуктивний кашель | 15 | 0,8 | 9 | 0 |
З боку шлунково-кишкового тракту | ||||
Нудота | 34 | 0,4 | 34 | 1,9 |
Запор | 17 | 0,8 | 19 | 0 |
Блювання | 15 | 0 | 17 | 1,1 |
Діарея | 10 | 1,1 | 11 | 1,1 |
З боку ендокринної системи | ||||
Гіпертиреозa | 10 | 0 | 0,4 | 0 |
З боку шкіри та підшкірної клітковини | ||||
Алопеція | 31 | 1,1 | 34 | 0,8 |
Висипанняb | 11 | 0 | 6 | 0 |
Загальні розлади та реакції в місці введення | ||||
Втома/астенія | 32 | 3,4 | 32 | 2,3 |
З боку обміну речовин і харчування | ||||
Зниження апетиту | 18 | 0,8 | 17 | 0,8 |
a Включає гіпертиреоз та Базедову хворобу.
b Включає еритематозні, генералізовані, макулярні, макуло-папульозні, папульозні, сверблячі, пустульозні висипання, еритему, екзему, висипання та дерматит.
У таблиці7 наведено відхилення лабораторних показників від норми, що відзначалися у ≥20% пацієнтів, які отримували ІМФІНЗІ в комбінації з хіміотерапією.
Таблиця7
Відхилення від норми лабораторних показників, що в порівнянні з вихідним рівнем погіршилися в ≥20%1 пацієнтів із дослідження CASPIAN
ІМФІНЗІ плюс етопозид та карбоплатин або цисплатин | Етопозид та карбоплатин або цисплатин | |
Відхилення лабораторних показників від норми | 3-4 ступеня2 (%)3 | 3-4 ступеня2 (%)3 |
Біохімічний аналіз крові | ||
Гіпонатріємія | 11 | 13 |
Гіпомагніємія | 11 | 6 |
Гіперглікемія | 5 | 5 |
Підвищення рівня лужної фосфатази | 4,9 | 3,5 |
Підвищення рівня АЛТ | 4,9 | 2,7 |
Підвищення рівня АСТ | 4,6 | 1,2 |
Гіпокальціємія | 3,5 | 2,4 |
Підвищення рівня креатиніну в крові | 3,4 | 1,1 |
Гіперкаліємія | 1,5 | 3,1 |
Зниження концентрації тиреотропного гормону (ТТГ) на вихідному рівні <НМН4 та ≥НМН | НЗ | НЗ |
Загальний аналіз крові | ||
Нейтропенія | 41 | 48 |
Лімфопенія | 14 | 13 |
Анемія | 13 | 22 |
Тромбоцитопенія | 12 | 15 |
1 Граничні значення частоти визначають за зміною (будь-якого ступеня) показника від вихідного рівня.
2 Класифіковано згідно з Загальними критеріями термінології для позначення побічних явищ (СТСАЕ) Національного інституту онкології (NCI) США, версія4.03.
3 При кожній оцінці частоти враховували кількість пацієнтів, у яких були результати лабораторних аналізів, зроблених на вихідному рівні та принаймні один раз під час дослідження: у групі ІМФІНЗІ (діапазон: 258-263) та групі хіміотерапії (діапазон: 253-262), за винятком визначення рівня магнію в групі ІМФІНЗІ + хіміотерапія (18) та в групі хіміотерапії (16).
4 НМН— нижня межа норми.
Імуногенність
Як і всі лікарські засоби білкового походження, ІМФІНЗІ може бути імуногенним. Виявлення процесу утворення антитіл дуже залежить від чутливості та специфічності тест-систем. Крім того, на позитивний результат тесту на наявність антитіл (зокрема нейтралізуючих антитіл) можуть впливати певні фактори, такі як методика проведення аналізу, обробка зразків крові, терміни забору зразків, застосування супутніх лікарських засобів і наявні захворювання. Через це порівняння частки пацієнтів із наявністю антитіл до дурвалумабу та частки пацієнтів із антитілами до інших лікарських засобів може бути оманливим.
Із 2280пацієнтів, які отримували ІМФІНЗІ як монотерапію в дозі 10мг/кг кожні 2тижні або 20мг/кг кожні 4тижні, у 69пацієнтів (3 %) були позитивні результати тесту на антитіла до лікарського засобу (АЛЗ), які з’явилися під час лікування, та у 12пацієнтів (0,5 %)— позитивні результати тесту на нейтралізуючі антитіла. Імовірно, поява АЛЗ до дурвалумабу не має клінічно значущого впливу на його фармакокінетику або безпеку.
Із 201пацієнта, які протягом дослідження CASPIAN застосовували ІМФІНЗІ в дозі 1500мг кожні 3тижні в комбінації з хіміотерапією (всього чотири дози), після чого отримували ІМФІНЗІ в дозі 1500мг кожні 4тижні, в жодного пацієнта не було позитивного результату тесту на АЛЗ, які з’явилися під час лікування.
Повідомлення про підозрювані побічні реакції
Важливо повідомляти про підозрювані побічні реакції у післяреєстраційний період застосування лікарського засобу. Це дає змогу здійснювати безперервний моніторинг співвідношення користь/ризик застосування лікарського засобу. Спеціалісти у галузі охорони здоров’я зобов’язані повідомляти про будь-які випадки підозрюваних побічних реакцій через національну систему звітності.
Термін придатності.
Невідкритий флакон
36 місяців.
Умови зберігання.
Невідкритий флакон
Зберігати в холодильнику при температурі від 2 до 8 °C в оригінальній упаковці для захисту від дії світла. Не заморожувати. Не струшувати.
Зберігати в недоступному для дітей місці.
Розведений розчин
Розчин для інфузій потрібно вводити відразу після приготування. Якщо розчин для інфузій не буде вводитися відразу та його потрібно зберігати, то загальний час від моменту приготування не повинен перевищувати:
• 28 днів у разі зберігання у холодильнику при температурі від 2 до 8 °C;
• 8 годин у разі зберігання при кімнатній температурі до 25 °C.
Упаковка.
1 флакон (120 мг/2,4 мл) з пробкою та ковпачком «flip-off» у картонній коробці або 1 флакон (500 мг/10 мл) з пробкою та ковпачком «flip-off» у картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
АстраЗенека АБ.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Гертуневеген, Содертал’є, 151 85, Швеція.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО