ЗОТЕОН ПОДХАЙЛЕР

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ЗОТЕОН ПОДХАЙЛЕР
( ZOTEON PODHALER®)
Склад:
діюча речовина:tobramycin;
1 капсула містить 28 мг тобраміцину;
допоміжні речовини :1,2-дистеароіл-сн-гліцеро-3-фосфохолін (DSPC), кальцію хлорид, сірчана кислота (для корекції pH), гіпромелоза, калію хлорид, карагінан, віск карнаубський, синє чорнило.
Лікарська форма Порошок для інгаляцій, тверді капсули.
Основні фізико-хімічні властивості:прозорі безбарвні капсули, що містять порошок від білого до майже білого кольору без видимих сторонніх механічних включень з відбитком “NVR AVCI” синього кольору по радіальній лінії на кришечці капсули та відбитком «![]() » синього кольору по радіальній лінії на корпусі капсули або з відбитком “NVR AVCI” синього кольору по радіальній лінії корпуса капсули і відбитком «
» синього кольору по радіальній лінії на корпусі капсули або з відбитком “NVR AVCI” синього кольору по радіальній лінії корпуса капсули і відбитком «![]() » синього кольору по радіальній лінії на кришечці капсули.
» синього кольору по радіальній лінії на кришечці капсули.
Фармакотерапевтична група
Антибактеріальні засоби для системного застосування. Аміноглікозиди. Код АТС J01G B01.Фармакологічні властивості
Тобраміцин - це аміноглікозидний антибіотик, що продукується мікроорганізмамиStreptomyces tenebrarius. Він діє переважно шляхом пригнічення синтезу білків мікроорганізму, що призводить до зміни проникності його клітинних мембран, прогресуючого руйнування клітинної оболонки та кінцевої загибелі бактерій. Він чинить бактерицидну дію у концентраціях, рівних або незначно вищих за інгібуючу концентрацію.
У ході плацебо-контрольованого дослідження та дослідження з активним препаратом спостерігалася тенденція до відновлення щільності культуриP. aeruginosa через 28 днів періоду без лікування, що було оборотним через наступні 28 днів періоду лікування.
Межа чутливості мікроорганізмів до тобраміцину для парентерального застосування не співпадає з такою при інгаляційному способі застосування. Слиз при кістозному фіброзі демонструє інгібуючу дію на місцеву біологічну активність інгаляційних аміноглікозидних засобів. Це робить необхідним умову, щоб концентрації тобраміцину в слизові після інгаляції були приблизно в десять разів вищі за мінімальну інгібуючу концентрацію (МІК) або ще вищі для пригніченняP.aeruginosa
Клінічна значущість зміни показників МІК дляP. aeruginosa при лікуванні пацієнтів з кістозним фіброзом точно визначена не була. Клінічні дослідження із застосуванням інгаляційного тобраміцину показали, що зменшення чутливостіin vitro не обов'язково впливає на клінічну користь для пацієнта.
Абсорбція
Очікується, що системна дія тобраміцину після інгаляції препарату ЗОТЕОН Подхайлер буде відбуватися переважно з частки лікарського засобу, що інгалюється, тому що тобраміцин не всмоктується в істотній кількості при пероральному застосуванні.
Концентрації в сироватці крові:після інгаляції одноразової дози 112 мг (4 капсули по 28 мг) препарату ЗОТЕОН Подхайлер у пацієнтів з кістозним фіброзом (КФ) максимальна концентрація (Cmax) тобраміцину становила 1,02 ± 0,53 мкг/мл (середнє ± SD), медіана часу до досягнення максимальної концентрації (Tmax) становила 1 годину. Для порівняння, після інгаляції одноразової дози ЗОТЕОН, розчину для небулайзерної терапії 300 мг/5 мл, Cmax становила 1,04 ± 0,58 мкг/мл, а медіана Tmax - 1 годину. Ступінь системної експозиції (AUC) також була аналогічною для дози препарату ЗОТЕОН Подхайлер 112 мг та дози ЗОТЕОН, розчину для небулайзерної терапії 300 мг. Наприкінці 4-тижневого циклу дозування препарату ЗОТЕОН Подхайлер (112 мг двічі на добу) максимальна концентрація тобраміцину в сироватці крові через 1 годину після прийому дози становила 1,99 ± 0,59 мкг/мл.
Концентрація в мокротинні:після інгаляції одноразової дози 112 мг (4 капсули по 28 мг) препарату ЗОТЕОН Подхайлер у пацієнтів з кістозним фіброзом показник Cmax тобраміцину в мокротинні становив 1047 ± 1080 мкг/мл (середнє ± SD). Для порівняння, після інгаляції одноразової дози ЗОТЕОН, розчину для небулайзерної терапії 300 мг/5 мл, показник Cmax у мокротинні становив 737,3 ± 1028,4 мкг/мл. Мінливість у фармакокінетичних показниках була вища у мокротинні, ніж у сироватці крові.
Розподіл
За оцінками популяційного фармакокінетичного аналізу для препарату ЗОТЕОН Подхайлер у пацієнтів з кістозним фіброзом очікуваний об'єм розподілу тобраміцину в центральному компартменті становить 84,1 літра для типового пацієнта з КФ. Оскільки було продемонстровано, що об'єм змінюється залежно від індексу маси тіла (ІМТ) та функції легень (вираженої показником ОФВ1 у % від прогнозованого значення), моделювання показало, що зміни ІМТ або функції легень не впливають на максимальні (Cmax) і мінімальні (Ctrough) концентрації тобраміцину.
Метаболізм
Тобраміцин не метаболізується та в основному виводиться у незміненому вигляді із сечею.
Елімінація
Тобраміцин елімінується із системного кровотоку в основному за допомогою клубочкової фільтрації сполуки в незміненому вигляді. Очікуваний період напіввиведення тобраміцину із сироватки крові після інгаляції одноразової дози препарату ЗОТЕОН Подхайлер 112 мг становив 3 години у пацієнтів із кістозним фіброзом і є порівнянним із періодом напіввиведення тобраміцину після інгаляції ЗОТЕОНУ, розчину для небулайзерної терапії.
За розрахунками методом популяційного фармакокінетичного аналізу застосування препарату ЗОТЕОН Подхайлер у пацієнтів з кістозним фіброзом у віці від 6 до 66 років очікуваний кліренс тобраміцину із сироватки крові становив 14 літрів/годину. Цей аналіз не показав фармакокінетичних відмінностей за статтю або віком.
Клінічні характеристики
Показання.
Тривале лікування хронічної інфекції легень, cпричиненої бактерієюPseudomonas aeruginosa, у дорослих та дітей віком від 6 років з муковісцидозом (кістозним фіброзом).
Протипоказання.
Підвищена чутливість до діючої речовини (тобраміцину) і будь-якого аміноглікозидного засобу або до будь-якої з допоміжних речовин.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження лікарської взаємодії з препаратом ЗОТЕОН Подхайлер не проводилися. На підставі профілю взаємодії для тобраміцину після внутрішньовенного та аерозольного застосування одночасне та/або подальше застосування препарату ЗОТЕОН Подхайлер з іншими лікарськими засобами, що чинять нефротоксичну або ототоксичну дію, не рекомендується.
Одночасне застосування препарату ЗОТЕОН Подхайлер із сечогінними засобами (такими як етакринова кислота, фуросемід, сечовина або манітол внутрішньовенно) не рекомендується. Такі сполуки можуть підвищити токсичність аміноглікозидних засобів, змінюючи концентрацію антибіотиків у сироватці крові та тканинах.
Див. також інформацію щодо попереднього або одночасного застосування системних аміноглікозидів та діуретиків в розділі «Особливості застосування».
Інші лікарські засоби, які збільшують потенційну токсичність аміноглікозидних засобів для парентерального застосування, включають:
- амфотерицин В, цефалотин, циклоспорин, такролімус, поліміксини (ризик підвищеної нефротоксичності);
- сполуки платини (ризик підвищеної нефротоксичності та ототоксичності);
- антихолінестеразні засоби, ботулотоксин (нейром'язові ефекти).
У ході клінічних досліджень пацієнти, які застосовували ЗОТЕОН Подхайлер, продовжували приймати дорназу альфа, бронхолітичні засоби, інгаляційні кортикостероїди та макролідні засоби. Дані про лікарську взаємодію з цими препаратами отримані не були.
Особливості застосування.
Ототоксичність
При застосуванні аміноглікозидних засобів парентерально повідомлялося про розвиток ототоксичності, що проявлялася у вигляді токсичної дії як на слуховий (втрата слуху), так і на вестибулярний апарат. Вестибулярна токсичність може проявлятися у вигляді вертиго, атаксії або запаморочення. Шум у вухах може бути сигнальним симптомом ототоксичності, таким чином, поява цього симптому служить застереженням при застосуванні цього препарату.
Слід дотримуватись офіційних рекомендацій з належного застосування антибактеріальних засобів.
У ході клінічних досліджень із застосуванням препарату ЗОТЕОН Подхайлер пацієнти повідомляли про втрату слуху та виникнення шуму у вухах (див. розділ «Побічні реакції»). Необхідно обережно призначати препарат пацієнтам з відомою або підозрюваною дисфункцією слухового або вестибулярного апарату.
Для пацієнтів з ознаками дисфункції слухового апарату або пацієнтів із факторами ризику до початку лікування препаратом ЗОТЕОН Подхайлер, можливо, знадобиться проведення аудіологічного обстеження. Якщо пацієнт повідомляє про виникнення шуму у вухах або втрату слуху під час терапії препаратом ЗОТЕОН Подхайлер, лікар повинен розглянути питання про доцільність його направлення на аудіологічне обстеження. Див. також «Моніторинг концентрації тобраміцину в сироватці крові».
Нефротоксичність
Повідомлялося про виникнення нефротоксичності при застосуванні аміноглікозидних засобів парентерально.
Під час проведення клінічних досліджень ЗОТЕОНУ Подхайлер розвиток нефротоксичності не спостерігався. Необхідно обережно призначати препарат пацієнтам з відомою або підозрюваною дисфункцією нирок. Необхідно провести обстеження функції нирок. Слід проводити повторну оцінку рівня креатиніну та сечовини в сироватці крові після кожних 6 повних циклів лікування препаратом ЗОТЕОН Подхайлер. Див. розділ «Спосіб застосування та дози. Пацієнти з порушенням функції нирок», а також «Моніторинг концентрації тобраміцину в сироватці крові».
Моніторинг концентрації тобраміцину в сироватці крові
У пацієнтів з відомою або підозрюваною дисфункцією нирок або слухового апарату слід контролювати рівень концентрації тобраміцину в сироватці крові. У випадку розвитку ото- або нефротоксичності у пацієнта, що застосовує ЗОТЕОН Подхайлер, терапію тобраміцином слід припинити до зниження концентрації тобраміцину в сироватці крові нижче 2 мкг/мл. Концентрації тобраміцину в сироватці крові вище 12 мкг/мл асоціюються з токсичністю тобраміцину, тому лікування слід припинити у випадку перевищення концентрацій цього рівня.
Концентрацію тобраміцину в сироватці крові потрібно моніторувати тільки при застосуванні валідованих методів. Не рекомендується проводити забір проби крові з пальця через ризик забруднення проби.
Бронхоспазм
Повідомлялося про розвиток бронхоспазму у ході клінічних досліджень та при застосуванні препарату ЗОТЕОН Подхайлер.
Для лікування бронхоспазму слід застосовувати належні медичні заходи.
Першу дозу препарату ЗОТЕОН Подхайлер необхідно приймати під наглядом лікаря після застосування бронхолітичного засобу, якщо цей засіб є частиною поточної схеми лікування пацієнта. Показник ОФВ1 необхідно вимірювати до та після інгаляції препарату ЗОТЕОН Подхайлер.
Якщо є ознаки бронхоспазму, спричиненого лікуванням, лікареві варто провести ретельну оцінку, чи переважає користь продовження застосування препарату ЗОТЕОН Подхайлер над ризиком. Якщо передбачається розвиток алергічної реакції, застосування препарату ЗОТЕОН Подхайлер слід припинити.
Кашель
Про виникнення кашлю повідомлялося при застосуванні препарату ЗОТЕОН Подхайлер у ході клінічних досліджень. На підставі даних клінічних випробувань повідомлялося, що застосування інгаляційного порошку ЗОТЕОН Подхайлер було пов'язане з більш високою частотою кашлю порівняно з такою при застосуванні тобраміцину (ЗОТЕОН), розчину для небулайзерної терапії. Кашель не був пов'язаний із бронхоспазмом. У дітей віком до 13 років більш ймовірно може виникнути кашель при лікуванні препаратом ЗОТЕОН Подхайлер порівняно з пацієнтами більш старшого віку.
Якщо при застосуванні препарату ЗОТЕОН Подхайлер спостерігаються ознаки тривалого, спричиненого лікуванням кашлю, лікареві слід розглянути питання щодо застосування ЗОТЕОНУ, розчину для небулайзерної терапії 300 мг/5мл, як альтернативного виду лікування.
Якщо кашель залишається незмінним, слід застосувати інші антибіотики.
Кровохаркання
Кровохаркання є ускладненням при муковісцидозі та частіше зустрічається у дорослих. Пацієнти з кровохарканням (>60 мл) були виключені із клінічних досліджень, тому дані відносно застосування препарату ЗОТЕОН Подхайлер цими пацієнтами відсутні. Це має бути прийнято до уваги, перш ніж призначати ЗОТЕОН Подхайлер, враховуючи те, що інгаляція порошком ЗОТЕОН Подхайлер супроводжувалась більш високою частотою повідомлень про кашель. ЗОТЕОН Подхайлер слід призначати або продовжувати застосовувати у пацієнтів з клінічно значущим кровохарканням тільки у випадку, коли користь від лікування перевищує ризик індукування подальшої кровотечі.
Інші запобіжні заходи
Пацієнти, які одержують супутню терапію аміноглікозидними засобами парентерально (або будь-який препарат, що діє на ниркову екскрецію, такий як сечогінний засіб), за необхідності повинні проходити належний клінічний моніторинг, враховуючи ризик кумулятивної токсичності. Це включає моніторинг концентрації тобраміцину в сироватці крові. Для пацієнтів із факторами ризику на тлі попередньої пролонгованої системної терапії аміноглікозидними засобами, можливо, до початку терапії препаратом ЗОТЕОН Подхайлер знадобиться розглянути доцільність проведення аудіологічного обстеження та оцінки функції нирок. Див. також «Моніторинг концентрації тобраміцину в сироватці крові».
Варто обережно призначати ЗОТЕОН Подхайлер пацієнтам з відомими або підозрюваними нейром'язовими захворюваннями, такими як міастенія гравіс або хвороба Паркінсона. Аміноглікозидні засоби можуть погіршити м'язову слабкість через можливу курареподібну дію на нейром'язову функцію.
Розвиток антибіотикорезистентнихP. aeruginosa та суперінфекція з іншими патогенами є потенційними ризиками, пов'язаними з терапією антибіотиками.
Під час клінічних досліджень у деяких пацієнтів, які застосовували препарат ЗОТЕОН Подхайлер, відмічено підвищення мінімальної інгібуючої концентрації (МІК) аміноглікозидних засобів для досліджуваних ізолятівP. aeruginosa. Спостережуване підвищення показника МІК було переважно оборотним під час періодів без лікування.
Існує теоретичний ризик, що у пацієнтів, які лікуються препаратом ЗОТЕОН Подхайлер, згодом можуть розвинутися ізолятиP. aeruginosa, резистентні до внутрішньовенного введення тобраміцину.
Розвиток резистентності під час інгаляційної терапії тобраміцином може впливати на варіанти лікування при загостреннях; це необхідно контролювати.
Дані в різних вікових групах
У 6-місячному (3 цикли лікування) дослідженні препарату ЗОТЕОН Подхайлер у порівнянні з розчином тобраміцину для небулайзерної терапії, участь в якому брали більшість дорослих пацієнтів із хронічною легеневоюP. aeruginosa інфекцією, що застосовували тобраміцин, зниження концентраціїP. aeruginosa в мокротинні було подібним у обох досліджуваних вікових групах; однак збільшення показника FEV1 від базового було більшим у молодших вікових групах (6 - <20), ніж у дорослій підгрупі (від 20 років) в обох групах. Див. також розділ «Фармакодинаміка» щодо профілю реакції препарату ЗОТЕОН Подхайлер у порівнянні з розчином тобраміцину для небулайзерної терапії. Дорослі пацієнти, як правило, частіше припиняють прийом лікарського засобу ЗОТЕОН Подхайлер з причин непереносимості, у порівнянні з розчином тобраміцину для небулайзерної терапії. Див. також розділ «Побічні реакції».
Якщо клінічне погіршення стану легенів очевидне, слід розглянути додаткову або альтернативну антипсевдомональну терапію.
Спостереження переваги щодо покращення функції легень та пригніченняP. aeruginosa слід оцінювати в контексті переносимості препарату ЗОТЕОН Подхайлер пацієнтом.
Не були вивчені безпека та ефективність застосування пацієнтам з форсованим видихом протягом 1 секунди (FEV1) <25% або>75% або пацієнтам, у яких виявленоBurkholderia cepacia
Методи визначення чутливостімікроорганізмів до антимікробних препаратівinvitro, які застосовувалися для парентеральної терапії тобраміцином, можуть використовуватися для моніторингу чутливості мікроорганізмівP. aeruginosa, виділених у пацієнтів із кістозним фіброзом.
Застосування у період вагітності або годування груддю.
Вагітність
Відповідних даних відносно застосування вагітним жінкам тобраміцину в інгаляції немає.
Дослідження застосування тобраміцину на тваринах не виявили тератогенного ефекту.
Проте аміноглікозидні засоби можуть заподіяти шкоду плоду (наприклад, вроджена глухота) при досягненні високих системних концентрацій у вагітної жінки.
Системна експозиція препарату ЗОТЕОН Подхайлер після інгаляції дуже низька, проте ЗОТЕОН Подхайлер не можна застосовувати під час вагітності, за виключенням випадків, коли очікувана користь для матері перевищує потенційний ризик для плода.
Пацієнтки, які застосовують препарат ЗОТЕОН Подхайлер під час вагітності, повинні бути проінформовані про можливу шкоду для плода.
Період годування груддю
Тобраміцин екскретується у грудне молоко жінки після системного застосування. Кількість тобраміцину, що виводиться у грудне молоко жінки після інгаляції, невідома, однак очікується дуже низька враховуючи низьку системну експозицію. Через можливий розвиток ототоксичності та нефротоксичності у дитини варто прийняти рішення або про тимчасове припинення годування груддю, або про припинення лікування препаратом ЗОТЕОН Подхайлер, враховуючи важливість лікування для матері.
Фертильність
Результати досліджень на тваринах, яким підшкірно було введено тобраміцин, не показали наявність потенційного ризику щодо фертильності ні у самців, ні у самок.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
ЗОТЕОН Подхайлер не впливає чи має незначний вплив на здатність керувати автотранспортом та працювати з іншими механізми.
Спосіб застосування та дози.
Доза препарату ЗОТЕОН Подхайлер однакова для всіх пацієнтів незалежно від віку або маси тіла. Рекомендоване дозування становить 112 мг тобраміцину (4 капсули), двічі на добу, протягом 28 днів. ЗОТЕОН Подхайлер застосовується послідовними циклами: по 28 днів лікування з інтервалом 28 днів без лікування. Дві дози (по 4 капсули кожна) необхідно інгалювати з максимально можливим інтервалом 12 годин, але не менше ніж з 6 годинною перервою.
Пропущені дози
У випадку пропуску дози не менше ніж за 6 годин до застосування наступної дози пацієнту необхідно прийняти дозу препарату якомога швидше. В іншому випадку пацієнту слід дочекатися терміну застосування наступної дози та не інгалювати більше капсул, щоб компенсувати пропущену дозу.
Тривалість лікування
Лікування повинен призначати лікар з досвідом лікування кістозного фіброзу. Лікування препаратом ЗОТЕОН Подхайлер повинне тривати на циклічній основі протягом такого періоду часу, поки лікар вважає, що включення препарату ЗОТЕОН Подхайлер в схему лікування приносить клінічну користь пацієнтові. Якщо є очевидним клінічне погіршення стану легенів, варто розглянути можливість додаткової або альтернативної терапії засобами, активними щодоPseudomonas aeruginosa
Особливі групи пацієнтів
Пацієнти літнього віку (віком від 65 років)
Даних для підтвердження рекомендації за або проти корекції дози для даної групи пацієнтів недостатньо.
Пацієнти з порушенням функції нирок
Тобраміцин в основному виводиться у незміненому вигляді із сечею, тому функція нирок впливає на експозицію тобраміцину. Пацієнти з показником креатиніну сироватки крові 2 мг/дл або вище та вмістом азоту сечовини в крові (BUN) 40 мг/дл або вище не були включені в клінічні дослідження. Даних для підтвердження рекомендації щодо корекції дози препарату ЗОТЕОН Подхайлер для цієї популяції немає. Слід проявляти обережність, призначаючи ЗОТЕОН Подхайлер пацієнтам з відомим або підозрюваним порушенням функції нирок. Див. також «Нефротоксичність» у розділі «Особливості застосування».
Пацієнти з порушенням функції печінки
Дослідження за участю пацієнтів з печінковою дисфункцією не проводилися. Оскільки тобраміцин не метаболізується, вплив печінкової дисфункції на експозицію тобраміцину не очікується.
Пацієнти після трансплантації органів
Відповідні дані відносно застосування препарату ЗОТЕОН Подхайлер пацієнтам після трансплантації органів відсутні. Тому рекомендації для або проти коригування дози пацієнтам після трансплантації органів не можуть бути надані.
Педіатричні пацієнти
Дослідження за участю пацієнтів віком до 6 років не проводилися, тому цей препарат не застосовують цій групі пацієнтів.
Спосіб введення
ЗОТЕОН Подхайлер застосовують шляхом оральної інгаляції за допомогою інгалятора Подхайлер. Цей лікарський засіб не можна застосовувати ніяким іншим шляхом або з використанням іншого інгалятора.
Особи, які забезпечують догляд, повинні надавати допомогу дітям на початку лікування препаратом ЗОТЕОН Подхайлер, особливо дітям віком до 10 років, і повинні продовжувати контролювати їх, поки вони не зможуть використовувати пристрій Подхайлер належним чином без сторонньої допомоги.
Капсули ЗОТЕОН Подхайлер не можна ковтати. Кожну капсулу ЗОТЕОН Подхайлер слід вдихати з двома затримками дихання і переконатися, що капсула порожня.
Якщо пацієнти застосовують декілька різних інгаляційних лікарських засобів і фізіотерапію грудної клітки, рекомендується застосовувати препарат ЗОТЕОН Подхайлер останнім.
Основні інструкції із застосування приводяться нижче.
Тверді капсули Інгалятор Флакон для зберігання
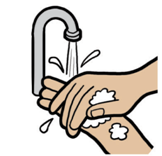
| 1. | Помийте таповністю просушіть руки. |
| 2. | · Поверхнево огляньте пристрій, щоб переконатися в його неушкодженості та незабрудненості. · Поставте його в основу контейнера. · Безпосередньо перед застосуванням дістаньте пристрій Подхайлер з його контейнера, тримаючи за основу та відкручуючи кришку контейнера в напрямку проти годинникової стрілки. · Відкладіть кришку контейнера. |
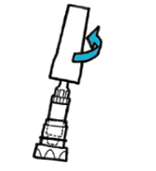
| 3. | · Тримаючи корпус пристрою, відкрутіть кришку контейнера в напрямку проти годинникової стрілки та зніміть мундштук з корпусу. · Покладіть мундштук на чисту суху поверхню. |
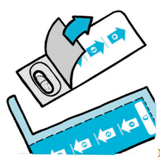
| 4. Відірвіть блістер за лінією перфорації по всій довжині та ширині, як зазначено на малюнках (1) та (2). | |
| 5. | · Відігніть фольгу з блістера з капсулами, щоб витягнути тільки одну капсулу. · Вийміть капсулу з блістера. |
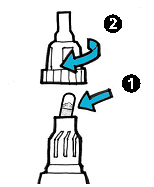
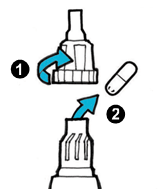
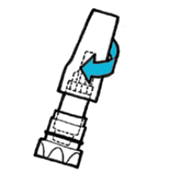
| 6. | · Негайно вставте капсулу безпосередньо в камеру інгалятора (1). · Замініть мундштук. · Закрутіть мундштук щільно до кінця. Не перекручуйте (2). |
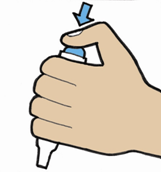
| 7. | · Щоб проколоти капсулу,тримайте пристрій мундштуком униз · Міцно натисніть пальцем на кнопку до припинення її ходу, потім відпустіть кнопку. · Наразі лікарський засіб готовий для інгаляції у 2 прийоми (етап 8 та 9). |
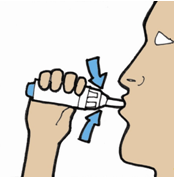
| 8. | Вдихання порошку: 1-а інгаляція · Перед тим, як взяти мундштук до рота, зробіть глибокий видих убік від інгалятора. · Візьміть пристрій мундштуком до себе. Щільно обхопіть губами мундштук. · Вдихніть глибоко порошок одним тривалим вдихом. · Дістаньте інгалятор з порожнини рота та затамуйте подих приблизно на 5 секунд. · Потім зробіть звичайний видих убік від інгалятора. |
| 9. | Вдихання порошку: 2-а інгаляція · Зробіть декілька звичайних видихів убік від інгалятора. · Коли Ви будете готові, виконайте повторну інгаляцію з цієї ж капсули, повторюючи етап 8. |
| 10. Відкрутіть мундштук (1) та дістаньте капсулу з камери (2). | |
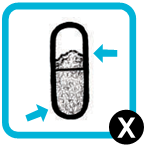
| 11. Перевірте використану капсулу.Вона повинна бути проколотою та порожньою.Якщо вона порожня, викиньте капсулу. | |
| Якщо капсула проколота, але в ній все ще знаходиться деяка кількість порошку: · Встановіть її назад у камеру інгалятора (етап 6); · Встановіть капсулу назад у камеру проколотою стороною; · Замініть мундштук та повторіть етапи 8 - 10. | |
| Якщо капсула виявилася не проколотою: · Встановіть її назад у камеру інгалятора (етап 6); · Замініть мундштук та повторіть етапи 7, 8 та 9. · Після цього, якщо капсула залишається повною та виявилася не проколотою, замініть інгалятор додатковимта повторіть етапи2, 3, 6, 7, 8, 9 та 10. | |
| 12. | Вийміть аналогічним способом інші 3капсули. · Повторіть етапи 5, 6, 7, 8, 9, 10 та 11 для трьох капсул дози, що залишилися. · Утилізуйте всі порожні капсули. |
| 13. | · Закрутіть мундштук міцно до упору. Після інгаляції всієї дози(4 капсули) витріть мундштук чистою сухою тканиною. ·Не промивайте інгалятор водою |
| 14. | · Встановіть інгалятор у контейнер для зберігання. · Поверніть кришку контейнер за годинниковою стрілкою до упору, щоб герметично закрити. |
Особливі запобіжні заходи при утилізації чи іншому поводженні з препаратом
Кожна коробка, призначена на один тиждень, містить 7 блістерних стрипів (що відповідає 7 дням тижня), 1 блістерний стрип містить 8 капсул (що відповідає добовій дозі: 4 капсули для застосування вранці та 4 капсули для застосування ввечері).
Капсули ЗОТЕОН Подхайлер слід завжди зберігати в блістерному стрипі (упаковка для капсул) і діставати з нього безпосередньо перед застосуванням. Кожен пристрій Подхайлер та його контейнер використовують протягом 7 днів і потім утилізують або замінюють.
Якщо препарат не застосовується, зберігати пристрій Подхайлер у герметично закритому контейнері.
Діти.
Препарат не застосовують дітям віком до 6 років.
Передозування.
Небажані реакції, пов'язані з передозуванням препарату ЗОТЕОН Подхайлер, встановлені не були. Максимальна добова доза препарату ЗОТЕОН Подхайлер, що витримується пацієнтами, встановлена не була. Визначення концентрації тобраміцину в сироватці крові може бути корисним при моніторингу передозування. У випадку ознак гострої токсичності рекомендується негайна відміна препарату ЗОТЕОН Подхайлер та обстеження функції нирок.
У разі випадкового перорального прийому капсул ЗОТЕОН Подхайлер малоймовірний розвиток токсичності, тому що тобраміцин слабко абсорбується із непошкодженого травного тракту.
Гемодіаліз може бути корисним при виведенні тобраміцину з організму.
Побічні реакції
Найбільш часто повідомлялося про такі побічні ефекти під час досліджень щодо безпеки, активно-контрольованих клінічних досліджень з Зотеоном Подхайлер у порівнянні з розчином тобраміцину у пацієнтів з муковісцидозом з інфекцієюP.aeruginosa: кашель, продуктивний кашель, гарячка, диспное, орофарингеальний біль, дисфонія та кровохаркання.
У плацебо-контрольованому дослідженні препарату ЗОТЕОН Подхайлер побічні реакції, зареєстрована частота виявлення яких була більшою, ніж у разі застосування плацебо, були фаринголарингеальний біль, дисгевзія та дисфонія.
Переважна більшість небажаних реакцій, про виникнення яких повідомлялося при застосуванні препарату ЗОТЕОН Подхайлер, була легкого або помірного ступеня, тяжкість їх прояву не відрізнялася між циклами або між цілими періодами дослідження та перебування на терапії.
Побічні реакції наведено відповідно до класів систем органів у MedDRA за частотою, при цьому першими наведено найбільш часті. У межах кожної групи за частотою побічні реакції препарату представлено в порядку зменшення серйозності. Частотна категорія визначена з використанням CIOMS III.
При оцінці частоти виникнення різних побічних реакцій використанітакі критерії: дуже часто (>1/10), часто (>1/100, <1/10); нечасто (>1/1000, <1/100); рідко (>1/10000, <1/1000); дуже рідко (<1/10000), невідомо: частота не може бути оцінена з наявних даних.
З боку судинної системи:
дуже часто - кровохаркання;
часто - носова кровотеча.
Бронхолегеневі, торакальні та медіастинальні порушення:
дуже часто - диспное, дисфонія, продуктивний кашель, кашель;
часто - свистяче дихання, хрипи, дискомфорт у ділянці грудної клітки, закладеність носа, бронхоспазм, афонія;
невідомо - зміна кольору слини.
Органи слуху:
часто - втрата слуху та шум у вухах.
З боку травного тракту:
дуже часто - орофарингеальний біль;
часто - блювання, діарея, подразнення у горлі, нудота, дисгевзія.
З боку шкіри та підшкірної клітковини:
часто - висипання.
З боку кістково-м'язової системи та сполучної тканини:
часто - кістково-м'язовий біль у ділянці грудної клітки.
Загальні розлади та місцеві реакції:
дуже часто - гарячка;
невідомо - нездужання.
Опис окремих побічних реакцій
Кашель був найчастішою побічною реакцією в обох клінічних дослідженнях. Проте ні в одному клінічному дослідженні ніяких асоціацій не спостерігалося між випадками бронхоспазму та випадками кашлю.
В активно-контрольованому дослідженні аудіологічне тестування проводилось у відібраних центрах, що охоплювало близько чверті досліджуваного населення. Чотири пацієнти в групі лікування препаратом ЗОТЕОН Подхайлер зазнали суттєвого зниження слуху, яке було тимчасовим у трьох пацієнтів, а в одному випадку - постійним.
У активно-контрольованому відкритому дослідженні пацієнти віком від 20 років мали тенденцію до припинення застосування препарату ЗОТЕОН Подхайлер частіше, ніж розчину тобраміцину для небулайзерної терапії; припинення застосування через побічні ефекти припадає приблизно на половину випадків відміни кожної лікарської форми. У дітей віком до 13 років відміна була більш частою у разі застосування розчину для небулайзерної терапії (ЗОТЕОН), при цьому у пацієнтів віком від 13 до 19 років була подібною частота припинення застосування обох лікарських форм.
Термін придатності.
3 роки.
Умови зберігання.
Зберігати при температурі не вище 30 ºС у захищеному від вологи місці. Зберігати у недоступному для дітей місці.
Упаковка.
По 8 капсул у блістері, по 7 блістерів, 1 інгалятор та інструкція для медичного застосування у картонній пачці.
По 4 картонні пачки та 1 додатковий інгалятор у коробці.
По 8 картонних пачок та 2 додаткові інгалятори у коробці.
Категорія відпуску.За рецептом.
Виробник.
Новартіс Фарма ГмбХ, Німеччина / Novartis Pharma GmbH, Germany
Місцезнаходження виробника та його адреса місця провадження діяльності .
Рунштрассе 25 та Обер Турнштрассе 8, Нюрнберг, 90429, Німеччина/
Roonstrasse 25 und Obere Turnstrasse 8, Nuernberg, 90429, Germany.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО