ЯРИНА® ПЛЮС

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ЯРИНА® ПЛЮС
(YARINA®PLUS)
Склад:
діючі речовини: етинілестрадіол, дроспіренон, левомефолат кальцію;
1 упаковка містить 28 таблеток, вкритих оболонкою (21 таблетка оранжевого кольору і 7 таблеток світло-оранжевого кольору);
1 таблетка оранжевого кольору містить етинілестрадіолу 0,03 мг, дроспіренону 3 мг та левомефолату кальцію 0,451 мг;
допоміжні речовини : лактози моногідрат, целюлоза мікрокристалічна, натрію карбокси-метилцелюлоза, гідроксипропілцелюлоза, магнію стеарат, гіпромелоза, макрогол 6000, тальк, титану діоксид (Е 171), заліза оксид жовтий (Е 172), заліза оксид червоний (Е 172);
1 таблетка світло-оранжевого кольору містить левомефолату кальцію 0,451 мг;
допоміжні речовини : лактози моногідрат, целюлоза мікрокристалічна, натрію карбокси-метилцелюлоза, гідроксипропілцелюлоза, магнію стеарат, гіпромелоза, макрогол 6000, тальк, титану діоксид ( Е 171), заліза оксид жовтий (Е 172), заліза оксид червоний (Е 172).
Лікарська формаТаблетки, вкриті оболонкою.
Основні фізико-хімічні властивості:
- таблетки, вкриті оболонкою, які містять гормони, круглі, двоопуклі, оранжевого кольору, з одного боку яких витиснено «Y+» у правильному шестикутнику;
- таблетки, які містять лише левомефолат кальцію, вкриті оболонкою, круглі, двоопуклі, світло-оранжевого кольору, з одного боку яких витиснено «М+» у правильному шестикутнику.
Фармакотерапевтична група
Гормони статевих залоз та препарати, які застосовують при патології статевої сфери. Гормональні контрацептиви для системного застосування.Код АТС G03А A12.
Фармакологічні властивості
Механізм дії
Комбіновані оральні контрацептиви (КОК) знижують ризик вагітності головним чином шляхом пригнічення овуляції. Інші можливі механізми включають зміни характеру цервікального слизу, завдяки яким ускладнюється проникнення сперми, та зміни едометрія, що знижують імовірність імплантації.
Фармакодинамічні властивості
Дроспіренон - аналог спіронолактону, що має антимінералокортикоїдні та антиандрогенні властивості. Естрогенний компонент препарату Ярина® Плюс - це етинілестрадіол.
Контрацептивна дія
Спеціальних досліджень фармакодинамічних властивостей препарату Ярина® Плюс не проводили.
Фолатна добавка
У ході двох досліджень вивчали вплив препарату Ярина® Плюс на рівень фолатів у плазмі та еритроцитах. У рандомізованому подвійному сліпому дослідженні з активним контролем у паралельних групах порівнювалися рівні фолатів у плазмі та еритроцитах у жінок (пацієнток) зі США під час 24-тижневого лікування 3 мг дроспіренону/0,02 мг етинілестрадіолу (препарат «Джаз») + 0,451 мг кальцію левомефолату та під час лікування тільки препаратом «Джаз». Фармакодинамічний вплив на рівень фолатів у плазмі крові, в еритроцитах та на профіль циркулюючих метаболітів фолатів оцінювався протягом 24 тижнів лікування за допомогою 0,451 мг кальцію левомефолату або 0,4 мг фолієвої кислоти (еквімолярна доза 0,451 мг кальцію левомефолату) у комбінації з 3 мг дроспіренону/0,03 мг етинілестрадіолу (Ярина®) з наступним немаскованим застосуванням впродовж 20 тижнів тільки препарату Ярина® (фаза елімінації)
Препарати Ярина® Плюс і Ярина є біоеквівалентними з огляду на дроспіренон та етинілестрадіол.
Абсолютна біодоступність дроспіренону при прийомі таблетки з вмістом тільки дроспіренону становить близько 76 %. Абсолютна біодоступність етинілестрадіолу - приблизно 40 %, що є результатом пресистемної кон’югації та ефекту першого проходження. Абсолютна біодоступність препарату Ярина® Плюс, що містить комбінацію дроспіренону та етинілестрадіолу, стабілізовану бетадексу клатратом (молекулярний комплекс), не досліджувалась. Етинілестрадіол має однакову біодоступність при застосуванні у вигляді комплексу з бетадексу клатратом і при прийомі як вільного стероїду. Сироваткові концентрації дроспіренону та етинілестрадіолу досягають максимального рівня через 1-2 години після прийому препарату Ярина® Плюс.
Фармакокінетика дроспіренону після прийому одноразових доз від 1 до 10 мг має дозозалежний характер. При щоденному застосуванні препарату «Ярина®» рівноважна концентрація дроспіренону досягалась через 8 днів. Спостерігалося майже 2-3 кратне підвищення показників Сmax та AUC (0-24 години) у сироватці крові дроспіренону після багаторазового застосування препарату «Ярина®» (див. таблицю 1).
Для етинілестрадіолу рівноважні умови спостерігалися протягом другої половини курсу лікування. При щоденному застосуванні препарату Ярина®, показники сироваткового рівня Сmax та AUC (0-24 години) етинілестрадіолу підвищилися майже у 1,5-2 рази (див. таблицю 1).
Кальцію левомефолат за своєю структурою є ідентичним L-5-метилтетрагідрофолату (L-5-метил-ТГФ), метаболіту вітаміну В9. Середня початкова концентрація в осіб, які не вживають продукти, збагачені фолієвою кислотою, проте мають нормальний поживний раціон, становить 15 нмоль/л. При пероральному прийомі кальцію левомефолат абсорбується і накопичується в організмі. Максимальна концентрація у плазмі крові, що на 50 нмоль/л вище початкого рівня, досягається через 0,5-1,5 години після одноразового перорального прийому кальцію левомефолату в дозі 0,451 мг.
Рівноважні умови для загального рівня фолату у плазмі крові після прийому 0,451 мг кальцію левомефолату досягаються приблизно через 8-16 тижнів, залежно від показників початкового рівня. Рівноважна концентрація кальцію левомефолату в еритроцитах досягається дещо пізніше, що зумовлено довшим життєвим циклом еритроцитів - 120 днів.
Таблиця 1
Фармакокінетичні параметри препарату «Ярина®» (3 мг дроспіренону і 0,03 мг етинілестрадіолу)
Дроспіренон Середні значення (%) | |||||
Курс/доба | Кількість пацієнтів | Сmax (нг/мл) | Tmax (год) | AUC(0-24год) (нг*год/мл) | T1/2 (год) |
1/1 | 12 | 36,9 (13) | 1,7 (47) | 288 (25) | Не застосовується |
1/21 | 12 | 87,5 (59) | 1,7 (20) | 827 (23) | 30,9 (44) |
6/21 | 12 | 84,2 (19) | 1,8 (19) | 930 (19) | 32,5 (38) |
9/21 | 12 | 81,3 (19) | 1,6 (38) | 957 (23) | 31,4 (39) |
13/21 | 12 | 78,7 (18) | 1,6 (26) | 968 (24) | 31,1 (36) |
Етинілестрадіол Середні значення (%) | |||||
Курс/доба | Кількість пацієнтів | Сmax (нг/мл) | Tmax (год) | AUC(0-24год) (нг*год/мл) | T1/2 (год) |
1/1 | 11 | 53,5 (43) | 1,9 (45) | 280 (87) | Не застосовується |
1/21 | 11 | 92,1 (35) | 1,5 (40) | 461 (94) | Не застосовується |
6/21 | 11 | 99,1 (45) | 1,5 (47) | 346 (74) | Не застосовується |
9/21 | 11 | 87 (43) | 1,5 (42) | 485 (92) | Не застосовується |
13/21 | 10 | 90,5 (45) | 1,6 (38) | 469 (83) | Не застосовується |
Вплив їжі
Швидкість абсорбції дроспіренону та етинілестрадіолу після одноразового застосування препаратів, подібних до Ярина® Плюс, була нижчою при прийомі після їжі (багатої на вміст жирів), при цьому середня сироваткова концентрація (Сmax) обох речовин знизилась майже на 40 %. Однак ступінь абсорбції дроспіренону залишився незмінним. Натомість ступінь абсорбції етинілестрадіолу зменшився майже на 20 % при застосуванні після їжі.
Вплив їжі на абсорбцію кальцію левомефолату при застосуванні препарату Ярина® Плюс не вивчався.
Розподіл
Спад сироваткових концентрацій дроспіренону та етинілестрадіолу відбувається в два етапи. Уявний об’єм розподілу дроспіренону становить близько 4 л/кг, а етинілестрадіолу - близько
4-5 л/кг.
Дроспіренон не зв’язується з глобуліном, що зв’язує статеві гормони (ГЗСГ), або глобуліном, що зв’язує кортизол (ГЗК), однак зв’язування з іншими білками сироватки крові становить близько 97 %. Після багаторазового застосування протягом більше 3 курсів не відмічено жодних змін вільної фракції (за показниками мінімальної концентрації). Повідомляється, що етинілестрадіол активно, проте неспецифічно зв’язується з сироватковим альбуміном (близько 98,5 %) та стимулює підвищення сироваткових концентрацій як ГЗСГ, так і ГЗК. Такий вплив на ГЗСГ і ГЗК, зумовлений дією етинілестрадіолу, не змінювався при зміні доз дроспіренону в діапазоні 2-3 мг.
Повідомлялось про двофазну кінетику фолатів зі швидким та повільним оновленням їх запасів. Швидке оновлення запасів, яке, можливо, відображає нещодавно абсорбовані фолати, відповідає показнику кінцевого періоду напіввиведення, що становить приблизно 4-5 годин після одноразового перорального прийому кальцію левомефолату в дозі 0,451 мг. Для повільного оновлення запасів, що відображає метаболізм поліглютамату фолату, середній час утримання становить 100 днів або більше.
Метаболізм
Два основних метаболіти дроспіренону, виявлені у плазмі людини - це кислотна форма дроспіренону, що утворюється внаслідок розкриття лактонового кільця, та 4,5-дигідро-дроспіренон-3-сульфат, що є результатом редукції та наступного сульфування. Встановлено, що ці метаболіти є фармакологічно неактивними. Дроспіренон також зазнає окислювального метаболізму під дією CYP3A4.
Повідомлялось, що етинілестрадіол проходить значний пресистемний метаболізм у кишечнику і печінці. Метаболізм етинілестрадіолу та його окислювальних метаболітів відбувається переважно шляхом кон’югації з глюкуронідом або сульфатом. CYP3A4 в печінці відповідає за 2-гідроксилювання, що є основною реакцією окислення. 2-гідрокси метаболіт проходить подальшу трансформацію під час метилювання та глюкуронідації перед тим, як бути виведеним із сечею та калом.
L-5-метил-ТГФ - переважаюча сполука фолієвої кислоти в системі кровообігу, що транспортується за фізіологічних умов та під час застосування фолієвої кислоти і кальцію левомефолату.
Виведення
Сироваткова концентрація дроспіренону характеризується кінцевим періодом напіввиведення у фазі розподілу близько 30 годин як після одноразового, так і багаторазового застосування. Виведення з організму дроспіренону було майже повним через 10 днів, а виведені кількості виявились дещо вищими у калі, ніж у сечі. Дроспіренон проходить активний метаболізм, і з сечею та калом виділяються тільки незначні кількості незміненого дроспіренону. У сечі та калі виявлено щонайменше 20 різних метаболітів. Близько 38-47 % метаболітів у сечі - кон’югати з глюкуронідами та сульфатами. Майже 17-20 % метаболітів, виявлених у калі, виводилися у формі глюкуронідів та сульфатів.
Кінцевий період напіввиведення у фазі розподілу етинілестрадіолу становив, за повідомленнями, близько 24 годин. Етинілестрадіол не виводиться у незміненому вигляді. Етинілестрадіол виводиться із сечею та калом у формі кон’югатів з глюкуронідами та сульфатами і проходить ентерогепатичну циркуляцію.
L-5-метил-ТГФ виводиться з організму з сечею у формі незмінених фолатів і продуктів катаболізму та з калом у процесі двофазної кінетики.
Застосування в особливих групах пацієнток
Застосування дітям. Безпека та ефективність застосування препарату Ярина® Плюс встановлена для жінок репродуктивного віку. Очікується, що препарат виявлятиме аналогічну ефективність у підлітків постпубертатного віку до 18 років та пацієнток віком від 18 років. Цей лікарський засіб не призначати до початку менструацій.
Застосування осібам літнього віку. Застосування препарату Ярина® Плюс у жінок постклімактеричного віку не досліджували; препарат не призначають пацієнткам цієї групи.
Расові відмінності. Не відмічено клінічно значущих відмінностей фармакокінетичних властивостей дроспіренону або етинілестрадіолу у японок та представниць європеоїдної раси (віком 25-35 років) при щоденному застосуванні препарату із вмістом 3 мг дроспіренону/0,02 мг етинілестрадіолу протягом 21 доби. Спеціальні дослідження щодо особливостей в інших етнічних групах не проводились.
Порушення функції нирок. Препарат Ярина® Плюс протипоказаний для застосування пацієнткам із порушенням функції нирок.
Вплив порушення функції нирок на фармакокінетичні властивості дроспіренону (в дозі 3 мг на добу протягом 14 днів) та вплив дроспіренону на концентрацію калію в сироватці вивчали у трьох окремих групах жінок (n = 28, вік 30-65). Всі особи перебували на дієті з низьким споживанням калію. Протягом дослідження 7 осіб продовжували приймати калійзберігаючі препарати для лікування їх основного захворювання. На 14-й день терапії дроспіреноном (рівноважний стан) сироваткові концентрації дроспіренону в групі з кліренсом креатиніну 50-79 мл/хв були аналогічними концентраціям в групі з кліренсом креатиніну ≥ 80 мл/хв. В осіб з кліренсом креатиніну 30 - 49 мл/хв сироваткові концентрації дроспіренону були в середньому на 37 % вищими, ніж у пацієнток з контрольної групи. При лікуванні дроспіреноном не відмічено жодного клінічно значущого впливу на рівень калію в сироватці крові. Незважаючи на те, що в дослідженні не спостерігалась гіперкаліємія, у 5 з 7 осіб, які продовжували застосування калійзберігаючих препаратів під час дослідження, середня сироваткова концентрація калію підвищилась до 0,33 мекв/л (див. розділи «Протипоказання» та «Особливості застосування»).
Порушення функції печінки. Препарат Ярина® Плюс протипоказаний для застосування пацієнткам із хворобами печінки.
Середня експозиція дроспіренону у жінок із порушенням функції печінки помірного ступеня є майже втричі вищою за експозицію у жінок з нормальною функцією печінки. Препарат Ярина® Плюс не досліджувався у жінок із тяжкими порушеннями функції печінки (див. розділи «Протипоказання» та «Особливості застосування»).
Медикаментозна взаємодія
Для отримання більш детальної інформації про взаємодію з гормональними контрацептивами або про можливі ферментні зміни слід переглянути інструкції для медичного застосування всіх
препаратів, які призначають одночасно з цим лікарським засобом.
Вплив інших лікарських засобів на КОК.
Речовини, що знижують ефективність КОК.Лікарські засоби або фітопрепарати, що індукують певні ферменти, в тому числі CYP3A4, можуть знижувати ефективність КОК або посилювати проривні кровотечі.
Речовини, що підвищують концентрацію КОК у плазмі крові.При супутньому застосуванні аторвастатину та певних КОК, що містять етинілестрадіол, відмічається підвищення показників AUC етинілестрадіолу майже на 20 %. Аскорбінова кислота та ацетамінофен можуть призводити до збільшення концентрації етинілестрадіолу у плазмі крові, ймовірно, через пригнічення кон’югації. У ході клінічного дослідження з вивчення взаємодії препаратів, що проводи з участю 20 жінок передклімактеричного віку, при застосуванні 1 раз на добу таблеток із вмістом 3 мг дроспіренону і 0,02 мг етинілестрадіолу одночасно з потужним інгібітором CYP3A4 кетоконазолом в дозі 200 мг двічі на добу протягом 10 днів відмічалось підвищення AUC (0-24) дроспіренону та етинілестрадіолу відповідно в 2,68 раза (90 % ДІ: 2,44, 2,95) та 1,4 раза (90 % ДІ: 1,31, 1,49). Показник Cmax зазнав 1,97-кратного підвищення (90 % ДІ: 1,79, 2,17) і 1,39-кратного підвищення (90 % ДІ: 1,28, 1,52) дроспіренону та етинілестрадіолу відповідно. Незважаючи на те, що не було відмічено жодного клінічно значущого впливу на безпеку або лабораторні показники, в тому числі рівень калію в сироватці крові, слід враховувати, що в цьому дослідженні суб’єкти вивчались лише протягом 10 днів. Клінічні наслідки прийому КОК із вмістом дроспіренону одночасно з безперервним застосуванням інгібітора CYP3A4/5 невідомі (див. розділ «Особливості застосування»).
Інгібітори протеази вірусу імунодефіциту людини (ВІЛ)/вірусу гепатиту С (ВГС) та ненуклеозидні інгібітори зворотної транскриптази.У деяких випадках при одночасному застосуванні КОК з інгібіторами протеази ВІЛ/ВГС або ненуклеозидними інгібіторами зворотної транскриптази спостерігалися значні зміни (збільшення або зменшення) плазмової концентрації естрогену та прогестину.
Антибіотики. Є повідомлення про випадки настання вагітності під час застосування гормональних контрацептивів та антибіотиків, однак клінічні дослідження з вивчення фармакокінетичних властивостей не виявили стійкого впливу антибіотиків на концентрацію синтетичних стероїдів у плазмі крові.
Вплив КОК на інші препарати
КОК з вмістом етинілестрадіолу можуть пригнічувати метаболізм інших препаратів. Встановлено, що КОК значно знижують концентрацію ламотриджину у плазмі крові, імовірно, через індукування глюкуронування ламотриджину. Внаслідок цього можливе зменшення контролю над судомами, тому може потребуватись коригування дози ламотриджину. Для отримання більш детальної інформації про взаємодію з КОК або про можливі ферментні зміни перегляньте інструкції для медичного застосування всіх препаратів, які призначають одночасно з цим лікарським засобом.
В умовахin vitro етинілестрадіол є інгібітором зворотної дії стосовно ізоферментів CYP2C19, CYP1A1 i CYP1A2 та незворотним інгібітором ізоферментів CYP3A4/5, CYP2C8 i CYP2J2. Метаболізм дроспіренону та потенційний вплив дроспіренону на печінкові CYP-ферменти вивчали у дослідженнях in vitro таin vivo. У ході двох дослідженьin vitro дроспіренон не виявляв впливу на метаболізм модельних субстратів CYP1A2 i CYP2D6, однак пригнічував метаболізм модельних субстратів CYP1A1, CYP2C9, CYP2C19 i CYP2A4, при цьому найбільш чутливим ферментом був CYP2C19. Потенційний вплив дроспіренону на активність ізоферменту CYP2C19 вивчали у ході дослідження клінічної фармакокінетики із застосуванням омепразолу як маркерного субстрату. У ході дослідження за участю 24 жінок постклімактеричного віку (12 жінок із гомозиготним (дикого типу) генотипом CYP2C19 та 12 жінок із гетерозотним генотипом CYP2C19) при щоденному пероральному застосуванні дроспіренону в дозі 3 мг протягом 14 днів не відмічено впливу на кліренс омепразолу (40 мг, одноразова пероральна доза) та 5-гідроксиомепразолу, утвореного під дією CYP2C19. Крім того, не було виявлено жодного значного впливу дроспіренону на системний кліренс омепразолу сульфону, метаболіту, утвореного за допомогою CYP3A4. Ці результати свідчать, що дроспіренон не пригнічує CYP2C19 i CYP3A4 в умовахin vivo
Було проведено два додаткових клінічних дослідження з вивчення медикаментозної взаємодії з використанням симвастатину та мідазоламу як маркерних субстратів для CYP3A4, у кожному з яких брали участь 24 здорові жінки постклімактеричного віку. Результати цих досліджень показали, що дроспіренон в рівноважній концентрації, досягнутій після його застосування в дозі 3 мг/добу, не виявляє впливу на фармакокінетичні властивості субстратів CYP3A4.
Жінки, які отримують замісну терапію гормонами щитоподібної залози, можуть потребувати вищих доз тиреоїдного гормону, оскільки на тлі застосування КОК сироваткова концентрація глобуліну, що зв’язує тиреоїдні гормони, зростає.
Взаємодія з препаратами, що можуть підвищувати сироватковий рівень калію. У жінок, які приймають препарат Ярина® Плюс одночасно з іншими препаратами, що можуть підвищувати рівень калію в сироватці крові, існує імовірність зростання сироваткової концентрації калію (див. розділ «Особливості застосування»).
Було проведено дослідження з вивчення медикаментозної взаємодії, в якому порівнювали застосування дроспіренону 3 мг/естрадіолу 1 мг і плацебо у 24 жінок постклімактеричного віку з артеріальною гіпертензією помірного ступеня, що приймали еналапрілу малеат у дозі 10 мг двічі на добу. Рівень калію перевіряли у всіх учасниць дослідження через день протягом 2 тижнів. Середня сироваткова концентрація калію в групі, що отримувала дроспіренон/естрадіол, була на 0,22 мекв/л вищою відносно вихідного рівня у плацебо-групі. Крім цього, рівень калію в сироватці крові вимірювався в окремих часових точках протягом 24 годин на вихідному рівні та на 14-й день. Станом на 14-й день співвідношення між Cmax і AUC сироваткового рівня калію в групі, що отримувала дроспіренон/естрадіол, і плацебо-групі було відповідно 0,955 (90 % ДІ: 0,914, 0,999) і 1,010 (90 % ДІ: 0,944, 1,08). У жодної пацієнтки з обох груп лікування не відмічено розвитку гіперкаліємії (рівень калію в сироватці крові ˃ 5,5 мекв/л).
Вплив фолатів на інші препарати. Фолати, такі як фолієва кислота і левомефолат кальцію, можуть змінювати фармакокінетичні або фармакодинамічні властивості певних антифолатів (наприклад протиепілептичні засоби, метотрексат).
Вплив інших препаратів на фолати. Повідомлялось, що окремі препарати (метотрексат, сульфасалазин, холестирамін, протиепілептичні препарати) викликають зниження рівня фолатів.
Доклінічні дані з безпеки
У ході дослідження канцерогенності у тварин, що тривало 24 місяці, при пероральному застосуванні 10 мг/кг/день дроспіренону або 1+0,01, 3+0,03 та 10+0,1 мг/кг/день дроспіренону та етинілестрадіолу, що становило 0,1-2 кратну експозицію (AUC дроспіренону) у жінок, які отримують контрацептиви, визначили збільшення випадків розвитку карциноми гардерової залози у групі, що отримувала монотерапію високими дозами дроспіренону. У схожому дослідженні в іншого виду тварин при пероральному застосуванні 10 мг/кг/день дроспіренону або 0,3+0,003, 3+0,03 та 10+0,1 мг/кг/день дроспіренону та етинілестрадіолу, що становило 0,8-10 кратну експозицію у жінок, які отримують контрацептиви, визначали збільшення випадків розвитку доброякісних та загальної кількості (доброякісних та злоякісних) феохромацитом надниркових залоз у групі, що отримувала монотерапію високими дозами дроспіренону. Дослідження мутагенності дроспіренону, що були проведеніin vivo таin vitro, не виявили свідчень мутагенної активності.
Довготривалих досліджень на тваринах для визначення канцерогенного потенціалу левомефолату не проводили. Дослідження мутагенності левомефолату, що були проведеніin vivo таin vitro, не виявили свідчень мутагенної активності.
Клінічні характеристики
Показання.
· Пероральна контрацепція.
Препарат Ярина® Плюс призначений для застосування жінкам з метою запобігання вагітності.
· Забезпечення фолатного статусу.
Препарат Ярина® Плюс призначати жінкам, які обрали пероральну контрацепцію як метод запобігання вагітності, для підвищення рівня фолатів з метою зменшення ризику виникнення дефекту нервової трубки.
Протипоказання.
Препарат Ярина® Плюс протипоказаний жінкам у разі наявності або виникнення нижчезазначених станів.
· Порушення функції нирок.
· Недостатність кори надниркових залоз.
· Високий ризик розвитку артеріального або венозного тромбозу. До цієї категорії, зокрема, належать жінки, які:
- палять і мають вік понад 35 років (див. розділ «Особливості застосування»);
- мають тромбоз глибоких вен або тромбоемболію легеневої артерії (ТЕЛА), у тому числі в анамнезі (див. розділ «Особливості застосування»);
- мають цереброваскулярне захворювання (див. розділ «Особливості застосування»);
- хворі на ішемічну хворобу серця (див. розділ «Особливості застосування»);
- мають тромбогенні вади клапана серця або тромбогенні порушення серцевого ритму (наприклад підгострий бактеріальний ендокардит з ураженням клапана або фібриляція передсердь(див. розділ «Особливості застосування»));
- хворі на спадкову або набуту гіперкоагулопатію (див. розділ «Особливості застосування»);
- хворі на неконтрольовану артеріальну гіпертензію (див. розділ «Особливості застосування»);
- хворі на цукровий діабет із судинними ускладненнями (див. розділ «Особливості застосування»);
- страждають на головні болі з вогнищевими неврологічними симптомами або мігрені з аурою або без і мають вік понад 35 років (див. розділ «Особливості застосування»).
· Аномальна маткова кровотеча нез’ясованої етіології (див. розділ «Особливості застосування».
· Рак молочної залози нині або в анамнезі, який може бути гормоночутливим (див. розділ «Особливості застосування»).
· Пухлини печінки, доброякісні або злоякісні, або захворювання печінки (див. розділ «Особливості застосування», «Спосіб застосування та дози»).
· Застосування комбінації лікарських засобів для лікування гепатиту С, що містять омбітасвір/паритапревір/ритонавір з або без додавання дасабувіру, внаслідок потенційного підвищення рівня АЛТ; застосування з лікарськими засобами, що містять глекапревір/пібрентасвір та софосбувір/велпатасвір/воксилапревір (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Для отримання більш детальної інформації про взаємодію з гормональними контрацептивами або про можливі ферментативні зміни перегляньте інструкції для медичного застосування всіх препаратів, що призначають одночасно з цим лікарським засобом.
Вплив інших препаратів на КОК
Речовини, що спричиняють зменшення ефективності КОК
Лікарські засоби та рослинні препарати, що індукують певні ферменти, в тому числі цитохром Р450 3А4 (CYP3A4), можуть знижувати ефективність КОК або посилювати проривні кровотечі. Препарати, які можуть зменшувати ефективність гормональних контрацептивів, включають: фенітоїн, барбітурати, карбамазепін, бозентан, фелбамат, гризеофульвін, окскарбазепін, рифампін, топірамат та лікарські засоби, що містять звіробій. Взаємодія оральних контрацептивів та інших лікарських засобів може призводити до проривної кровотечі та/або втрати ефективності контрацептиву. При терапії препаратами, що індукують ферменти, одночасно із застосуванням КОК альтернативний або додатковий методи контрацепції слід застосовувати протягом усього терміну лікування відповідним препаратом і ще протягом 28 днів після припинення його застосування для забезпечення повноцінної контрацепції.
Речовини, що спричиняють збільшення концентрації КОК у плазмі крові
При супутньому застосуванні аторвастатину та певних КОК, що містять етинілестрадіол, відмічається підвищення показників AUC етинілестрадіолу майже на 20 %. Аскорбінова кислота та ацетамінофен можуть призводити до збільшення концентрації етинілестрадіолу у плазмі крові, імовірно, через пригнічення кон’югації.
Супутнє застосування помірних або сильних інгібіторів CYP3A4, до яких належать азольні протигрибкові препарати (кетоконазол, ітраконазол, вориконазол, флуконазол), верапаміл, макроліди (наприклад, кларитроміцин, еритроміцин), дилтіазем та грейпфрутовий сік, може спричиняти підвищення концентрації у плазмі крові естрогену або прогестину чи їх обох речовин. У клінічному дослідженні з вивчення взаємодії препаратів, що проводилося за участю жінок передклімактеричного віку, при застосуванні 1 раз на добу препарату, що містив 3 мг дроспіренону/0,02 мг етинілестрадіолу, одночасно з потужним інгібітором CYP3A4 кетоконазолом у дозі 200 мг 2 рази на добу протягом 10 днів відмічалося помірне підвищення системної експозиції дроспіренону. Експозиція етинілестрадіолу збільшилася незначно (див. розділ «Особливості застосування» та «Фармакологічні властивості»).
Інгібітори протеази вірусу імунодефіциту людини (ВІЛ)/вірусу гепатиту С (ВГС) та ненуклеозидні інгібітори зворотної транскриптази
У деяких випадках при одночасному застосуванні КОК з інгібіторами протеази ВІЛ/ВГС або ненуклеозидними інгібіторами зворотної транскриптази спостерігалися значні зміни (збільшення або зменшення) плазмової концентрації естрогену та прогестину.
Антибактеріальні засоби
Є повідомлення про випадки настання вагітності під час застосування гормональних контрацептивів та антибіотиків, однак клінічні дослідження з вивчення фармакокінетичних властивостей не виявили стійкого впливу антибіотиків на концентрацію синтетичних стероїдів у плазмі крові.
Вплив КОК на інші препарати
КОК із вмістом етинілестрадіолу можуть пригнічувати метаболізм інших препаратів. Встановлено, що КОК значно знижують концентрацію ламотриджину в плазмі крові, імовірно, через індукування глюкуронування ламотриджину. Внаслідок цього можливе зменшення контролю над судомною активністю, тому може потребуватися корекція дози ламотриджину. Для отримання більш детальної інформації про взаємодію з КОК або про можливі ферментативні зміни слід переглянути інструкції для медичного застосування всіх препаратів, що призначаються одночасно з цим лікарським засобом.
КОК, що підвищують концентрацію ферментів цитохрому CYP450 у плазмі крові
У ході клінічних досліджень на тлі застосування гормональних контрацептивів із вмістом етинілестрадіолу підвищення концентрації субстратів CYP3А4 (наприклад, мідазолам) у плазмі крові було відсутнє або мало незначний ступінь, тоді як плазмові концентрації субстратів CYP2C19 (наприклад, омепразол та вориконазол) і субстратів CYP1A2 (наприклад, теофілін та тизанідин) могли підвищуватися у діапазоні від незначного до помірного ступеня.
Клінічні дослідження не вказують на наявність інгібіторного потенціалу у дроспіренону відносно CYP-ферментів людини при застосуванні у клінічно значущих концентраціях (див. розділ «Фармакологічні властивості»).
Жінки, які отримують замісну терапію гормонами щитоподібної залози, можуть потребувати вищих доз тиреоїдного гормону, оскільки на тлі застосування КОК сироваткова концентрація глобуліну, що зв’язує тиреоїдні гормони, зростає.
Взаємодія з препаратами, що можуть підвищувати сироватковий рівень калію
У жінок, які приймають препарат Ярина® Плюс одночасно з іншими препаратами, що можуть підвищувати рівень калію у сироватці крові, існує імовірність зростання сироваткової концентрації калію (див. розділи «Особливості застосування», «Фармакологічні властивості»).
Вплив фолатів на інші лікарські засоби
Фолати можуть змінювати фармакокінетичні або фармакодинамічні властивості деяких препаратів-антифолатів, зокрема протиепілептичних засобів (наприклад фенітоїн), метотрексату або піриметаміну, що може призвести до зниження фармакологічного ефекту препаратів-антифолатів.
Вплив інших лікарських засобів на фолати
Повідомлялося, що окремі препарати викликають зниження рівня фолатів шляхом пригнічення ферменту дегідрофолатредуктази (наприклад, метотрексат та сульфасалазин), шляхом зменшення абсорбції фолатів (наприклад, холестирамін) або за допомогою невідомих механізмів (наприклад протиепілептичні препарати, такі як карбамазепін, фенітоїн, фенобарбітал, примідон та вальпроєва кислота).
Вплив на результати лабораторних досліджень
Застосування контрацептивних стероїдів може впливати на результати певних лабораторних аналізів, зокрема це стосується факторів коагуляції, рівня ліпідів, толерантності до глюкози та зв’язуючих білків. Дроспіренон збільшує активність реніну та альдостерону у плазмі крові, що індукується його помірною антимінералокортикоїдною активністю. Фолати можуть приховувати дефіцит вітаміну В12 (див. розділ «Особливості застосування» та підрозділ «Вплив КОК на інші препарати» розділу «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Під час клінічних досліджень із залученням пацієнтів, які отримували лікарські засоби для лікування інфекцій вірусного гепатиту С (ВГС), що містять омбітасвір/паритапревір/ритонавір і дасабувір з додаванням рибавірину або без такого, було виявлено підвищення трансамінази (АЛТ) більше ніж у 5 разів вище верхньої межі норми (ВМН). Це відбувалося зі значно більшою частотою у жінок, які застосовували лікарські засоби, що містять етинілестрадіол, зокрема і комбіновані гормональні контрацептиви (КГК). Крім того, під час лікування глекапревіром/пібрентасвіром або софосбувіром/велпатасвіром/воксилапревіром спостерігалося підвищення АЛТ у жінок, які приймали лікарські засоби, що містять етинілестрадіол, такі як КГК (див. розділ «Протипоказання»).
Особливості застосування.
Паління та серйозні серцево-судинні ускладнення
Паління підвищує ризик розвитку серйозних серцево-судинних ускладнень на тлі застосування КОК. Цей ризик зростає з віком та з кількістю випалених за день цигарок. Тому КОК не слід застосовувати жінкам у віці старше 35 років, які палять (див. розділ «Протипоказання»).
Тромбоемболічні розлади та інші судинні захворювання
Застосування препарату Ярина® Плюс слід припинити в разі розвитку артеріальних або венозних тромбоемболічних ускладнень.
Виходячи з наявної інформації стосовно КОК, що містять дроспіренон і 0,03 мг етинілестрадіолу (препарат «Ярина®»), КОК із вмістом дроспіренону асоціюються з більшим ризиком розвитку венозної тромбоемболії (ВTE), ніж КОК, що містять левоноргестрел або інші прогестини. За даними епідеміологічних досліджень порівняння ризиків ВTE, можлива як повна відсутність будь-якого підвищення ризику, так і його збільшення в три рази. Перед початком застосування препарату Ярина® Плюс у жінки, яка раніше не застосовували КОК, та у жінки, яка переходить з іншого контрацептива, який не містить дроспіренон, слід оцінити всі ризики та переваги застосування КОК із вмістом дроспіренону з огляду на імовірність розвитку ВTE. Додатково до інших факторів, чрез яких застосування КОК є протипоказаним, до відомих факторів ризику ВTE належать паління, ожиріння та ВTE у сімейному анамнезі (див. розділ «Протипоказання»).
У ряді досліджень порівнювали ризик ВTE у жінок, які приймали препарат Ярина® (що містить
0,03 мг етинілестрадіолу і 3 мг дроспіренону), та у жінок, які застосовували інші КОК, у тому числі з левоноргестрелом. Результати досліджень, що проводили на вимогу або за сприяння регуляторних органів, узагальнені у таблиці 2.
Таблиця 2
Розрахункові дані (відносний ризик) розвитку венозної тромбоемболії у жінок, які отримують препарат Ярина®, порівняно з жінками, які приймають оральні контрацептиви з вмістом інших прогестинів
Епідеміологічне дослідження (автори, рік публікації) Популяція дослідження | Препарат порівняння (всі препарати - низькодозовані КОК; вміст етинілестрадіолу становить ≤ 0,04 мг) | Відносний ризик (ВР) (95% ДІ) |
i3 Ingenix (Seeger 2007) Жінки, які розпочинають застосування | Всі КОК, що були наявні в США під час проведення дослідженняb | ВР: 0,9 (0,5-1,6) |
EURAS (Dinger 2007) Жінки, які розпочинають застосуванняа | Всі КОК, що були наявні в Європі під час проведення дослідженняс Левоноргестрел/ЕЕ | ВР: 0,9 (0,6-1,4) ВР: 1,0 (0,6-1,8) |
Дослідження за фінансування FDA (2011) Жінки, які не користувалися комбінованими гормональними контрацептивами щонайменше протягом попередніх 6 місяціва Усі жінки, які застосовують комбіновані гормональні контрацептивиа (в тому числі ті, які розпочинають та продовжують застосування комбінованого гормонального контрацептива, що вивчається в дослідженні) | Інші КОК, наявні під час проведення дослідженняd Левоноргестрел/0,03 мг ЕЕ Інші КОК, наявні під час проведення дослідженняd Левоноргестрел/0,03 мг ЕЕ | ВР: 1,8 (1,3-2,4) ВР: 1,6 (1,1-2,2) ВР: 1,7 (1,4-2,1) ВР: 1,5 (1,2-1,8) |
а) в тому числі жінки, які не користувалися комбінованими гормональними контрацептивами щонайменше протягом попередніх 6 місяців
b) включаючи низькодозовані КОК, що містять такі прогестини: норгестимат, норетиндрон, левоноргестрел, дезогестрел, норгестрел, медроксипрогестерон або етинодіолу діацетат
с) включаючи низькодозовані КОК, що містять такі прогестини: левоноргестрел, дезогестрел, дієногест, хлормадинону ацетат, гестоден, ципротерону ацетат, норгестимат або норетиндрон
d) включаючи низькодозовані КОК, що містять такі прогестини: норгестимат, норетиндрон або левоноргестрел
Окрім вищенаведених «регуляторних досліджень», також проводили інші дослідження з різними цілями. Загалом було проведено два проспективних когортних дослідження (див. таблицю 2): постмаркетингове дослідження з вивчення безпеки (США) Ingenix (Seeger 2007) і Європейське постмаркетингове дослідження з вивчення безпеки EURAS (Європейське активне моніторингове дослідження) (Dinger 2007). У продовженні дослідження EURAS, Довготривалому активному моніторинговому дослідженні (LASS), не залучали додаткових осіб, а проводили подальшу оцінку ризику розвитку ВТЕ. Також було проведено три ретроспективних когортних дослідження: одне в США за фінансування FDA (див. таблицю 2), і два - в Данії (Lidegaard 2009, Lidegaard 2011). Окрім цього, було проведено два дослідження «випадок-контроль»: одне в Данії - аналітичне дослідження MEGA (van Hylckama Vlieg 2009) і одне в Німеччині (Dinger 2010). На додаток до цього проводилося два когортних дослідження типу «випадок-контроль», в яких оцінювався ризик розвитку нелетальної ідіопатичної ВТЕ: дослідження PharMetrics (Jick 2011) і дослідження GPRD (Parkin 2011). Результати всіх цих досліджень наведені на Рис. 1.
Рис 1. Ризик розвитку ВТЕ на тлі застосування препарату «Ярина®» та при застосуванні КОК, що містять левоноргестрел (скоригований ризик#)

Відношення ризиків відображені на логарифмічній шкалі; відношення ризиків <1 означає нижчий ризик розвитку ВТЕ при застосуванні дроспіренону, а ˃1 означає підвищений ризик розвитку ВТЕ дроспіренону.
*Препарат порівняння «інші КОК», в тому числі вмістом левоноргестрелу.
†LASS - продовження дослідження EURAS.
#Деякі додаткові параметри позначені надрядковими літерами: а) інтенсивне паління; b) артеріальна гіпертензія; с) ожиріння; d) сімейний анамнез; е) вік; f) ІМТ; g) час застосування; h) ВТЕ в анамнезі; і) період включення; j) календарний рік; k) освіта; l) тривалість використання; m) здатність до дітонародження; n) хронічне захворювання; о) супутні лікарські засоби; р) паління; q) тривалість експозиції; r) місце
(Посилання: Ingenix (Seeger 2007), EURAS (Європейське активне моніторингове дослідження) (Dinger 2007), LASS (Довготривалe активне моніторингове дослідження) (Dinger, неопублікований документ), Дослідження за фінансування FDA (Sidney 2011), Датське дослідження (Lidegaard 2009), Датський повторний аналіз (Lidegaard 2011), дослідження MEGA (van Hylckama Vlieg 2009), Німецьке дослідження «випадок-контроль» (Dinger 2010), PharMetrics (Jick 2011), дослідження GPRD (Parkin 2011)10).
Незважаючи на підвищення абсолютних показників ризику розвитку ВТЕ у жінок, які приймають гормональні контрацептиви, порівняно з особами, які не застосовували їх, частота виникнення ВТЕ у період вагітності є ще більшою, особливо у післяпологовий період (див. рис.2). За оцінками, ризик ВТЕ у жінок, які користуються КОК, становить від 3 до 9 випадків на 10000 жінко-років. Найвищий ризик ВТЕ спостерігається протягом першого року застосування КОК. Дані великого проспективного когортного дослідження з вивчення безпеки різних КОК дозволяють зробити припущення, що таке підвищення ризику, якщо порівнювати з особами, які не приймають КОК, є найвищим протягом перших 6 місяців застосування КОК. Результати цього дослідження вказують, що найбільший ризик розвитку ВТЕ відмічається на початку використання КОК або після відновлення прийому (після перерви тривалістю 4 тижні або більше) КОК (того самого або іншого).
Після припинення застосування КОК ризик розвитку тромбоемболічних ускладнень, спричинений прийомом оральних контрацептивів, поступово зникає.
На рис.2 відображено ризик розвитку ВТЕ у жінок, які не є вагітними і не використовують оральні контрацептиви; для жінок, які приймають оральні контрацептиви; для вагітних жінок та жінок у післяпологовий період. Ризик виникнення ВТЕ у перспективі виглядає таким чином: якщо прослідкувати за станом здоров’я 10000 жінок, які не є вагітними і не приймають оральні контрацептиви, протягом 1 року, з’ясується, що ВТЕ виникне у 1-5 з таких жінок.
Рис. 2. Імовірність розвитку ВТЕ
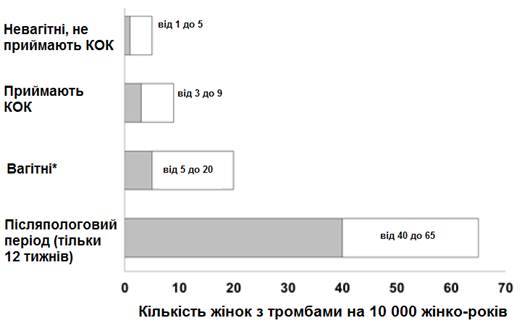
*Дані щодо вагітних розраховані згідно з фактичною тривалістю вагітності відповідно до результатів контрольних досліджень. Виходячи з даних, що вагітність триває дев’ять календарних місяців, частота становить 7 - 27 випадків на 10000 жінко-років.
У разі можливості необхідно припинити застосування препарату Ярина® Плюс принаймні за 4 тижні до великих операцій або інших хірургічних втручань, при яких підвищується ризик тромбоемболії, та не використовувати препарат протягом 2 тижнів після таких операцій.
Жінки, які не годують груддю, можуть розпочинати прийом препарату Ярина® Плюс не раніше ніж через 4 тижні після пологів. Ризик післяпологової тромбоемболії знижується через 3 тижні після пологів, тоді як саме в цей час ризик овуляції підвищується.
Застосування КОК також спричиняє підвищення ризику артеріальних тромбозів, зокрема інсульту та інфаркту міокарда, особливо у жінок з іншими факторами ризику розвитку згаданих розладів.
Встановлено, що КОК підвищують як відносний, так і популяційний ризик розвитку цереброваскулярних явищ (ішемічний та геморагічний інсульт), хоча загалом ризик є вищим у жінок старшого віку (˃35 років), хворих на артеріальну гіпертензію, які палять. Застосування КОК також підвищує ризик інсульту у жінок з іншими основними факторами ризику.
Застосування оральних контрацептивів жінкам з факторами ризику розвитку цереброваскулярних захворювань потребує обережності.
Застосування препарату Ярина® Плюс слід припинити при втраті зору нез’ясованої етіології, проптозі, диплопії, набряку диска зорового нерва та судинних ураженнях сітківки. Необхідно негайно зробити обстеження щодо виявлення можливого тромбозу ретинальних вен (див. розділ «Побічні реакції»).
Гіперкаліємія
Препарат Ярина® Плюс містить 3 мг прогестину дроспіренону, який має антимінералокортикоїдні властивості, в тому числі може спричиняти гіперкаліємію у пацієнток, які належать до групи підвищеного ризику. Вказана властивість дроспіренону аналогічна дії спіронолактону в дозі 25 мг. Препарат Ярина® Плюс протипоказаний для застосування пацієнткам із захворюваннями, що провокують розвиток гіперкаліємії (наприклад, порушення функції нирок, порушення функції печінки та недостатність кори надниркових залоз). У жінок, які отримують щоденну тривалу терапію хронічних станів або захворювань препаратами, здатними підвищувати рівень калію у сироватці крові, необхідно впродовж курсу лікування контролювати сироваткову концентрацію калію. До лікарських засобів, що можуть підвищувати рівень калію у сироватці крові, належать інгібітори АПФ, антагоністи рецепторів ангіотензину ІІ, калійзберігаючі діуретики, калієві добавки, гепарин, антагоністи альдостерону та НПЗП. Слід розглянути можливість здійснення моніторингу сироваткових концентрацій калію у пацієнток з групи підвищеного ризику, які проходять супутню довготривалу терапію із застосуванням потужного інгібітора цитохрому CYP3A4. Потужні інгібітори CYP3A4 включають азольні протигрибкові препарати (наприклад, кетоконазол, ітраконазол, вориконазол), інгібітори протеази ВІЛ/ВГС (наприклад, індинавір, боцепревір) та кларитроміцин (див. розділ «Фармакологічні властивості»).
Рак молочної залози
Лікарський засіб Ярина® Плюс протипоказаний жінкам, які мають рак молочної залози нині або в анамнезі, оскільки рак молочної залози може бути гормоночутливим.
Епідеміологічні дослідження не виявили стійкого зв’язку між використанням комбінованих оральних контрацептивів (КОК) і ризиком розвитку раку молочної залози. Дослідження не показують зв’язку між застосуванням КОК будь-коли (нині чи в минулому) та ризиком розвитку раку молочної залози. Однак деякі дослідження вказують на невелике підвищення ризику розвитку раку молочної залози у жінок, які застосовують нині або нещодавно застосовували КОК (< 6 місяців з моменту останнього застосування), а також жінок, які застосовують КОК протягом більш тривалого часу (див. розділ «Побічні реакції»).
Рак шийки матки
Результати деяких досліджень свідчать, що застосування КОК асоціюється зі зростанням ризику розвитку раку шийки матки або інтраепітеліальної неоплазії. Проте не досягнуто єдиної думки щодо того, наскільки ці результати можуть бути зумовлені відмінностями у статевій поведінці та іншими факторами.
Найважливішим фактором ризику раку шийки матки є папіломавірусна інфекція людини.
Захворювання печінки
При появі жовтяниці застосування препарату Ярина® Плюс припиняють. У пацієнток із порушенням функції печінки можливе порушення метаболізму стероїдних гормонів. При гострих або хронічних порушеннях функції печінки може виникнути необхідність припинити прийом КОК, поки показники функції печінки не повернуться до норми і буде виключено причинний зв’язок із прийомом КОК.
Виникнення аденоми печінки асоціюється із застосуванням КОК. За розрахунками, цей ризик становить 3,3 випадки на 100000 жінок, які приймають КОК. Розрив аденоми печінки може мати летальні наслідки через внутрішньочеревну кровотечу.
Дослідження показали підвищення ризику розвитку печінково-клітинного раку в осіб, які застосовують КОК протягом тривалого часу (˃8 років). Однак ризик виникнення раку печінки у жінок, які застосовують КОК становить менше 1 випадка на мільйон осіб.
У поодиноких випадках у жінок, які застосовують КОК, спостерігалися доброякісні, а ще рідше - злоякісні пухлини печінки, що в окремих випадках призводили до небезпечної для життя внутрішньочеревної кровотечі. У разі виникнення скарг на сильний біль в епігастральній ділянці, збільшення печінки або ознаки внутрішньочеревної кровотечі при диференційній діагностиці слід враховувати можливість наявності пухлини печінки при застосуванні КОК.
У жінок, які мають в анамнезі випадки холестазу, пов’язаного з вагітністю, можливий розвиток холестазу, що асоціюється із застосуванням оральних контрацептивів. У жінок з холестазом, зумовленим КОК, в анамнезі можуть розвиватися рецидиви при повторному застосуванні КОК.
Ризик підвищення рівня печінкових ферментів при одночасному застосуванні препаратів для лікування вірусного гепатиту С
Слід припинити застосування препарату Ярина® Плюс перед початком терапії комбінацією омбітасвір/паритапревір/рітонавір з/ без додавання дасабувіру (див. розділ «Протипоказання»). Відновити застосування препарату Ярина® Плюс можна приблизно через 2 тижні після завершення курсу застосування лікарських засобів для терапії вірусного гепатиту С.
Підвищення артеріального тиску
У жінок з добре контрольованою артеріальною гіпертензією слід відстежувати показники артеріального тиску та припинити застосування препарату Ярина® Плюс при їх значному підвищенні. Жінкам з неконтрольованою артеріальною гіпертензією або гіпертензією з супутніми іншими судинними захворюваннями не повинні приймати КОК.
У жінок, які приймали КОК, спостерігалось про підвищення артеріального тиску, що виникає частіше у жінок старшого віку та при тривалому застосуванні препарату. Частота виникнення артеріальної гіпертензії зростає зі збільшенням концентрації прогестину.
Захворювання жовчного міхура
Результати досліджень вказують на незначне підвищення відносного ризику розвитку захворювань жовчного міхура у жінок, які застосовують КОК.
Вплив на вуглеводний та ліпідний обмін
Жінки зі схильністю до розвитку цукрового діабету та пацієнтки, які страждають на діабет, мають перебувати під ретельним наглядом під час застосування препарату Ярина® Плюс. КОК можуть спричиняти дозозалежне зниження толерантності до глюкози.
Для жінок з неконтрольованою дисліпідемією слід розглянути можливість використання альтернативних засобів контрацепції. У незначної частини жінок на тлі застосування КОК відбуваються несприятливі зміни ліпідного обміну.
У жінок із гіпертригліцеридемією або наявністю у сімейному анамнезі цього розладу при застосуванні КОК підвищується ризик розвитку панкреатиту.
Головний біль
Якщо у жінки, яка приймає препарат Ярина® Плюс, виникають головні болі, які мають рецидивний характер, є стійкими або інтенсивними, слід ретельно вивчити випадок та, у разі
потреби, відмінити застосування препарату Ярина® Плюс.
Збільшення частоти або тяжкості мігреней на тлі застосування КОК (що може бути попередником цереброваскулярного розладу) може бути підставою для негайної відміни КОК.
Нерегулярні кровотечі
На тлі застосування КОК у пацієнток іноді виникають нерегулярні (проривні або внутрішньоциклові) кровотечі та кровомазання, особливо протягом перших трьох місяців прийому. У разі стійких кровотеч або появи кровотечі після попереднього регулярного циклу слід обстежити жінку на наявність вагітності та щодо злоякісних новоутворень. Якщо патологію та вагітність виключено, нерегулярні кровотечі можуть зникнути з часом або після переходу на інший КОК.
Дані десяти клінічних досліджень контрацептивної ефективності препарату Ярина® (N = 2467) показали, що кількість жінок, які застосовували препарат Ярина® та у яких були незаплановані кровотечі, зменшилася з 12 % у циклі 2 до 6 % (цикл 13). 25 пацієнток з 3009 у ході досліджень застосування препарату Ярина® та препарату Ярина® Плюс (<1 %) припинили участь у дослідженнях через скарги на кровотечі. Скарги описані як метрорагія, вагінальна кровотеча, менорагія, аномальні кровотечі відміни та менометрорагія.
Середня кількість днів кровотечі у більшості пацієнток (86-88 %) становила 4-7 днів. У пацієнток, які застосовували препарат Ярина® Плюс, може спостерігатися відсутність кровотечі відміни, навіть якщо вони не вагітні. Згідно з записами пацієнток у щоденниках, проаналізованими у ході досліджень контрацептивної ефективності препарату Ярина®, протягом 2-13 циклів, від 6 до 10 % мали цикли без кровотеч відміни. У деяких жінок може зустрічатися аменорея або олігоменорея, спричинена прийомом протизаплідних таблеток, особливо якщо такі розлади відмічалися раніше.
При відсутності кровотечі відміни слід розглянути можливість наявності вагітності. Якщо пацієнтка не дотримувалася призначеного режиму застосування препарату (пропустила прийом однієї або більше таблеток, що містили гормони, або почала приймати їх на день пізніше, ніж мала б почати), при першій відсутності кровотечі відміни необхідно враховувати імовірність вагітності і вжити необхідних діагностичних заходів. Якщо пацієнтка дотримувалася призначеного режиму застосування препарату і у неї відсутні дві кровотечі відміни поспіль, необхідно виключити вагітність.
Депресія
Жінки з депресією в анамнезі повинні перебувати під ретельним наглядом; при рецидивах депресії тяжкого ступеня препарат Ярина® Плюс слід відмінити.
Вплив на результати лабораторних досліджень
Застосування контрацептивних стероїдів може впливати на результати певних лабораторних аналізів, зокрема це стосується факторів коагуляції, рівня ліпідів, толерантності до глюкози та зв’язуючих білків. Жінки, які отримують замісну терапію гормонами щитоподібної залози, можуть потребувати вищих доз тиреоїдного гормону, оскільки на тлі застосування КОК сироваткова концентрація глобуліну, що зв’язує тиреоїдні гормони, зростає. Дроспіренон збільшує активність реніну та альдостерону у плазмі крові, що індукується його помірною антимінералокортикоїдною активністю. Фолати можуть приховувати дефіцит вітаміну В12.
Моніторинг
Жінки, які приймають КОК, повинні щорічно відвідувати свого лікаря з метою контролю артеріального тиску та проведення інших необхідних обстежень.
Інші стани
Екзогенні естрогени можуть індукувати або посилювати симптоми спадкового та набутого ангіоневротичного набряку.
У поодиноких випадках може розвиватися хлоазма, особливо у жінок, які раніше мали хлоазму вагітних. Жінки зі схильністю до появи хлоазми повинні уникати впливу сонячного або ультрафіолетового випромінювання під час прийому КОК.
Випадки хвороби Крона та виразкового коліту також спостерігалися під час застосування КОК.
Кожна таблетка оранжевого кольору препарату містить 45 мг лактози, кожна таблетка світло-оранжевого кольору містить 48 мг лактози. При наявності рідкісних спадкових станів непереносимості галактози, дефіциту лактази Лаппа або мальабсорбції глюкози-галактози, у разі перебування на безлактозній дієті слід враховувати зазначену кількість лактози.
Застосування у період вагітності або годування груддю.
Вагітність.
Не застосовується для контрацепції під час вагітності, тому необхідно припинити застосування препарату Ярина® Плюс під час вагітності. Епідеміологічні дослідження та результати мета-аналізів не виявили збільшення ризику виникнення вроджених вад розвитку статевих та інших органів (у тому числі пороків серця та дефектів зменшення кінцівок) після прийому КГК до зачаття або на ранніх строках вагітності. У загальній популяції в США розрахунковий фоновий ризик серйозних вроджених вад і викиднів у разі клінічно підтвердженої вагітності становить від 2 до 4% і від 15 до 20% відповідно.
Дані
Дані досліджень за участю людей.Ретроспективне дослідження бази даних жінок у Норвегії, яке включало 44 734 вагітності, з яких 368 були у жінок, які випадково приймали дроспіренон/етинілестрадіол протягом першого триместру вагітності, виявило відсутність негативного впливу, як-от передчасні пологи, малий розмір плода для гестаційного віку або низька маса тіла при народженні (z-score).
Післяреєстраційні дані щодо побічних явищ при застосуванні лікарського засобу Ярина® Плюс вагітними жінками свідчать про те, що частота викиднів і вроджених аномалій не була вищою за розрахунковий фоновий ризик у загальній популяції.
Годування груддю
Дроспіренон проникає в грудне молоко. Після одноразового перорального прийому таблеток 3мг дроспіренону /0,03мг етинілестрадіолу концентрація дроспіренону у грудному молоці протягом 24годин становила від1,4 до 7,0нг/мл із середнім значенням± стандартне відхилення 3,7±1,9нг/мл. Розрахункова середня доза для немовлят становила 0,003мг/добу, що відповідає приблизно 0,1% дози для матері (див. нижче «Дані»).Інформація про вплив лікарського засобу Ярина® Плюс на немовлят, які знаходяться на грудному вигодовуванні, є обмеженою. КГК можуть зменшувати вироблення молока в жінок, які годують груддю. Таке зменшення може відбутися в будь-який час, але менш імовірно, що це станеться після того, як режим грудного вигодовування буде добре налагоджено. У разі можливості жінкам, які годують груддю, потрібно рекомендувати використовувати інші методи контрацепції до завершення періоду грудного вигодовування (див. також розділ «Спосіб застосування та дози»). Підвищення концентрації фолату в молоці не очікується (див. нижче «Дані»).
Необхідно враховувати переваги грудного вигодовування для розвитку та здоров’я дитини поряд з клінічною потребою матері в застосуванні лікарського засобу Ярина® Плюс та будь-яким потенційним несприятливим впливом на дитину, яка знаходиться на грудному вигодовуванні, від застосування лікарського засобу Ярина® Плюс або від основного захворювання матері.
Дані
Дані досліджень за участю людей.У відкритому дослідженні оцінювали ступінь проникнення дроспіренону у грудне молоко протягом 72годин після одноразового перорального застосування таблеток 3мг дроспіренону /0,03мг етинілестрадіолу у 6 здорових жінок, які годували груддю і у яких після пологів минуло від 1тижня до 3місяців. Дроспіренон було виявлено в грудному молоці, середнє значення Cmax становило 13,5нг/мл, тоді як середнє значення Cmax у сироватці крові жінок, які годують груддю, становило 30,8нг/мл. Концентрація дроспіренону у грудному молоці протягом 24-годинного періоду після застосування 3мг дроспіренону /0,03мг етинілестрадіолу становила від1,4 до 7,0нг/мл, а середнє значення± стандартне відхилення становило 3,7±1,9нг/мл. З огляду на дані щодо одноразового застосування 3мг дроспіренону /0,03мг етинілестрадіолу була розрахована максимальна добова доза дроспіренону у немовлят, яка становить 0,003мг/добу, що в середньому відповідає 0,1% дози для матері.
Дослідження за участю приблизно 60жінок, які годували груддю, не виявило суттєвих відмінностей у концентраціях фолату в молоці жінок, які отримували 416мкг/добу [6S]-5-метилтетрагідрофолату або 400мкг/добу фолієвої кислоти, та жінок, які отримували плацебо, протягом 16-тижневого періоду. Наявні результати досліджень вказують на відсутність несприятливого впливу фолату на немовлят, які перебувають на грудному годуванні.
Здатність впливати на швидкість реакції при керуванні автотранспортом або з механізмами.
Не проводили досліджень щодо впливу на здатність керувати автотранспортом або механізмами. Не повідомлялося про вплив на здатність керувати автотранспортом або працювати з механізмами у жінок, які приймають комбіновані оральні контрацептиви.
Спосіб застосування та дози.
Як приймати препарат Ярина® Плюс
Приймають по 1 таблетці перорально в один і той самий час кожного дня. При пропуску прийому таблеток або неправильному застосуванні препарату ефективність може знижуватися.
Для досягнення максимального контрацептивного ефекту препарат Ярина® Плюс слід застосовувати згідно з призначенням та з дотриманням вказівок, зазначених на блістерній упаковці. У разі пропуску прийому 1 таблетки її слід прийняти якомога швидше.
Як почати застосування препарату Ярина® Плюс
Починати прийом препарату Ярина® Плюс необхідно у перший день менструального циклу (початок у 1-й день циклу) або у першу неділю після початку менструального циклу (початок у неділю).
·Початок у 1-й день циклу
Протягом першого циклу застосування препарату Ярина® Плюс жінка повинна приймати по
1 оранжевій таблетці препарату щоденно, починаючи з 1-го дня менструального циклу (перший день менструації - це 1-й день циклу). Пацієнтка має приймати по 1 оранжевій таблетці препарату Ярина® Плюс на день протягом 21 дня поспіль, після чого упродовж 22-28 днів циклу приймати по 1 світло-оранжевій таблетці на добу. Препарат Ярина® Плюс слід приймати згідно з вказівками, що містяться на упаковці, в один і той самий час кожного дня, бажано після вечері або перед сном, запиваючи невеликою кількістю рідини, у разі потреби. Прийом препарату Ярина® Плюс не залежить від вживання їжі. У разі першого прийому таблеток Ярина® Плюс не у 1-й день менструального циклу, а пізніше, контрацептивна ефективність препарату настає тільки після перших 7 днів його безперервного застосування. У такому разі необхідне додаткове використання негормональних засобів контрацепції протягом перших 7 днів прийому препарату Ярина® Плюс. Слід враховувати можливість настання овуляції та запліднення до початку застосування препарату.
·Початок у неділю
Протягом першого циклу застосування препарату Ярина® Плюс жінка повинна приймати по
1 оранжевій таблетці Ярина® Плюс щоденно протягом 21 дня поспіль, після чого впродовж 22-28 днів циклу приймати по 1 світло-оранжевій таблетці на добу. Препарат Ярина® Плюс слід приймати згідно з вказівками, зазначеними на упаковці, в один і той самий час кожного дня, бажано після вечері або перед сном, запиваючи невеликою кількістю рідини, у разі потреби. Прийом препарату Ярина® Плюс не залежить від вживання їжі. Контрацептивна ефективність препарату Ярина® Плюс настає не раніше ніж через 7 днів його безперервного застосування. Необхідне додаткове застосування негормональних засобів контрацепції протягом перших 7 днів прийому препарату Ярина® Плюс. Слід враховувати можливість настання овуляції та запліднення до початку застосування препарату.
Пацієнтка повинна розпочинати другий і всі наступні 28-денні курси прийому препарату Ярина® Плюс у той самий день тижня, що й перший курс та дотримуватись однакової схеми застосування. Прийом оранжевих таблеток розпочинати наступного дня після прийому останньої світло-оранжевої таблетки, що містить фолат, незалежно від того, настала менструація або ще очікується. Кожного разу, коли наступний курс препарату Ярина® Плюс розпочинається не наступного дня після прийому останньої світло-оранжевої таблетки, а пізніше, пацієнтка повинна користуватися іншим методом контрацепції, поки період прийому оранжевих таблеток препарату Ярина® Плюс не становитиме 7 днів поспіль.
Перехід з інших протизаплідних таблеток
При переході з інших протизаплідних таблеток застосування препарату Ярина® Плюс розпочинати у день, коли необхідно було б розпочати прийом таблеток з нової упаковки попереднього орального контрацептива.
Перехід з іншого методу контрацепції, окрім протизаплідних таблеток
При переході з трансдермального пластиру або вагінального кільця препарат Ярина® Плюс починати приймати у день настання строку наступного застосування зазначених засобів контрацепції. При переході з ін’єкційних контрацептивів препарат Ярина® Плюс розпочинають застосовувати у день, коли мала б бути проведена наступна ін’єкція. При переході з внутрішньоматкового засобу або імплантата препарат Ярина® Плюс починати приймати у день їх видалення.
Кровотеча відміни зазвичай настає упродовж 3 днів після прийому останньої оранжевої таблетки. У разі появи кровомазання або проривної кровотечі під час прийому препарату Ярина® Плюс необхідне продовження його застосування згідно з режимом, наведеним вище. Такі кровотечі зазвичай є тимчасовими і не мають клінічного значення, однак у випадку стійкої або тривалої кровотечі жінку має оглянути лікар.
Незважаючи на те, що частота вагітності при застосуванні препарату Ярина® Плюс згідно з інструкцією є низькою, у разі відсутності кровотечі відміни слід враховувати можливість вагітності. У випадку недотримання пацієнткою призначеного режиму застосування (пропуск прийому 1 або більше активних таблеток чи початок їх застосування не у потрібний день, а пізніше) при першій відсутності кровотечі відміни необхідно враховувати можливість вагітності та вжити відповідних діагностичних заходів. Якщо пацієнтка дотримувалась призначеного режиму і у неї відсутні дві кровотечі поспіль, слід виключити наявність вагітності. При підтвердженні вагітності застосування препарату Ярина® Плюс потрібно припинити.
Ризик настання вагітності зростає з кожною пропущеною активною таблеткою оранжевого кольору.
Якщо проривна кровотеча з’являється після пропуску прийому таблеток, зазвичай це є тимчасовим явищем і не має наслідків. У разі пропуску пацієнткою прийому однієї або більше світло-оранжевих таблеток контрацептивний захист зберігається за умови, що у потрібний день вона почне новий курс прийому таблеток оранжевого кольору. Через підвищений ризик розвитку тромбоемболії жінкам у післяпологовий період, які не годують груддю, та жінкам після аборту у другому триместрі вагітності необхідно починати прийом препарату Ярина® Плюс не раніше ніж через 4 тижні після пологів. Якщо жінка починає застосування препарату Ярина® Плюс після пологів і ще не мала менструальної кровотечі, слід перевірити її на наявність вагітності та поінформувати про необхідність використання додаткового методу контрацепції, доки період безперервного прийому таблеток Ярина® Плюс не становитиме 7 днів.
Що робити у разі пропуску прийому таблетки
Таблиця 3
Правила застосуванняу разі пропуску прийому таблетки Ярина® Плюс
Пропущено прийом 1 оранжевої таблетки в упаковці. | Прийняти таблетку, як тільки пацієнтка згадає про пропуск. Приймати наступну таблетку у звичайний час. Це означає, що у такому випадку можливий прийом 2 таблеток в один день. У разі статевого акту немає потреби у додаткових методах контрацепції. |
Пропущено прийом 2 оранжевих таблеток у ряду «Тиждень 1» або «Тиждень 2» блістерної упаковки. | Прийняти 2 таблетки у день, в який згадано про пропуск, та 2 таблетки наступного дня. Далі приймати по 1 таблетці на день до закінчення упаковки. Якщо у наступні 7 днів після відновлення прийому таблеток відбудеться статевий акт, слід використовувати додатковий негормональний метод контрацепції (такі як презерватив та сперміциди) протягом цих 7 днів. |
Пропущено прийом 2 оранжевих таблеток у ряду «Тиждень 3» блістерної упаковки. | Якщо застосування препарату Ярина® Плюс було розпочато в 1-й день циклу, припинити прийом препарату з даної упаковки та розпочати прийом таблеток з нової упаковки того ж дня. Якщо застосування препарату Ярина® Плюс було розпочато в неділю, продовжувати прийом по 1 таблетці на день до неділі. У неділю припинити прийом препарату з даної упаковки та розпочати прийом таблеток з нової упаковки того ж дня. Якщо у наступні 7 днів після відновлення прийому таблеток відбудеться статевий акт, слід використовувати додатковий негормональний метод контрацепції (такі як презерватив та сперміциди) протягом цих 7 днів. Очікується, що в даному циклі буде відсутньою кровотеча відміни. Однак за умови відсутності двох кровотеч відміни поспіль у двох циклах необхідно виключити наявність вагітності. |
Пропущено прийом 3 або більше оранжевих таблеток у ряду протягом будь-якого тижня | Якщо застосування препарату Ярина® Плюс було розпочато в 1-й день циклу, слід припинити прийом препарату з даної упаковки та розпочати прийом таблеток з нової упаковки того ж дня. Якщо застосування препарату Ярина® Плюс було розпочато в неділю, продовжувати прийом по 1 таблетці на день до неділі. У неділю припинити прийом препарату з даної упаковки та розпочати прийом таблеток з нової упаковки того ж дня. Якщо у наступні 7 днів після відновлення прийому таблеток відбудеться статевий акт, слід використовувати додатковий негормональний метод контрацепції (такі як презерватив та сперміциди) протягом цих 7 днів. Очікується, що в даному циклі буде відсутньою кровотеча відміни. Однак за умови відсутності двох кровотеч відміни поспіль у двох циклах необхідно виключити наявність вагітності. |
Пропущено прийом будь-якої з 7 світло-оранжевих таблеток у ряду «Тиждень 4» | Вилучити пропущену таблетку з блістерної упаковки. Продовжувати прийом по 1 таблетці на день до закінчення таблеток у блістерній упаковці. Потреби у додаткових методах контрацепції немає. |
Якщо, незважаючи на наведені вище рекомендації, пацієнтка не впевнена у тому, яким чином діяти у разі пропуску прийому таблеток | Використовувати додатковий негормональний метод контрацепції (такі як презерватив та сперміциди) під час статевого акту. Звернутися за консультацією до лікаря та продовжувати прийом препарату по 1 активній оранжевій таблетці 1 раз на день, якщо не отримано інших рекомендацій. |
Рекомендації у випадку розладів з боку шлунково-кишкового тракту.
У разі тяжкого блювання або діареї можливе неповне всмоктування препарату. У такому разі слід застосовувати додаткові засоби контрацепції.
Якщо блювання почалось упродовж 3-4 годин після прийому таблетки Ярина® Плюс, ця ситуація схожа на пропуск прийому препарату, тому слід дотримуватись рекомендацій на випадок пропуску прийому таблеток.
Фолати.
Робоча група США з профілактичних заходів рекомендує жінкам репродуктивного віку щоденно доповнювати свій раціон принаймні 0,4 мг (400 мкг) фолієвої кислоти. Перед призначенням препарату Ярина® Плюс необхідно дізнатися, чи приймає жінка фолати, і враховувати це. Якщо застосування препарату Ярина® Плюс припиняється через настання вагітності, слід забезпечити продовження отримання фолатів жінкою.
Застосування особам літнього віку.
Застосування препарату Ярина® Плюс у жінок постклімактеричного віку не досліджувалось; препарат не призначати пацієнткам цієї вікової групи.
Пацієнтки з порушенням функції нирок.
Препарат Ярина® Плюс протипоказаний для застосування пацієнткам із порушенням функції нирок.
Вплив порушення функції нирок на фармакокінетичні властивості дроспіренону (в дозі 3 мг на добу протягом 14 днів) та вплив дроспіренону на концентрацію калію в сироватці вивчався на трьох окремих групах жінок (n = 28, вік 30-65). Усі особи перебували на дієті з низьким споживанням калію. Протягом дослідження 7 осіб продовжували приймати калійзберігаючі препарати для лікування їх основного захворювання. На 14-й день терапії дроспіреноном (рівноважний стан) сироваткові концентрації дроспіренону у групі з кліренсом креатиніну
50-79 мл/хв були аналогічними концентраціям у групі з кліренсом креатиніну ≥ 80 мл/хв. У осіб з кліренсом креатиніну 30-49 мл/хв сироваткові концентрації дроспіренону були в середньому на 37 % вищими, ніж у пацієнток з контрольної групи. При лікуванні дроспіреноном не відмічено жодного клінічно значущого впливу на рівень калію в сироватці крові. Незважаючи на те, що в дослідженні не спостерігалась гіперкаліємія, у 5 з 7 осіб, які продовжували застосування калійзберігаючих препаратів під час дослідження, середня сироваткова концентрація калію підвищилась до 0,33 мекв/л (див. розділи «Протипоказання» та «Особливості застосування»).
Пацієнтки з порушенням функції печінки.
Препарат Ярина® Плюс протипоказаний для застосування пацієнткам із хворобами печінки.
Середня експозиція дроспіренону у жінок із порушенням функції печінки помірного ступеня є майже втричі вищою за експозицію у жінок з нормальною функцією печінки. Препарат Ярина® Плюс не досліджувався у жінок із тяжкими порушеннями функції печінки (див. розділи «Протипоказання» та «Особливості застосування»).
Расові відмінності.
Не відмічено клінічно значущих відмінностей фармакокінетичних властивостей дроспіренону або етинілестрадіолу у японок та представниць європеоїдної раси (віком 25-35 років) при щоденному застосуванні препарату із вмістом 3 мг дроспіренону/0,02 мг етинілестрадіолу протягом 21 доби. Спеціальних дослідженнь щодо особливостей в інших етнічних групах не проводили.
Діти.
Безпека та ефективність застосування препарату Ярина® Плюс встановлені для жінок репродуктивного віку. Очікується, що препарат виявляє аналогічну ефективність у підлітків постпубертатного віку, до 18 років та у пацієнток віком від 18 років. Цей лікарський засіб не призначати до початку менструацій.
Передозування.
Повідомлення про серйозні несприятливі наслідки передозування, в тому числі при прийомі препарату дітьми, відсутні. Передозування може призводити до появи у жінок кровотечі відміни та нудоти.
Дроспіренон - це аналог спіронолактону, що має антимінералокортикоїдні властивості. При передозуванні слід здійснювати моніторинг концентрації калію та натрію у сироватці крові і відстежувати ознаки метаболічного ацидозу.
Левомефолат кальцію в дозі 17 мг на добу (що в 37 разів вище, ніж доза левомефолату кальцію у препараті Ярина® Плюс) добре переносився при тривалому лікуванні до 12 тижнів.
Побічні реакції.
Серйозні побічні реакції, відмічені при застосуванні КОК, описано в інших розділах цієї інструкції для медичного застосування:
• серйозні серцево-судинні розлади та інсульт (див. розділ «Особливості застосування»);
• судинні події (див. розділ «Особливості застосування»);
• захворювання печінки (див. розділ «Особливості застосування»).
Побічні реакції, які часто спостерігаються у жінок, які застосовують КОК:
• нерегулярні маткові кровотечі;
• нудота;
• болісність молочних залоз;
• головний біль.
Дані, отримані у ході клінічних досліджень
Оскільки умови проведення клінічних досліджень широко різняться, частота побічних реакцій, відмічена в одних дослідженнях, не може безпосередньо порівнюватись з частотою, зареєстрованою в інших клінічних дослідженнях, і може не відображати реальну частоту, що зустрічається на практиці.
Клінічні дослідження з вивчення контрацептивної дії та забезпечення фолатного статусу
Дані відображають досвід застосування препарату «Ярина®» (3 мг дроспіренон/0,03 мг етинілестрадіол) у адекватному контрольованому дослідженні контрацептивної дії (N = 2837) та забезпечення фолатного статусу (N = 172).
Щодо контрацептивної дії (N = 326) у США проведено мультицентрове відкрите дослідження участю здорових жінок віком від 18 до 35 років, які застосовували препарат «Ярина®» до 13 циклів. Друге реєстраційне клінічне дослідження (N = 442) - мультицентрове, рандомізоване, відкрите порівняльне Європейське дослідження застосування препарату «Ярина®» порівнянно з 0,150 мг дезогестрелу/0,03 мг етинілестрадіолу у здорових жінок віком від 17 до 40 років, які отримували препарати до 26 циклів. Для дослідження первинної ефективності із застосуванням препарату Ярина® Плюс для забезпечення фолатного статусу було проведено рандомізоване одноцентрове Європейське дослідження за участі 172 здорових жінок віком від 18 до 40 років для порівняння фармакодинамічних ефектів препарату «Ярина®» + 0,451 мг левомефолату кальцію та сумісного застосування препарату «Ярина®» з фолієвою кислотою протягом 24 тижнів лікування з наступним 20-тижневим відкритим дослідженням застосування препарату «Ярина®».
Побічні реакції, відмічені під час застосування за двома показаннями, збігаються і наводяться із зазначенням частоти відповідно до об’єднаних масивів даних. Найпоширенішими побічними реакціями (≥ 2 %) були: предменструальний синдром (12,4 %), головний біль/мігрень (10,3 %), болісність/чутливість молочних залоз/відчуття дискомфорту у молочних залозах (8,1 %), нудота/блювання (4,4 %), зміни настрою (депресія, депресивний стан, роздратованість, зміни настрою, зміни настрою та афективна лабільність (2,3 %)), абдомінальний біль/дискомфорт/ болісність (2,2 %).
Побічні реакції (≥1%), що вимагали припинення участі в дослідженнях
Клінічні дослідження з вивчення контрацептивної дії. З 2837 жінок 6,7 % припинили участь у дослідженнях через побічні реакції, найпоширенішими з яких були головні болі/мігрень (1,5 %).
Клінічні дослідження з вивчення ефективності додавання фолатів. Не спостерігалися реакції, що призводили до припинення участі в дослідженнях.
Серйозні побічні реакції
Клінічні дослідження з вивчення контрацептивної дії: депресія, легенева емболія, токсичний шкірний висип, лейоміома матки.
Клінічне дослідження з вивчення ефективності додавання фолатів: не відмічено жодних серйозних побічних реакцій.
Досвід післяреєстраційного застосування
У п’яти дослідженнях, в яких порівнювали ризик розвитку раку молочної залози у жінок, які коли-небудь застосовували КОК (нині чи у минулому), і у тих, хто ніколи не застосовував КОК, не було виявлено зв’язку між будь-яким застосуванням КОК і ризиком розвитку раку молочної залози з оцінкою ефекту в діапазоні від 0,9 до 1,12 (рис. 3).
У трьох дослідженнях порівнювали ризик розвитку раку молочної залози у жінок, які нині застосовують або нещодавно застосовували КОК (< 6 місяців з моменту останнього застосування), і у тих, хто ніколи не застосовував КОК (рис. 3). Одне з цих досліджень показало відсутність зв’язку між ризиком розвитку раку молочної залози та застосуванням КОК. Два інших дослідження виявили підвищений відносний ризик 1,19-1,33 при поточному або нещодавньому застосуванні. Обидва ці дослідження виявили підвищений ризик розвитку раку молочної залози при поточному тривалому застосуванні з відносним ризиком у діапазоні від 1,03 при застосуванні КОК менше одного року до приблизно 1,4 при застосуванні КОК понад 8-10 років.
Рис. 3. Дослідження ризику розвитку раку молочної залози при застосуванні комбінованих оральних контрацептивів
Жінки, які коли-небу д ь застосовували КОК, порівняно з жінками, які ніколи не застосовували КОК NICHD дослідження жінок CARE, Marchbanks PA. 2002 Французьке E3N когортне дослідження, Dumeaux V. 2005 Шанхайське дослідження здоров’я жінок, Dorjgochoo T. 2009 Дослідження здоров’я медичних сестер ІІ, Hunter DJ. 2010 Оксфордське дослідження планування сім’ї, Vessey M. 2013 Жінки, які нині застосовують КОК, порівняно з жінками, які ніколи не застосовували КОК NICHD дослідження жінок CARE, Marchbanks PA. 2002 Дослідження здоров’я медичних сестер ІІ, Hunter DJ. 2010 Датське реєстрове дослідження впливу статевих гормонів, Morch LS.2017 |
| ВШ: 0,90 (0,80; 1,00) ВР: 0,91 (0,81; 1,03) ВРˊ: 1,05 (0,84; 1,31) ВР: 1,12 (0,95; 1,33) ВР: 1,00 (0,90; 1,10) ВШ: 1,00 (0,80; 1,30) ВР: 1,33 (1,03; 1,73) ВР: 1,19 (1,13; 1,26) |
-1,50 -1,00 -0,50 0,00 1,00 1,50 2,00 Оцінка ефекту | ||
ВР - відносний ризик; ВШ - відношення шансів; ВРˊ - відношення ризиків; «коли-небудь застосовували» - жінки, які застосовують КОК нині або застосовували їх в минулому.
Наведені далі побічні реакції були виявлені під час післяреєстраційного застосування препарату «Ярина®». Оскільки повідомлення про ці реакції надсилали добровільно і вони стосувалися популяцій невизначеного розміру, не завжди можливо достовірно оцінити їх частоту або встановити причинний зв’язок із застосуванням препарату.
З боку судин: венозні та артеріальні тромбоемболічні явища (в тому числі легенева емболія, тромбоз глибоких вен, інтракардіальний тромбоз, тромбоз інтракраніального венозного синуса, тромбоз сагітальної пазухи твердої мозкової оболонки, тромбоз вен сітківки, інфаркт міокарда та інсульт), артеріальна гіпертензія.
Гепатобіліарні розлади: захворювання жовчного міхура.
З боку імунної системи: підвищена чутливість.
З боку харчування та порушення обміну речовин: гіперкаліємія.
З боку шкіри та підшкірної основи: хлоазма.
Екзогенні естрогени можуть індукувати або посилювати симптоми спадкового та набутого ангіоневротичного набряку.
Термін придатності.
36 місяців.
Умови зберігання.
Зберігати в недоступному для дітей місці при температурі не вище 25° С.
Упаковка.
Блістер з 28 таблетками, вкритими оболонкою, і календарною шкалою в картонній пачці.
Категорія відпуску.
За рецептом.
Виробник.
Байєр АГ / Bayer AG.
Місцезнаходження виробника та його адреса місця провадження діяльності.
Мюллєрштрассе 178, 13353, Берлін, Німеччина / Mullerstrasse 178, 13353, Berlin, Germany.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО


