СИНАГІС
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.
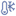 від 2 °С до 8 °С. Не заморожувати
від 2 °С до 8 °С. Не заморожувати 

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
СИНАГІС
Склад:
1 флакон містить 50 мг палівізумабу, що при розчиненні забезпечує дозу 50 мг у 0,5 мл;
1 флакон містить 100 мг палівізумаб, що при розчиненні забезпечує дозу 100 мг у 1 мл;
допоміжні речовини: гістидин, гліцин, маніт (Е421).
1 ампула з розчинником містить 1 мл води для ін’єкцій.
Лікарська формаПорошок ліофілізований для приготування розчину для ін`єкцій.
Основні фізико-хімічні властивості:
порошок ліофілізований - однорідна суха ущільнена маса від білого до майже білого кольору, без видимих сторонніх домішок;
приготований розчин - прозорий або слабо опалесцюючий розчин, може спостерігатись невелика кількість видимих часток;
розчинник (вода для ін’єкцій) - прозорий безбарвний розчин, що не містить видимих часток.
Фармакотерапевтична група
Специфічні імуноглобуліни. Палівізумаб. Код АТС J06B B16.
Фармакологічні властивості
Синагіс (палівізумаб) - гуманізовані IgG1k моноклональні антитіла до антигенної детермінанти (епітопу) в А антигенному локусі гібридного білка респіраторно- синцитіального вірусу (РСВ). Палівізумаб складається з амінокислотних послідовностей людини (95 %) та миші (5 %). Mає потужну нейтралізуючу та гібридно-інгібуючу активність проти РСВ підтипів А та В.
Палівізумаб при концентрації 30 мкг/мл у сироватці крові спричинює 99 % зниження легеневої реплікації РСВ.
У дослідженнях на здорових дорослих волонтерах палівізумаб виявив фармакокінетичний профіль, подібний до антитіла IgG1 людини відносно об’єму розподілу (в середньому 57 мл/кг) та періоду напіввиведення (у середньому 18 днів). У дослідженнях з профілактики РСВ у недоношених дітей та дітей з бронхолегеневою дисплазією середній період напіввиведення палівізумабу складав 20 днів, а щомісячні внутрішньом’язові дози 15 мг/кг забезпечували середню 30-денну концентрацію активної речовини в сироватці крові близько 40 мкг/мл після першої ін’єкції, 60 мкг/мл після другої ін’єкції та приблизно 70 мкг/мл після третьої та четвертої ін’єкцій.
У дітей, яким вводили палівізумаб впродовж другого сезону, середня концентрація препарату в сироватці крові після першого та четвертого введення дорівнювала 60 та 90 мкг/мл відповідно.
У дітей віком 24 місяці або менше з гемодинамічно значущими вродженими вадами серця, які отримували палівізумаб та яким проводили серцево-легеневе шунтування на відкритому серці, середня концентрація палівізумабу у сироватці крові складала приблизно 100 мкг/мл перед шунтуванням і знижувалася до 40 мкг/мл після нього.
Проспективне відкрите дослідження (фаза ІІ) для оцінки фармакокінетичних та імуногенних властивостей та безпеки після введення 7 доз палівізумабу впродовж одного сезону РСВ свідчить, що відповідний середній рівень палівізумабу був досягнутий у всіх 18 дітей, включених у дослідження.
Ефективність.
У плацебо-контрольованому дослідженні профілактики РСВ-захворювань у 1502 дітей із високим ризиком (1002 отримували палівізумаб, 500 - плацебо), щомісячне введення препарату в дозі 15 мг/кг зменшувало частоту госпіталізації, пов’язану із РСВ, на 55% (р<0,001).
Мікробіологія.
Противірусна активність (дослідження in vitro).
Противірусна активність палівізумаба оцінювалась методом мікронейтралізації, в якому підвищені концентрації антитіл були інкубовані з РСВ перед додаванням епітеліальних клітин людини HEp-2. Після інкубації впродовж 4-5 діб РСВ-антиген вимірювався методом імуносорбентного ферментного аналізу (ELISA). Титр нейтралізації (50 % ефективної концентрації [ЕС50]) виражається концентрацією антитіла, необхідною для зниження визначення РСВ-антигену на 50 % порівняно з нелікованими клітинами, інфікованими вірусом. Палівізумаб демонструє середні значення ЕС50 0,65 мкг/мл (середнє [стандартне відхилення] = 0,75 [0,53] мкг/мл; n = 69, діапазон 0,07-2,89 мкг/мл) та 0,28 мкг/мл (середнє [стандартне відхилення] = 0,35 [0,23] мкг/мл; n = 35, діапазон 0,03-0,88 мкг/мл) проти клінічних РСВ А та РСВ B ізолятів відповідно. Більшість досліджених клінічних РСВ ізолятів (n = 96) були відібрані від пацієнтів із США, незначна кількість із Японії (n = 1), Австралії (n = 5) та Ізраїлю (n = 2). Зазначені ізоляти кодують поширенішу РСВ F послідовність поліморфізмів, виявлених у всьому світі.
Резистентність.
Палівізумаб зв’язує висококонсервативну ділянку на позаклітинному домені зрілого РСВ F білка, яка називається антигенною детермінантою ІІ або антигенною детермінантою А та включає амінокислотні залишки від 262 до 275. Всі РСВ-мутанти, які виявляють резистентність до палівізумабу, показали, що має місце заміна амінокислот на цій ділянці F білка. Відсутня інформація щодо поліморфних або не поліморфних варіацій послідовностей поза межами антигенної детермінанти А РСВ F білка, що є РСВ-резистентними до нейтралізації палівізумабом. Принаймні, одне з заміщень, асоційованих з резистентністю до палівізумабу, N262D, K272E/Q або S275F/L було ідентифіковано в 8 із 126 клінічних РСВ-ізолятів від пацієнтів, у котрих імунопрофілактика виявилась неефективною. Таким чином, загальна частота мутацій, асоційованих із резистентністю, складає 6,3 %. Огляд отриманих клінічних даних не виявив зв’язку між послідовністю змін в антигенній детермінанті А та ступенем тяжкості РСВ-захворювання у дітей, які отримували імунопрофілактику палівізумабом та у яких розвинулось РСВ-захворювання нижніх відділів дихальних шляхів. Аналіз 254 клінічних ізолятів, відібраних від пацієнтів, яким раніше не проводилась імунопрофілактика палівізумабом, виявив заміщення, асоційовані з резистентністю до палівізумабу в двох ізолятах (один з N262D та один з S275F), таким чином, частота мутацій, асоційованих з резистентністю, складає 0,79 %.
Клінічні характеристики
Показання.
Для профілактики серйозного захворювання нижніх дихальних шляхів, що потребує госпіталізації, спричиненого респіраторно-синцитіальним вірусом (РСВ), у дітей з високим ризиком розвитку РСВ захворювання:
· діти, народжені на 35-му тижні вагітності або раніше, вік яких на початок сезону РСВ інфекції 6 місяців або менше;
· діти віком до 2 років, які потребували терапії бронхолегеневої дисплазії впродовж останніх 6 місяців;
· діти віком до 2 років із гемодинамічно значущими вродженими вадами серця.
Протипоказання.
Підвищена чутливість до активної речовини або будь-якої допоміжної речовини або до інших гуманізованих моноклональних антитіл.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Досліджень взаємодії з лікарськими засобами не проводилися і до теперішнього часу такі взаємодії не описані. В клінічному дослідженні IMpact-RSV кількість дітей у групі плацебо та групі палівізумабу, які отримували планові профілактичні щеплення, вакцинацію проти грипу, бронходилятатори або кортикостероїди, була однаковою та в них не спостерігалося збільшення кількості побічних реакцій.
Оскільки моноклональні антитіла специфічні до РСВ, впливу палівізумабу на поствакцинальний імунітет не очікується, у тому числі після застосування живих вірусних вакцин.
Взаємодія та вплив на результати лабораторних тестів.
Палівізумаб може вплинути на результати імунологічних діагностичних РСВ-тестів, наприклад, деяких аналізів на основі виявлення антигену. Крім того, палівізумаб пригнічує реплікацію вірусу в культурі клітин, отже, може також вплинути на результати аналізів з використанням вірусної культури. Палівізумаб не впливає на результати аналізів на основі полімеразної ланцюгової реакції зі зворотною транскріптазою. Вплив на результати лабораторних тестів може призвести до помилково-негативних результатів діагностики РСВ. Таким чином, результати діагностичних тестів необхідно розглядати з урахуванням клінічних даних.
Особливості застосування.
Реакції гіперчутливості.
Після введення палівізумабу повідомлялося про розвиток алергічних реакцій, в т.ч. дуже рідкі випадки розвитку анафілаксії та анафілактичного шоку, у деяких випадках із летальним наслідком (див. побічні реакції/ досвід постмаркетингового застосування). Необхідні медикаменти для екстреного лікування цих реакцій повинні бути напоготові для негайного застосування. При розвитку серйозної реакції гіперчутливості, включаючи анафілаксію та анафілактичний шок, терапію палівізумабом слід припинити. При розвитку менш виражених проявів реакцій гіперчутливості слід бути обережними при подальшому застосуванні палівізумабу.
Загальні застереження.
Як і при проведенні будь-якої внутрішньом’язової ін’єкції, палівізумаб слід вводити з обережністю пацієнтам із тромбоцитопенією або будь-яким порушенням згортання крові. Флакон для одноразового використання з палівізумабом не містить консервантів. Ін’єкцію слід виконати впродовж 3 годин після розведення препарату (щодо умов зберігання приготованого розчину див. «Термін придатності»).
Гостра інфекція середнього або важкого ступеня тяжкості або пропасниця можуть вимагати відстрочення введення палівізумабу, якщо тільки, на думку лікаря, відстрочка введення палівізумабу не тягне за собою більшого ризику. Слабка пропасниця, така як при інфекції верхніх дихальних шляхів легкого ступеня тяжкості, зазвичай не є причиною для відкладання введення палівізумабу.
Застосування у період вагітності або годування груддю.
Відповідних досліджень не проводилося. Препарат не призначений для застосування у дорослих.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Препарат не призначений для застосування у дорослих.
Спосіб застосування та дози.
Рекомендована доза палівізумабу складає 15 мг/кг маси тіла 1 раз на місяць впродовж періоду, що очікують для розповсюдження РСВ у популяції. Першу дозу слід вводити до передбачуваного РСВ сезону, а наступні - щомісяця впродовж усього сезону. У регіонах з помірним кліматом РСВ сезон зазвичай розпочинається в осінні місяці та триває впродовж весни (але були повідомлення про випадки РСВ і влітку). Для зниження ризику реінфекції рекомендується, щоб діти, які застосовують палівізумаб та які були інфіковані РСВ, продовжували отримувати щомісячні дози препарату впродовж РСВ сезону.
Клінічний досвід, включаючи основні клінічні дослідження ІІІ фази, здебільшого був отриманий при застосуванні 5 ін’єкцій палівізумабу впродовж одного сезону. Є обмежені дані щодо застосування більше ніж 5 доз палівізумабу.
Для дітей, які перенесли хірургічне втручання з метою коронарного шунтування, рекомендована доза складає 15 мг/кг маси тіла після стабілізації стану, щоб забезпечити необхідний рівень палівізумабу в сироватці крові. Необхідно продовжити введення наступних доз щомісяця впродовж РСВ сезону у дітей з високим ризиком розвитку РСВ захворювання.
Спосіб введення.
Палівізумаб вводити внутрішньом’язово, переважно у передньо-бокову частину стегна. Препарат не вводять у сідничний м’яз через ризик травмування сідничного нерву. Ін’єкцію виконують з використанням стандартної асептичної техніки. Місячна доза (мл) = вага пацієнта (кг) х 0,15. Якщо об’єм ін’єкції перевищує 1 мл, препарат вводити окремими дозами.
Ефективність Синагіса в іншій дозі, ніж 15 мг/ кг маси тіла, або іншому інтервалі, ніж 1 раз на місяць, впродовж РСВ сезону не встановлена.
Приготування розчину.
Флакон 50 мгмістить надлишок для забезпечення повноти набирання 50 мг при розведенні у відповідності до нижченаведеної техніки приготування розчину.
Флакон 100 мгмістить надлишок для забезпечення повноти набирання 100 мг при розведенні у відповідності до нижченаведеної техніки приготування розчину
Для того, щоб здійснити розведення, необхідно видалити відривну частину ковпачка флакона та очистити гумову пробку за допомогою 70 % етилового спирту або рівноцінного замінника.
ПОВІЛЬНО додати розчинник (стерильна вода для ін’єкцій), що міститься в упаковці, в кількості 0,6 мл до флакона Синагіс 50 мг або 1,0 мл до флакона Синагіс 100 мг. Додавати воду слід вздовж внутрішньої стінки флакона для запобігання утворенню піни. Обережно впродовж 30 секунд повертати флакон до розчинення порошку, запобігаючи утворенню піни. НЕ СТРУШУВАТИ ФЛАКОН. Розчин палівізумабу слід залишити при кімнатній температурі мінімум на 20 хвилин для того, щоб розчин став прозорим. Розчин палівізумабу не містить консервантів і його потрібно використати впродовж 3 годин після приготування. Флакони призначені для одноразового використання. Невикористані залишки подальшому застосуванню не підлягають.
При розчиненні згідно з рекомендаціями, кінцева концентрація складає 100 мг/мл.
Діти.
Показаний для застосування дітям за показаннями, зазначеними в розділі «Показання».
Передозування.
У клінічних дослідженнях застосування палівізумабу у дозі вище ніж 15 мг/кг не спричиняло до появи будь-яких медичних наслідків. Ці дози складали 20,25 мг/кг, 21,1 мг/кг та 22,27 мг/кг (у трьох дітей відповідно).
У постмаркетинговому досвіді повідомлялося про передозування до 85 мг/кг, у деяких випадках побічні реакції, які спостерігались у пацієнтів, не відрізнялись від тих, що спостерігались після застосування палівізумабу в дозі 15 мг/кг.
У разі передозування рекомендоване спостереження за пацієнтом на предмет виявлення будь-яких ознак та симптомів побічних реакцій, та при їх появі - негайне проведення симптоматичної терапії.
Побічні реакції.
Побічні реакції, про які повідомлялося впродовж досліджень з профілактики РСВ у дітей, були аналогічними в групі плацебо та в групі палівізумабу. Більшість реакцій були транзисторними від легкого до середнього ступеня тяжкості.
У досліджені з профілактики РСВ у недоношених дітей та дітей із бронхолегеневою дисплазією (IMpact- RSV) не спостерігалось клінічно значущої різниці в побічних реакціях за системами органів або в підгрупах дітей, розподілених за статтю, віком, гестаційним віком, країною, расовою/етнічною належністю або квартильною концентрацією палівізумаба в сироватці крові. Не спостерігалось значної різниці в профілі безпеки між дітьми без активної РСВ інфекції та тими, які були госпіталізовані з РСВ захворюванням. Випадки повного завершення введення палівізумабу, зумовлені виникненням побічних реакцій, були рідкими (0,2 %). Летальність була аналогічною у групі плацебо та у групі палівізумабу та не мала причинного зв’язку з препаратом.
У дослідженні з профілактики РСВ у дітей з уродженими вадами серця( CHD study)не спостерігалось клінічно значущої різниці в побічних реакціях за системами органів або в підгрупах дітей, розподілених за типами вад серця (цианотичний порівняно з ацианотичним). Частота серйозних побічних реакцій була значно нижчою в групі палівізумабу порівняно з групою плацебо. Повідомлення про серйозні побічні реакції, пов’язані з застосуванням палівізумабу, були відсутні. Частота планових, передчасних та невідкладних кардіохірургічних втручань була аналогічною між групами. В групі палівізумабу було зафіксовано 2 летальних наслідки, асоційованих із РСВ інфекцією, та 4 випадки в групі плацебо, які не мали зв'язку з застосуванням препарату.
Побічні реакції, що мали хоча б можливий причинний зв’язок з палівізумабом, та про які повідомлялося впродовж клінічних досліджень у недоношених та дітей з бронхолегеневою дисплазією, а також у дітей з уродженими вадами серця, класифіковані за системами та органами, за частотою виникнення (≥ 1/10 - дуже часто, від ≥1/100 до ˂1/10 - часто; від ≥ 1/1000 до ˂1/100 - нечасто, від ≥1/10000 до ˂1/1000 - рідко) .
Оскільки про побічні реакції, які виникають під час постмаркетингового спостереження, отримують повідомлення від населення добровільно, розмір популяції є невідомим, не завжди можливо достовірно визначити частоту їх виникнення чи встановити причинно-наслідковий взаємозв’язок із застосуванням палівізумабу (див. також розділ «Особливості застосування»). Тому частота таких побічних реакцій була оцінена ґрунтуючись на даних з безпеки, отриманих з двох зареєстрованих клінічних досліджень, в яких було продемонстровано відсутність різниці щодо частоти виникнення побічних реакцій у групі палівізумабу порівняно з групою плацебо, та які не мали зв'язку з застосуванням препарату.
Побічні реакції, про які повідомлялося впродовж клінічних досліджень та постмаркетингового досвіду:
Органи та системи організму | Частота | Побічні реакції |
Порушення з боку шкіри та підшкірної клітковини | дуже часто | висипання |
Загальні розлади та реакції в місці введення | дуже часто | підвищення температури |
часто | реакції у місці введення | |
Порушення з боку кровоносної та лімфатичної систем | нечасто | тромбоцитопенія* |
Порушення з боку імунної системи | невідомо | анафілаксія, анафілактичний шок (у деяких випадках із летальним наслідком)* |
Порушення з боку нервової системи | нечасто | судоми* |
Порушення з боку дихальної системи, органів грудної клітки та середостіння | часто | апное* |
Порушення з боку шкіри і підшкірної клітковини | нечасто | кропив’янка* |
* побічні реакції, про які повідомлялося впродовж постмаркетингового досвіду
Реакції гіперчутливості.
Після введення палівізумабу повідомлялося про розвиток алергічних реакцій, в т.ч. дуже рідкі випадки розвитку анафілаксії та анафілактичного шоку, у деяких випадках із летальним наслідком (дивись також розділ «Особливості застосування»).
Постмаркетинговий досвід.
Були оцінені повідомлення щодо виникнення серйозних непередбачуваних побічних реакцій, отримані впродовж терапії палівізумабом між 1998 - 2002 роками, що охоплює 4 РСВ-сезони. Загалом було отримано 1291 повідомлення під час терапії палівізумабом як зазначено та впродовж одного сезону. Поява побічних реакцій після 6-ї або більшої дози спостерігалась лише в 22 випадках (15 - після 6-ї дози, 6 - після 7-ї дози та 1 - після 8-ї дози). Ці реакції були схожі за характером та частотою, як і після перших 5 доз.
Досвід застосування палівізумабу між 1998 - 2000 роками у 20000 дітей (1250 дітей отримали 6 ін’єкцій, 183 дитини отримали 7 ін’єкцій та 27 дітей - 8 або 9 ін’єкцій) показав, що побічні реакції, що спостерігалися у пацієнтів після 6-ї або більшої дози, були однакові за характером та частотою, як і після перших 5 доз.
Імуногенність.
У дослідженні IMpact-RSV поява антитіл до палівізумабу спостерігалась приблизно у 1 % пацієнтів впродовж першого курсу терапії. Ця реактивність була транзиторною з низьким титром, яка повністю зникала, незважаючи на продовження застосування (перший та другий сезон), та не спостерігалась у 55 із 56 пацієнтів впродовж другого сезону (включаючи 2 випадки впродовж першого сезону). У CHD-дослідженні імуногенність не оцінювали.
Антитіла до палівізумабу визначались у чотирьох додаткових дослідженнях у 4337 дітей, пролікованих даним препаратом (народжених із гестаційним віком 35 тижнів або менше та у віці 6 місяців або менше, або у віці < 24 місяці з бронхолегеневою дисплазією або з уродженими вадами серця з порушенням гемодинаміки) та спостерігалось у 0-1,5 % дітей на різних етапах дослідження. Зв’язок між наявністю антитіл та побічними реакціями був відсутній. Таким чином, імунологічні відповіді на препарат не мали клінічного значення.
Термін придатності.
3 роки.
Приготований розчин слід використати негайно після приготування, однак є дані щодо його стабільності впродовж 3 годин при температурі 20-24 °С.
Умови зберігання.
Зберігати в недоступному для дітей місці при температурі від 2 до 8 °С в оригінальній упаковці. Не заморожувати.
Несумісність.
Палівізумаб не можна змішувати з будь-якими іншими лікарськими засобами або іншими розчинниками, крім стерильної води для ін’єкцій.
Упаковка.
Порошок ліофілізований для приготування розчину для ін’єкцій по 50 мг або 100 мг у флаконі №1 у комплекті з розчинником (вода для ін’єкцій) по 1 мл в ампулі №1 в картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
Випуск серії:Еббві С.р.л., Італія.
Місцезнаходження виробника та його адреса місця провадження діяльності.
С.Р. 148 Понтіна Км 52, СНС - Камповерде ді Апріліа (лок. Апріліа) - 04011 Апріліа (ЛТ), Італія.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО

