НІКСАР® 2,5 МГ/МЛ
МНН: Bilastine

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
НІКСАР® 2,5 МГ/МЛ
(NIXAR® 2.5 MG/ML)
Склад:
діюча речовина: біластин;
1 мл розчину орального містить 2,5 мг біластину;
допоміжні речовини: бетадекс; гідроксіетилцелюлоза; метилпарагідроксибензоат (Е 218); пропілпарагідроксибензоат (E216); сахаралоза (E955); малиновий ароматизатор (основні компоненти: етанол, триацетин, вода, етилбутират, ліналилацетат); кислота хлористоводнева розведена (10%) (для коригування pH); натрію гідроксид (для коригування pH); вода очищена.
Лікарська форма Розчин оральний.
Основні фізико-хімічні властивості:прозорий, злегка в’язкий водний розчин з рН 3,0-4,0, без осаду.
Фармакотерапевтична група
Антигістамінні засоби для системного застосування. Інші антигістамінні засоби для системного застосування. Біластин. Код АТС . R06A X29.Фармакологічні властивості
Механізм дії. Біластин - це неседативний антигістамінний засіб тривалої дії, який вибірково зв’язується з периферичними H1-рецепторами та не зв’язується з мускариновими рецепторами.
Після одноразового застосування однієї дози біластин протягом 24 годин пригнічує розвиток шкірних реакцій, а саме пухирців та еритеми, що спричинюються гістаміном.
Клінічна ефективність. Ефективність біластину була досліджена у дорослих і підлітків. Згідно з рекомендаціями, доведена ефективність у дорослих і підлітків може вважатися прийнятною для дітей із урахуванням того, що системний вплив 10 мг біластину у дітей віком від 6 до 11 років з масою тіла не менше 20 кг відповідає системному впливу, що спостерігається при прийомі 20 мг біластину у дорослих (див. розділ «Фармакокінетика»). Екстраполяція даних, отриманих у дорослих і підлітків, вважається прийнятною для цього лікарського засобу, оскільки патофізіологія алергічного ринокон’юнктивіту і кропив’янки є однаковою для всіх вікових груп.
У ході клінічних досліджень за участю дорослих та підлітків з алергічним ринокон’юнктивітом (сезонним та цілорічним), на тлі застосування біластину в дозі 20 мг 1 раз на добу впродовж 14-28 днів відзначалося полегшення таких симптомів захворювання, як чхання, виділення з носа, свербіж носа, закладеність носа, свербіж очей, сльозотеча та почервоніння очей. Контроль симптомів під впливом біластину ефективно зберігався протягом 24 годин.
У ході двох клінічних досліджень, в яких брали участь пацієнти з хронічною ідіопатичною кропив’янкою, на тлі застосування біластину в дозі 20 мг 1 раз на добу впродовж 28 днів відзначалося зменшення інтенсивності свербежу та зменшення кількості та розміру пухирів; крім того, пацієнти відчували менший дискомфорт, спричинений кропив’янкою. У пацієнтів спостерігалося покращення сну та якості життя.
Ні клінічно значимого подовження інтервалу QTс на електрокардіограмі, ні інших порушень з боку серцево-судинної системи не спостерігалося під час проведених клінічних досліджень біластину, навіть при застосуванні у дозі 200 мг на добу (що в 10 разів вище клінічної дози) 9 учасникам протягом 7 днів і в разі його застосування одночасно з інгібіторами P-gp, такими як кетоконазол (24 учасники) і еритроміцин (24 учасники). Крім того, було проведено ретельне дослідження QT у 30 добровольців.
Під час контрольованих клінічних досліджень застосування в рекомендованій дозі 20 мг 1 раз на добу профіль безпеки біластину та плацебо відносно ЦНС був схожим, а частота появи сонливості статистично не відрізнялася. У клінічних дослідженнях біластин в дозах до 40 мг 1 раз на добу не впливав на психомоторну активність і на здатність керування транспортними засобами в стандартному тесті на водіння.
У пацієнтів літнього віку (≥65 років), які включені у дослідження у II і III фазі, продемонстрована відсутність відмінностей ефективності та безпеки у порівнянні із пацієнтами молодшого віку.
Клінічна безпека. У 12-тижневому контрольованому клінічному дослідженні за участю дітей віком від 2 до 11 років (всього 509 дітей, 260 з них отримували біластин 10 мг: 58 віком від 2 до <6 років, 105 віком від 6 до <9 років і 97 від 9 до <12 років, 249 дітей отримували плацебо: 58 віком від 2 до <6 років, 95 віком від 6 до <9 років і 96 віком від 9 до <12 років) при застосуванні в рекомендованій педіатричній дозі 10 мг один раз на добу профіль безпеки біластину (n=260) був аналогічний профілю безпеки при застосуванні плацебо (n=249), побічні реакції спостерігалися у 5,8% і 8,0% пацієнтів, які приймали біластин 10 мг і плацебо відповідно. Прийом біластину 10 мг та плацебо призвів до невеликого зменшення сонливості і седативного ефекту при оцінці за анкетою для педіатричного сну під час цього дослідження, статистично значуща різниця між групами лікування була відсутня. У дітей віком від 2 до 11 років, які приймали біластин у дозі 10 мг на добу, не спостерігалось значущої різниці в інтервалі QTc порівняно з тими, хто приймав плацебо. Анкети щодо якості життя, специфічні для дітей з алергічним ринокон’юнктивітом або хронічною кропив’янкою, показали загальний приріст балів за 12 тижнів без статистично значущої різниці між групами біластину та плацебо. Всього в дослідженні брали участь 509 дітей, включаючи 479 учасників з алергічним ринокон’юнктивітом і 30 учасників з діагностованою хронічною кропив’янкою. 260 дітей отримували біластин: 252 (96,9%) - для лікування алергічного ринокон’юнктивіту і 8 (3,1%) - для лікування хронічної кропив’янки. Аналогічно 249 дітей отримували плацебо: 227 (91,2%) - для лікування алергічного ринокон’юнктивіту і 22 (8,8%) - для лікування хронічної кропив’янки.
Педіатрична популяція. Європейське агентство з лікарських засобів відмовилося від зобов’язання подавати результати досліджень біластину у всіх підгрупах педіатричної популяції віком до 2 років (див. розділ «Спосіб застосування та дози», інформація щодо застосування дітям).
Всмоктування. Після перорального застосування біластин швидко всмоктується, а його максимальна концентрація в плазмі досягається приблизно через 1,3 години після прийому. Накопичення препарату в організмі не спостерігалось. Середній показник біодоступності при пероральному застосуванні біластину становить 61%.
Розподіл. Дослідженняin vitro таin vivoпродемонстрували те, що біластин є субстратом P-gp (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»: «Взаємодія з кетоконазолом або еритроміцином» та «Взаємодія з дилтіаземом») та OATP (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»: «Взаємодія з грейпфрутовим соком»).
У терапевтичних дозах біластин зв’язується з білками плазми на 84-90%.
Біотрансформація. У ході дослідженьin vitro біластин не виявив здатності індукувати або пригнічувати активність ізоферментів CYP450.
Елімінація. За даними дослідження балансу маси за участю здорових дорослих добровольців, після одноразового застосування 14C-біластину в дозі 20 мг майже 95% введеної дози виявлялися в сечі (28,3%) та калі (66,5%) у вигляді незміненого біластину, з чого можна зробити висновок, що в організмі людини біластин метаболізується незначним чином. У середньому період напіввиведення біластину у здорових добровольців становив 14,5 години.
Лінійність. У досліджуваному діапазоні доз (5 до 220 мг) біластин має лінійну фармакокінетику із низькою індивідуальною незначною відмінністю.
Порушення функції нирок. Вплив біластину у разі наявності порушень функції нирок було досліджено за участю дорослих пацієнтів.
Під час дослідження у пацієнтів із порушенням функції нирок значення AUC0-¥ (СВ) підвищилось з 737,4 (± 260,8) нг•год/мл у пацієнтів з нормальною функцією нирок (ШКФ: > 80 мл/хв/1,73 м2) до 967,4 (± 140,2) нг•год/мл у пацієнтів з порушенням функції нирок легкого ступеня тяжкості (ШКФ: 50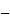 80 мл/хв/1,73 м2), 1384,2 (± 263,23) нг•год/мл у пацієнтів з порушеннями середнього ступеня тяжкості (ШКФ: 30
80 мл/хв/1,73 м2), 1384,2 (± 263,23) нг•год/мл у пацієнтів з порушеннями середнього ступеня тяжкості (ШКФ: 30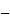 <50 мл/хв/1,73 м2) і 1708,5 (± 699,0) нг•год/мл у пацієнтів з порушеннями тяжкого ступеня (ШКФ: <30 мл/хв/1,73 м2). У пацієнтів без порушень значення (СВ) періоду напіввиведення біластину становило 9,3 год (± 2,8), у пацієнтів з порушеннями легкого ступеня тяжкості
<50 мл/хв/1,73 м2) і 1708,5 (± 699,0) нг•год/мл у пацієнтів з порушеннями тяжкого ступеня (ШКФ: <30 мл/хв/1,73 м2). У пацієнтів без порушень значення (СВ) періоду напіввиведення біластину становило 9,3 год (± 2,8), у пацієнтів з порушеннями легкого ступеня тяжкості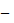 15,1 год (± 7,7), у пацієнтів з порушеннями середнього ступеня тяжкості
15,1 год (± 7,7), у пацієнтів з порушеннями середнього ступеня тяжкості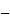 10,5 год (± 2,3), а у пацієнтів з порушеннями тяжкого ступеня
10,5 год (± 2,3), а у пацієнтів з порушеннями тяжкого ступеня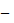 18,4 год (± 11,4). У всіх пацієнтів через 48
18,4 год (± 11,4). У всіх пацієнтів через 48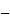 72 год виведення з сечею біластину було більшою мірою закінчено. Ці зміни фармакокінетики не повинні мати клінічного впливу на безпеку біластину, оскільки показники рівня його концентрації у плазмі у пацієнтів з порушенням функції нирок залишаються в безпечних межах.
72 год виведення з сечею біластину було більшою мірою закінчено. Ці зміни фармакокінетики не повинні мати клінічного впливу на безпеку біластину, оскільки показники рівня його концентрації у плазмі у пацієнтів з порушенням функції нирок залишаються в безпечних межах.
Порушення функції печінки. Фармакокінетичні дані щодо пацієнтів з порушенням функції печінки відсутні. В організмі людини біластин не метаболізується. Оскільки результати дослідження за участю пацієнтів із порушеннями функції нирок показали, що головним чином виведення біластину здійснюється через нирки, екскреція жовчі, очікувано, незначною мірою бере участь у виведенні біластину. Зміни функції печінки не мають клінічно значущого впливу на фармакокінетику біластину.
Педіатрична популяція. Фармакокінетичні дані щодо дітей були отримані у II фазі фармакокінетичного дослідження за участю 31 дитини віком від 4 до 11 років з алергічним ринокон’юнктивітом або хронічною кропив’янкою, які приймали 10 мг біластину у вигляді таблеток, що диспергуються в ротовій порожнині, по 1 таблетці один раз на добу. Було доведено, що ця лікарська форма є біоеквівалентною розчину оральному біластину, 2,5 мг/мл. Фармакокінетичний аналіз концентрації біластину в плазмі показав, що після прийому біластину у педіатричній дозі 10 мг один раз на добу, його системний вплив відповідає впливу, що спостерігається у дорослих і підлітків після прийому препарату в дозі 20 мг, а середнє значення AUC у дітей віком від 6 до 11 років становить 1014 нг•год/мл. Ці результати були в основному нижче максимального безпечного рівня, встановленого на основі даних про прийом препарату дорослими в дозі 80 мг один раз на добу відповідно до профілю безпеки лікарського засобу. Ці результати підтвердили вибір дози біластину 10 мг один раз на добу як обґрунтованої терапевтичної дози для застосування пацієнтам педіатричної популяції віком від 6 до 11 років з масою тіла не менше 20 кг.
Доклінічні дані з безпеки.
Доклінічні дані про біластин, що базуються на загальних дослідженнях фармакології безпеки, токсичності повторюваної дози, генотоксичності і канцерогенного впливу, показали відсутність специфічного ризику для людини.
Під час досліджень репродуктивної токсичності впливи біластину на плід (пре- і постімплантаційна загибель плода у щурів, неповна осифікація кісток черепа, сегмента груднини і кінцівок у кролів) відзначалися тільки у в дозах, токсичних для матері.
У разі застосування біластину тваринам у дозах, при яких не спостерігаються побічні ефекти (NOAEL), системний вплив значно перевищує (> 30 разів) системний вплив у людини після застосування препарату в рекомендованій терапевтичній дозі.
У дослідженні лактації біластин був виявлений в молоці щурів, що годують, після одноразового перорального введення дози (20 мг/кг). Концентрація біластину в молоці становила близько половини його концентрації в материнській плазмі. Значимість цих результатів для людини невідома.
У дослідженні фертильності у щурів біластин вводили тваринам перорально в дозах до
1000 мг/кг/добу, при цьому ніякого впливу на жіночі і чоловічі репродуктивні органи виявлено не було. Індекси спарювання, фертильності та вагітності не змінювалися.
За даними дослідження розподілу у щурів, в якому значення концентрації лікарського засобу в різних тканинах визначали методом авторадіографії, в ЦНС біластин не накопичується.
Клінічні характеристики
Показання.
Симптоматичне лікування алергічного ринокон’юнктивіту (сезонного та цілорічного) та кропив’янки. Ніксар® показаний дітям віком від 6 до 11 років з масою тіла не менше 20 кг.
Протипоказання.
Підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин, зазначених в розділі «Склад».
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження взаємодії були проведені тільки за участю дорослих.
Взаємодія з харчовими продуктами. Їжа суттєво знижує біодоступність біластину при пероральному прийомі 20 мг у формі таблеток (на 30 %), та 2,5 мг/мл у формі орального розчину (на 20%).
Взаємодія з грейпфрутовим соком. У разі застосування біластину в дозі 20 мг одночасно з грейпфрутовим соком біодоступність біластину знижувалася на 30 %. Подібний ефект може спостерігатися і у разі застосування інших фруктових соків. Ступінь зменшення біодоступності може різнитися залежно від виробника соку та фруктів. Ця взаємодія обумовлена здатністю компонентів фруктів пригнічувати OATP1A2, для якого біластин є субстратом (див. розділ «Фармакокінетика»). Зменшувати концентрацію біластину в плазмі можуть і лікарські засоби, які є субстратами або інгібіторами OATP1A2, такі як ритонавір або рифампіцин.
Взаємодія з кетоконазолом або еритроміцином. У разі прийому біластину 20 мг один раз на добу одночасно з кетоконазолом 400 мг один раз на добу або еритроміцином 500 мг три рази на добу, AUC біластину збільшувалася у 2 рази, а Cmax - у 2-3 рази. Подібні ефекти можна пояснити взаємодією на рівні білків-транспортерів, що відповідають за виведення лікарських засобів із клітин кишечнику, оскільки біластин є субстратом P-gp та не метаболізується (див. розділ «Фармакокінетика»). На профіль безпеки біластину, з одного боку, та кетоконазолу або еритроміцину, з іншого, ці ефекти, ймовірно, не впливають. Збільшувати концентрацію біластину в плазмі можуть і інші лікарські засоби, що є субстратами або інгібіторами P-gp, такі як циклоспорин.
Взаємодія з дилтіаземом. У разі прийому біластину 20 мг один раз на добу одночасно з дилтіаземом 60 мг один раз на добу Cmax біластину збільшувалася на 50 %. Подібний ефект можна пояснити взаємодією на рівні білків-транспортерів, що відповідають за виведення лікарських засобів з клітин кишечнику (див. розділ «Фармакокінетика»). На профіль безпеки біластину цей ефект, ймовірно, не впливає.
Взаємодія з алкоголем. Після одночасного застосування алкоголю та біластину 20 мг один раз на добу психомоторні функції знаходилися на тому ж рівні, що й після одночасного застосування алкоголю та плацебо.
Взаємодія з лоразепамом. У разі застосування біластину 20 мг один раз на добу одночасно з лоразепамом 3 мг один раз на добу упродовж 8 днів посилення пригнічувальної дії лоразепаму на ЦНС виявлено не було.
Педіатрична популяція.У дітей дослідження взаємодії біластину у формі орального розчину не проводилися. Оскільки клінічний досвід взаємодії біластину у дітей з іншими медичними препаратами, їжею або фруктовими соками відсутній, при призначенні біластину дітям слід враховувати результати досліджень взаємодії, отримані у дорослих. Клінічні дані, на підставі яких можна було б зробити висновок, чи впливають обумовлені взаємодіями зміни AUC чи Cmax біластину на його профіль безпеки у дітей, відсутні.
Особливості застосування.
Педіатрична популяція. Ефективність та безпека біластину при лікуванні дітей віком до 2 років не встановлені, і є лише невеликий досвід клінічного застосування дітям віком від 2 до 5 років, тому біластин не слід застосовувати для лікування пацієнтів цих вікових груп.
У пацієнтів з помірними або тяжкими порушеннями функції нирок застосування біластину одночасно з інгібіторами P-gp (кетоконазолом, еритроміцином, циклоспорином, ритонавіром, дилтіаземом) може призводити до підвищення концентрації біластину в плазмі крові та, отже, до збільшення ризику його побічних реакцій. З цієї причини пацієнтам із середніми або тяжкими порушеннями функції нирок біластин одночасно з інгібіторами P-gp застосовувати не слід.
Ніксар® містить метилпарагідроксибензоат (E218) і пропілпарагідроксибензоат (E216), які можуть спричиняти алергічні реакції (можливо, сповільненого типу).
Цей лікарський засіб містить до 0,44 мг спирту (етанолу) в кожній дозі (4 мл), тобто 11 мг / 100 мл (0,011 % мас/об), що еквівалентно 0,02 мл пива або 0,005 мл вина. Така невелика кількість етанолу не матиме ніяких помітних ефектів.
Цей лікарський засіб містить менше 1 ммоль натрію (23 мг) на 4 мл, тобто практично вільний від натрію.
Застосування у період вагітності або годування груддю.
Вагітність. Дані щодо застосування біластину вагітним обмежені або відсутні зовсім.
У ході досліджень на тваринах також не відмічено прямого або непрямого шкідливого впливу препарату на репродуктивну функцію, пологи або постнатальний розвиток (див. розділ «Доклінічні дані з безпеки»). З міркувань безпеки застосування препарату Ніксар® під час вагітності слід уникати.
Годування груддю. Дослідження про те, чи проникає біластин у грудне молоко, не проводилися. Доступні дані з фармакокінетики показали, що у тварин біластин потрапляє в молоко (див. розділ «Доклінічні дані з безпеки»). Рішення про продовження/припинення годування груддю, а також про припинення/утримання від терапії препаратом Ніксар® слід приймати з урахуванням користі від годування груддю для дитини та користі терапії біластином для матері.
Фертильність. Клінічні дані відсутні або обмежені. Дослідження на щурах не виявило жодного негативного впливу на фертильність (див. розділ «Доклінічні дані з безпеки»).
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
За даними дослідження впливу біластину на здатність керувати автомобілем, застосування біластину в дозі 20 мг на здатність керувати транспортними засобами не впливає. Однак, оскільки індивідуальна реакція на лікарський засіб може варіювати, пацієнтам слід рекомендувати утримуватися від керування автотранспортом або обслуговування механізмів доти, доки не буде з’ясована їхня індивідуальна реакція на біластин.
Спосіб застосування та дози.
Дозування.
Педіатрична популяція.
· Діти віком від 6 до 11 років з масою тіла не менше 20 кг - 10 мг біластину (4 мл орального розчину) 1 раз на добу для полегшення симптомів алергічного ринокон’юнктивіту (сезонних алергічних ринітів і цілорічних алергічних ринітів) та кропив’янки.
Розчин оральний слід застосовувати за 1 годину до або через 2 години після прийому їжі або фруктового соку (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
· Діти віком до 6 років із масою тіла до 20 кг.
На сьогодні доступні дані зазначено в розділах «Особливості застосування», «Побічні реакції», «Фармакодинаміка» та «Фармакокінетика», але рекомендації щодо дозування не можуть бути складені. Тому біластин не слід застосовувати пацієнтам цієї вікової групи.
Дорослі і підлітки (віком від 12 років) можуть приймати біластин 20 мг, таблетки.
Тривалість лікування.
Пацієнтам з алергічним ринокон’юнктивітом препарат слід застосовувати тільки в період контакту з алергенами. Пацієнтам з сезонним алергічним ринітом лікування можна припинити після пом’якшення симптомів та поновлювати після їх повернення. Пацієнтам з цілорічним алергічним ринітом препарат можна безперервно застосовувати впродовж періоду контакту з алергенами. У пацієнтів з кропив’янкою тривалість лікування залежить від характеру та тривалості симптомів, а також від їхньої динаміки.
Особливі групи пацієнтів.
При порушенні функції нирок. Безпека і ефективність застосування біластину дітям з порушенням функції нирок не встановлені. У дослідженнях, проведених за участю дорослих з груп особливого ризику (пацієнти з порушенням функції нирок), показано, що необхідності корегувати дозу біластину для дорослих немає (див. розділ «Фармакокінетика»).
При порушенні функції печінки. Безпека і ефективність застосування біластину дітям з порушенням функції печінки не встановлені. Досвід клінічного застосування препарату пацієнтам з порушенням функції печінки відсутній як щодо дорослих, так і щодо педіатричних пацієнтів.
Однак, оскільки біластин не метаболізується і виводиться з сечею і калом в незміненому вигляді, порушення функції печінки не повинно призводити до збільшення його системної дії до небезпечного рівня у дорослих пацієнтів. Тому дорослим пацієнтам з порушенням функції печінки корегувати дозу не потрібно (див. розділ «Фармакокінетика»).
Спосіб застосування.
Для перорального застосування.
Флакон розчину орального забезпечений кришечкою із захистом від несанкціонованого відкриття і відкривається в такий спосіб: натисніть вниз на пластикову кришечку і одночасно поверніть її проти годинникової стрілки.
Упаковка розчину орального містить мірний стаканчик для дозування з відміткою, що відповідає 4 мл (10 мг біластину на дозу).
Діти.
Безпека та ефективність біластину для дітей віком до 2 років не підтверджені і клінічний досвід застосування дітям віком від 2 до 5 років незначний, тому біластин не слід призначати цим віковим групам.
Передозування.
Дані про передозування дітям відсутні.
Дані, що стосуються гострого передозування біластину, були отримані тільки в ході клінічних досліджень, проведених під час розробки, та під час постмаркетингового спостереження. При проведенні клінічних випробувань на тлі застосування біластину в дозах, що перевищували терапевтичну в 10-11 разів (220 мг в разі одноразового прийому, або 200 мг/добу в разі застосування протягом 7 днів), побічні реакції у 26 дорослих здорових добровольців виникали в 2 рази частіше, ніж на тлі застосування плацебо. Побічні реакції, які відзначалися найчастіше, включали запаморочення, головний біль та нудоту. Серйозних побічних реакцій та значного збільшення тривалості інтервалу QTc відмічено не було. Інформація, зібрана під час постмаркетингового спостереження, узгоджується з інформацією, отриманою при проведенні клінічних випробувань.
У ході перехресного дослідження з вимірюванням інтервалів QT/QTc, в якому у 30 здорових дорослих добровольців вивчали вплив багаторазового застосування біластину (в дозі 100 мг/добу протягом 4 днів) на реполяризацію шлуночків, статистично значимого подовження інтервалу QTc виявлено не було.
У разі передозування рекомендована симптоматична та підтримуюча терапія.
Специфічний антидот для біластину невідомий.
Побічні реакції.
Загальний профіль безпеки у пацієнтів педіатричного профілю. Під час клінічної розробки частота, тип і тяжкість побічних реакцій у підлітків (віком від 12 до 17 років) були такими ж, як у дорослих. Інформація, зібрана в даній групі (підлітки) під час постмаркетингового спостереження, підтвердила результати клінічних випробувань.
Відсоток дітей (віком від 2 до 11 років), у яких спостерігалися побічні реакції (ПР) після прийому біластину 10 мг для лікування алергічного ринокон’юнктивіту або хронічної ідіопатичної кропив’янки протягом 12-тижневого контрольованого клінічного дослідження, був порівнянний з відсотком групи пацієнтів, які отримували плацебо (68,5% проти 67,5%).
ПР, що найчастіше відмічалися в 291 дитини (віком від 2 до 11 років), які отримували біластин 10 мг (у формі таблеток, що диспергуються у ротовій порожнині) в ході клінічних випробувань (#260 дітей отримували препарат в ході клінічних досліджень з безпеки, 31 дитина отримувала препарат в ході фармакокінетичних досліджень) були головний біль, алергічний кон’юнктивіт, риніт і біль у животі. Ці ж побічні реакції відзначалися з порівнянною частотою у 249 пацієнтів, які отримували плацебо.
Таблиця з даними про побічні реакції у педіатричних пацієнтів. Нижче наведено побічні реакції, зв’язок яких з біластином визнаний або принаймні можливий та які у програмі клінічної розробки були відмічені більш ніж у 0,1% дітей (2-11 років), які застосовували біластин.
За частотою побічні реакції розподіляються за такими категоріями:
Дуже часто (≥ 1/10)
Часто (≥ 1/100 до < 1/10)
Нечасто (≥ 1/1000 до < 1/100)
Невідомо (наявні дані не дають змоги дати оцінку)
Побічні реакції, що виникають рідко і дуже рідко, а також ті, частота яких невідома, в таблиці не вказані.
Органи і системи органів Частота Побічна реакція | Біластин 10мг (n=291) # | Плацебо (n=249) | |
Інфекції та паразитарні захворювання | |||
Часто | Риніт | 3 (1,0 %) | 3 (1,2 %) |
Порушення з боку нервової системи | |||
Часто | Головний біль | 6 (2,1 %) | 3 (1,2 %) |
Нечасто | Запаморочення | 1 (0,3 %) | 0 (0,0 %) |
Втрата свідомості | 1 (0,3 %) | 0 (0,0 %) | |
Порушення з боку органів зору | |||
Часто | Алергічний кон’юнктивіт | 4 (1,4 %) | 5 (2,0 %) |
Нечасто | Подразнення очей | 1 (0,3 %) | 0 (0,0 %) |
Порушення з боку травної системи | |||
Часто | Біль у животі / Біль у верхньому відділі живота | 3 (1,0 %) | 3 (1,2 %) |
Нечасто | Діарея | 2 (0,7 %) | 0 (0,0 %) |
Нудота | 1 (0,3 %) | 0 (0,0 %) | |
Набряк губ | 1 (0,3 %) | 0 (0,0 %) | |
Порушення з боку шкіри та підшкірно-жирової тканини | |||
Нечасто | Екзема | 1 (0,3 %) | 0 (0,0 %) |
Кропив’янка | 2 (0,7 %) | 2 (0,8 %) | |
Загальні та місцеві порушення | |||
Нечасто | Втомлюваність | 2 (0,7 %) | 0 (0,0 %) |
#260 дітей отримували препарат в ході клінічних досліджень безпеки, 31 дитина отримувала препарат в ході фармакокінетичних досліджень.
Опис окремих побічних реакцій в педіатричній популяції. Головний біль, біль в животі, алергічний кон’юнктивіт та риніт спостерігалися у дітей, які отримували біластин 10 мг або плацебо. Були отримані повідомлення про такі показники частоти: головний біль - 2,1% і 1,2%; біль в животі - 1,0% і 1,2%; алергічний кон’юнктивіт - 1,4% і 2,0% і риніт - 1,0% і 1,2%.
Загальний профіль безпеки у дорослих пацієнтів і пацієнтів підліткового віку. У клінічних дослідженнях у дорослих пацієнтів і пацієнтів підліткового віку, які страждали від алергічного ринокон’юнктивіту чи хронічної ідіопатичної кропив’янки, частота виникнення побічних реакцій на фоні застосування біластину в дозі 20 мг була порівнянна з такою у пацієнтів на тлі застосування плацебо (12,7% проти 12,8%).
Клінічні випробування II і III фази, проведені під час клінічної розробки, включали 2525 дорослих пацієнтів і пацієнтів підліткового віку, що приймали різні дози біластину; 1697 з них отримували біластин в дозі 20 мг. В цих дослідженнях 1362 отримували плацебо. При застосуванні біластину для симптоматичного лікування алергічного ринокон’юнктивіту та хронічної ідіопатичної кропив’янки у дозі 20 мг найчастіше відзначалися такі побічні реакції, як головний біль, сонливість, запаморочення та втомлюваність. Приблизно з аналогічною частотою ці небажані явища відзначалися у пацієнтів, які приймали плацебо.
Таблиця з даними про побічні реакції у дорослих пацієнтів і пацієнтів підліткового віку. Нижче наведено побічні реакції, зв’язок яких з біластином визнаний або принаймні можливий та які у програмі клінічної розробки (N = 1697) були відмічені більш ніж у 0,1% пацієнтів, які застосовували біластин у дозі 20 мг.
За частотою побічні реакції розподіляються за такими категоріями:
Дуже часто (≥ 1/10)
Часто (≥ 1/100 до < 1/10)
Нечасто (≥ 1/1000 до < 1/100)
Рідко (≥ 1/10000 до < 1/1000)
Дуже рідко (< 1/10000)
Невідомо (наявні дані не дають змоги дати оцінку).
Побічні реакції, що виникають рідко і дуже рідко, а також ті, частота яких невідома, в таблиці не вказані.
Органи і системи органів Частота Побічна реакція | Біластин 20 мг N=1697 | Всі дози біластину N=2525 | Плацебо | ||
Інфекції та паразитарні захворювання | |||||
Нечасто | Герпес порожнини рота | 2 (0,12 %) | 2 (0,08 %) | 0 (0,0 %) | |
Порушення живлення та обміну речовин | |||||
Нечасто | Підвищений апетит | 10 (0,59 %) | 11 (0,44 %) | 7 (0,51 %) | |
Порушення з боку психіки | |||||
Нечасто | Тривожність | 6 (0,35 %) | 8 (0,32 %) | 0 (0,0 %) | |
Безсоння | 2 (0,12 %) | 4 (0,16 %) | 0 (0,0 %) | ||
Порушення з боку нервової системи | |||||
Часто | Сонливість | 52 (3,06 %) | 82 (3,25 %) | 39 (2,86 %) | |
Головний біль | 68 (4,01 %) | 90 (3,56 %) | 46 (3,38 %) | ||
Нечасто | Запаморочення | 14 (0,83 %) | 23 (0,91 %) | 8 (0,59 %) | |
Порушення з боку органів слуху та рівноваги | |||||
Нечасто | Шум у вухах | 2 (0,12 %) | 2 (0,08 %) | 0 (0,0 %) | |
Головокружіння | 3 (0,18 %) | 3 (0,12 %) | 0 (0,0 %) | ||
Порушення з боку серцево-судинної системи | |||||
Нечасто | Блокада правої ніжки пучка Гіса | 4 (0,24 %) | 5 (0,20 %) | 3 (0,22 %) | |
Синусова аритмія | 5 (0,30 %) | 5 (0,20 %) | 1 (0,07 %) | ||
Подовження інтервалу QT на електрокардіограмі | 9 (0,53 %) | 10 (0,40 %) | 5 (0,37 %) | ||
Інші порушення на ЕКГ | 7 (0,41 %) | 11 (0,44 %) | 2 (0,15 %) | ||
Порушення з боку дихальної системи, органів грудної клітки і середостіння | |||||
Нечасто | Задишка | 2 (0,12 %) | 2 (0,08 %) | 0 (0,0 %) | |
Неприємні відчуття у носі | 2 (0,12 %) | 2 (0,08 %) | 0 (0,0 %) | ||
Сухість у носі | 3 (0,18 %) | 6 (0,24 %) | 4 (0,29 %) | ||
Порушення з боку травної системи | |||||
Нечасто | Біль у верхньому відділі живота | 11 (0,65 %) | 14 (0,55 %) | 6 (0,44 %) | |
Біль у животі | 5 (0,30 %) | 5 (0,20 %) | 4 (0,29 %) | ||
Нудота | 7 (0,41 %) | 10 (0,40 %) | 14 (1,03 %) | ||
Неприємні відчуття в животі | 3 (0,18 %) | 4 (0,16 %) | 0 (0,0 %) | ||
Діарея | 4 (0,24 %) | 6 (0,24 %) | 3 (0,22 %) | ||
Сухість у роті | 2 (0,12 %) | 6 (0,24 %) | 5 (0,37 %) | ||
Диспепсія | 2 (0,12 %) | 4 (0,16 %) | 4 (0,29 %) | ||
Гастрит | 4 (0,24 %) | 4 (0,16 %) | 0 (0,0 %) | ||
Порушення з боку шкіри та підшкірно-жирової тканини | |||||
Нечасто | Свербіж | 2 (0,12 %) | 4 (0,16 %) | 2 (0,15 %) | |
Загальні порушення та у місці застосування | |||||
Нечасто | Втомлюваність | 14 (0,83 %) | 19 (0,75 %) | 18 (1.32 %) | |
Спрага | 3 (0,18 %) | 4 (0,16 %) | 1 (0,07 %) | ||
Посилення вже наявних захворювань | 2 (0,12 %) | 2 (0,08 %) | 1 (0,07 %) | ||
Пропасниця | 2 (0,12 %) | 3 (0,12 %) | 1 (0,07 %) | ||
Астенія | 3 (0,18 %) | 4 (0,16 %) | 5 (0,37 %) | ||
Додаткові методи дослідження | |||||
Нечасто | Підвищення рівня гама-глутамілтрансферази | 7 (0,41 %) | 8 (0,32 %) | 2 (0,15 %) | |
Підвищення рівня аланінамінотрансферази | 5 (0,30 %) | 5 (0,20 %) | 3 (0,22 %) | ||
Підвищення рівня аспартатамінотрансферази | 3 (0,18 %) | 3 (0,12 %) | 3 (0,22 %) | ||
Підвищення рівня креатиніну у крові | 2 (0,12 %) | 2 (0,08 %) | 0 (0,0 %) | ||
Підвищення рівня тригліцеридів у крові | 2 (0,12 %) | 2 (0,08 %) | 3 (0,22 %) | ||
Збільшення маси тіла | 8 (0,47 %) | 12 (0,48 %) | 2 (0,15 %) | ||
Частота невідома (неможливо оцінити на підставі наявних даних). У постмаркетинговий період спостерігалися посилене серцебиття, тахікардія, реакції гіперчутливості (такі як анафілаксія, ангіоневротичний набряк, задишка, висип, локалізований/місцевий набряк та еритема) та блювання.
Опис окремих побічних реакцій у дорослих пацієнтів і пацієнтів підліткового віку. Сонливість, головний біль, запаморочення і втомлюваність спостерігалися у пацієнтів, які отримували біластин 20 мг або плацебо. Їхня частота становила відповідно 3,06 % проти 2,86 % для сонливості; 4,01 % проти 3,38 % для головного болю; 0,83 % проти 0,59 % для запаморочення і 0,83 % проти 1,32 % для стомлюваності.
Інформація, отримана в ході постмаркетингового спостереження, підтвердила профіль безпеки, отриманий під час клінічної розробки.
Повідомлення про підозрювані побічні реакції. Повідомлення про підозрювані побічні реакції після реєстрації лікарського засобу відіграють важливу роль. Це дає змогу продовжувати спостереження за співвідношенням користі та ризику застосування лікарського засобу. Працівники галузі охорони здоров’я повинні повідомляти про будь-які підозрювані побічні реакції через національну систему повідомлень.
Термін придатності.
3 роки. Термін придатності після першого відкриття флакона становить 6 місяців.
Умови зберігання.
Зберігати при температурі не вище 30 °С.
Упаковка
По 120 мл у флаконі; по 1 флакону з мірним стаканом у картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
БЕРЛІН-ХЕМІ АГ.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Глінікер Вег 125, 12489 Берлін, Німеччина.
Заявник.
Менаріні Інтернешонал Оперейшонс Люксембург С.А.
Місцезнаходження заявника.
1, Авеню де ла Гар, Л-1611 Люксембург, Люксембург.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО

