НАГЛАЗИМ
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.
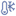 від 2 °С до 8 °С. Не заморожувати
від 2 °С до 8 °С. Не заморожувати 

ІНСТРУКЦІЯ
для медичного застосування препарату
Наглазим
( Naglazyme ® )
Склад:
діюча речовина:galsulfase;
1 мл розчину містить 1 мг галсульфази;
1 флакон містить 5 мг галсульфази;
допоміжні речовини: натрію хлорид; натрію дигідрофосфат, моногідрат; натрію гідрофосфат, гептагідрат; полісорбат 80; вода для ін’єкцій.
Лікарська формаКонцентрат для розчину для інфузій.
Основні фізико-хімічні властивості:
Від прозорої до трохи опалесціюючої рідина, від безбарвного до блідо-жовтого кольору.
Фармакотерапевтична група. Код АТС .
Інші засоби, що впливають на травну систему та метаболічні процеси, ферменти. Код АТС A16A B08.
Фармакологічні властивості
Дефіцит певних лізосомальних ферментів, необхідних для катаболізму глікозаміногліканів (ГАГ), викликає порушення накопичення мукополісахаридів. Мукополісахаридоз VI типу (МПС VI) - це гетерогенне і мультисистемне захворювання, що характеризується дефіцитом N-ацетилгалактозамін-4-сульфатази, лізосомальної гідролази, що каталізує гідроліз сульфатного фрагмента глікозаміноглікану, дерматансульфату. Знижена кількість або відсутність N-ацетилгалактозамін-4-сульфатази призводить до накопичення дерматансульфату в клітинах різних типів і тканинах.
Обґрунтування ферментної терапії полягає у відновленні рівня ферментативної активності, достатньої для гідролізу накопиченого субстрату, і запобіганні подальшому накопиченню.
Очищена галсульфаза, рекомбінантна форма N-ацетилгалактозамін-4-сульфатази людини, являє собою глікопротеїн з молекулярною масою приблизно 56 кДа. Після відщеплення N-кінця галсульфаза складається з 495 амінокислот. Молекула містить 6 N-зв’язаних олігосахаридних модифікаційних ділянок. Після внутрішньовенного введення галсульфаза швидко виводиться з кровотоку і захоплюється клітинами з розташуванням в лізосомах, швидше за все, за участі маноза-6-фосфатних рецепторів.
Три клінічних дослідження Наглазиму були зосереджені на оцінці системних проявів мукополісахаридозу VI типу (МПС VI), таких як витривалість, рухливість у суглобах, болі в суглобах і ригідність, обструкція верхніх дихальних шляхів, дрібна моторика рук і гострота зору.
Безпека та ефективність Наглазиму оцінювалися в рандомізованому, подвійному сліпому, плацебо-контрольованому дослідженні 3 фази за участю 39 пацієнтів з мукополісахаридозом VI типу (МПС VI) віком від 5 до 29 років. Більшість пацієнтів мали низький зріст, порушену витривалість і симптоми з боку опорно-рухового апарату. У дослідження були включені пацієнти, які на вихідному рівні могли пройти більше 5 метрів, але менше 250 м за 6 хвилин у 12-хвилинному тесті ходьби або менше 400 м за 12 хвилин.
Щотижня, в цілому протягом 24 тижнів, пацієнти отримували 1 мг/кг галсульфази або плацебо. Основним кінцевим показником ефективності була кількість пройдених за 12 хвилин метрів на 24-му тижні порівняно з кількістю пройдених метрів на початковому рівні. Вторинними кінцевими показниками ефективності були кількість пройдених сходів за 3 хвилини й екскреція сечових глікозаміногліканів (ГАГ) у пацієнтів групи лікування порівняно з групою плацебо на 24-му тижні. 38 пацієнтів згодом були включені у відкрите розширене дослідження, у якому вони щотижня отримували по 1 мг/кг галсульфази.
Після 24 тижнів лікування у пацієнтів, що отримували Наглазим, відзначалося покращення пройденої за 12 хвилин відстані 92±40 м, порівняно з групою плацебо (р = 0,025). У пацієнтів групи лікування відзначалося покращення у 3-хвилинному тесті з підйомом сходами на 5,7 сходинки за хвилину, порівняно з групою плацебо. Після 24 тижнів лікування, порівняно з групою плацебо, у пацієнтів групи лікування також спостерігалося середнє зниження екскреції сечового глікозаміноглікану на 238 ± 17,8 мкг/мг креатиніну (± стандартна похибка (СП)). В групі лікування Наглазимом результати глікозаміногліканів (ГАГ) наблизилися до нормального вікового діапазону.
У додатковому рандомізованому дослідженні 4 фази з двома рівнями доз брали участь
4 пацієнти з мукополісахаридозом VI типу (МПС VI) віком до 1 року, які отримували 1 або 2 мг/кг/тиждень протягом 53‑153 тижнів.
Попри дуже малу кількість пацієнтів, що брали участь у дослідженні, воно дозволяє зробити такі висновки.
Лікування Наглазимом демонструє поліпшення або відсутність погіршення щодо дисморфізму обличчя. Воно не запобігає прогресуванню дисплазії скелету і розвитку гриж, а також не запобігає прогресуванню помутніння рогівки. Темпи росту залишалися нормальними протягом цього обмеженого періоду спостереження. В усіх чотирьох пацієнтів поліпшення слуху було відзначено принаймні в одному вусі. Рівні сечових глікозаміногліканів (ГАГ) знизилися більш ніж на 70 %, що узгоджується з результатами у пацієнтів старшого віку.
Фармакокінетика галсульфази оцінювалась у 13 пацієнтів з мукополісахаридозом VI типу (МПС VI), що отримували 1 мг/кг галсульфази у вигляді 4-годинної інфузії. Після 24 тижнів лікування середня (± стандартна похибка (СП)) максимальна концентрація в плазмі (Cmax) становила 2357 (± 1560) нг/мл і середня (± СП) площа під кривою «концентрація - час» (AUC0-T) становила 5860 (± 4184) год × нг/мл. Середній (± СП) об’єм розподілу (Vz) становив 316 (± 752) мл/кг і середній (± СП) плазматичний кліренс (CL) становив 7,9 (± 14,7) мл/хв/кг. Середній (± СП) період напіввиведення (t1/2) становив 22,8 (±10,7) хв на 24-му тижні.
Фармакокінетичні параметри у пацієнтів, включених у дослідження 1 фази, залишалися стабільними протягом тривалого часу (принаймні до 194 тижнів).
Галсульфаза - це білок, що підлягає метаболічній деградації шляхом гідролізу пептидів. Отже, не очікується клінічно значущого впливу порушення функції печінки на фармакокінетику галсульфази. Виведення галсульфази шляхом ниркової екскреції вважається незначним.
Клінічні характеристики
Показання.
Наглазим застосовують для довгострокової ферментної замісної терапії пацієнтів з підтвердженим діагнозом мукополісахаридозу VI типу (МПС VI; недостатність N-ацетилгалактозамін-4-сульфатази; синдром Марото-Ламі).
Протипоказання.
Тяжка або загрозлива для життя підвищена чутливість до активної речовини або до будь-якої допоміжної речовини, яка не піддається корекції.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження щодо взаємодії з лікарськими засобами не проводились.
Особливості застосування.
Застосування пацієнтам з порушеннями респіраторного тракту
Під час застосування Наглазиму пацієнтам з порушеннями респіраторного тракту слід дотримуватися обережності, обмеживши або ретельно контролюючи застосування антигістамінних та інших седативних лікарських засобів. У відповідних клінічних випадках слід розглянути необхідність застосування позитивного тиску в дихальних шляхах під час сну, а також трахеостомії.
Для пацієнтів з гострою лихоманкою або респіраторним захворюванням, можливо потрібно буде відкласти застосування інфузії Наглазиму.
Застосування пацієнтам з інфузійними реакціями
У пацієнтів, що отримували Наглазим, спостерігалися інфузійні реакції, що визначаються як будь-які небажані реакції під час інфузії або протягом 24 годин після інфузії.
За даними, отриманими в ході клінічних досліджень Наглазиму, протягом 4-8 тижнів після початку лікування у більшості пацієнтів очікується утворення антитіл IgG до галсульфази.
У клінічних дослідженнях Наглазиму інфузійні реакції, як правило, корегувалися шляхом переривання або уповільнення швидкості інфузії і (попереднього) введення пацієнту антигістамінних засобів та/або жарознижувальних засобів (парацетамол), що дозволяє пацієнту продовжити лікування.
Враховуючи обмежений досвід щодо поновлення лікування після тривалої перерви, слід дотримуватися обережності через теоретично можливе збільшення ризику виникнення реакції підвищеної чутливості.
Щоб мінімізувати можливість виникнення інфузійних реакцій, при введенні Наглазиму пацієнтам рекомендується попередньо вводити антигістамінні засоби з жарознижувальними засобами або без них приблизно за 30-60 хвилин до початку інфузії.
У випадку легкої або помірної інфузійної реакції слід розглянути необхідність введення антигістамінних засобів і парацетамолу та/або необхідність зниження швидкості інфузії до половини від швидкості, за якої виникла реакція.
У випадку окремої тяжкої інфузійної реакції інфузію слід припинити до зникнення симптомів, а також розглянути необхідність введення антигістамінних засобів та парацетамолу. Інфузійне введення можна відновити, зменшивши швидкість інфузії до
50 % -25 % від швидкості, за якої виникла реакція.
У разі рецидивної помірної інфузійної реакції або повторного введення після окремої тяжкої інфузійної реакції слід розглянути необхідність попереднього застосування медикаментозної терапії (антигістамінних засобів, парацетамолу та/або кортикостероїдів) і зменшення швидкості інфузії до 50% -25% від швидкості, за якої виникла попередня реакція.
Як і у випадку внутрішньовенного введення будь-якого білкового лікарського засобу, можливі тяжкі реакції підвищеної чутливості алергічного типу. При виникненні таких реакцій рекомендується негайно припинити введення Наглазиму та розпочати відповідне медикаментозне лікування. Слід дотримуватись сучасних медичних стандартів надання невідкладної допомоги. Пацієнти з алергічними реакціями під час інфузії Наглазиму потребують обережності при повторних введеннях; під час проведення інфузій необхідна наявність належним чином підготовленого персоналу та обладнання для надання невідкладної реанімаційної допомоги (у тому числі введення адреналіну). Тяжкі або потенційно загрозливі для життя реакції підвищеної чутливості є протипоказанням до повторного введення, якщо реакція підвищеної чутливості не піддається корекції.
Наглазим містить 0,8 ммоль (18,4 мг) натрію в одному флаконі і вводиться у розчині натрію хлориду 9 мг/мл для ін’єкцій. Це слід враховувати при лікуванні пацієнтів, що дотримуються дієти з контрольованим вмістом натрію.
Компресія спинного мозку або його шийного відділу
Компресія спинного мозку або його шийного відділу (КСШ), що спричиняє мієлопатію, є відомим і серйозним ускладненням мукополісахаридозу VI типу (МПС VI). КСШ виникає під час природного перебігу цієї хвороби у пацієнтів, включаючи тих, кому призначають Наглазим. Протягом післяреєстраційного періоду у деяких пацієнтів, що отримували Наглазим, з’являлась або посилювалась КСШ, що викликало необхідність проведення декомпресійної хірургії. Пацієнти з мукополісахаридозом VI типу (МПС VI) потребують нагляду для виявлення ознак і симптомів КСШ (включаючи біль у спині, параліч кінцівок нижче рівня компресії, нетримання сечі і калу) і відповідної клінічної допомоги.
Застосування у період вагітності або годування груддю.
Вагітність
Немає клінічних даних щодо застосування препарату Наглазим вагітним жінкам. Дослідження на тваринах не вказують на прямий або опосередкований шкідливий вплив на вагітність або ембріофетальний розвиток. Наглазим не слід застосовувати вагітним жінкам, за винятком тих випадків, коли лікування необхідне.
Годування груддю
Інформація щодо екскреції галсульфази у грудне молоко відсутня, тому слід припинити годування груддю під час лікування Наглазимом.
Фертильність
Дослідження репродуктивної функції, проведені на тваринах у дозах до 3 мг/кг/добу, не виявили порушення фертильності або шкідливого впливу на ембріон або плід внаслідок застосування Наглазиму.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Дослідження щодо впливу на здатність керувати транспортними засобами та працювати з механізмами не проводились.
Спосіб застосування та дози.
Як і у випадку інших лізосомальних генетичних порушень, вкрай важливо, особливо за тяжких форм, розпочинати лікування якомога раніше, до появи необоротних клінічних проявів захворювання.
Лікування Наглазимом слід проводити під наглядом лікаря, який має досвід лікування пацієнтів з мукополісахаридозом VI типу (МПС VI) або іншими спадковими метаболічними захворюваннями. Наглазим слід вводити у відповідних клінічних умовах, за наявності реанімаційного обладнання для надання невідкладної медичної допомоги.
Дозування
Рекомендована доза галсульфази становить 1 мг/кг маси тіла один раз на тиждень у вигляді внутрішньовенної інфузії протягом 4 годин.
Окремі групи пацієнтів
Пацієнти літнього віку
Безпека та ефективність Наглазиму для пацієнтів віком понад 65 років не була встановлена, і рекомендації щодо альтернативної схеми дозування для цих пацієнтів відсутні.
Пацієнти з порушенням функції нирок та печінки
Безпека та ефективність Наглазиму для пацієнтів з нирковою або печінковою недостатністю не була встановлена, й рекомендації щодо альтернативної схеми дозування для цих пацієнтів відсутні.
Інструкції щодо застосування препарату
Спосіб застосування
Початкову швидкість інфузії регулюють таким чином, щоб приблизно 2,5 % від загального об’єму розчину було введено протягом першої години, а об'єм, що залишився (приблизно 97,5 %), вводять протягом наступних 3 годин.
Кожен флакон Наглазиму призначений лише для одноразового використання. Концентрат для розчину для інфузій потрібно розвести у розчині натрію хлориду 9 мг/мл (0,9 %) для інфузій з використанням асептичного методу. Розведений розчин Наглазиму слід вводити пацієнтам з використанням системи для інфузій, оснащеної вбудованим 0,2 мкм фільтром.
Приготування інфузійного розчину Наглазиму (слід використовувати асептичний метод)
Залежно від ваги конкретного пацієнта необхідно визначити кількість флаконів для розведення й заздалегідь, приблизно за 20 хвилин, вийняти їх з холодильника, щоб флакони досягли кімнатної температури.
Перед розведенням кожен флакон потрібно перевірити на наявність механічних включень і зміну кольору. Розчин має бути від прозорого до трохи опалесцюючого, від безбарвного до блідо-жовтого кольору, вільний від видимих часток.
З інфузійного мішка об’ємом 250 мл слід видалити та утилізувати об’єм розчину натрію хлориду 9 мг/мл (0,9 %) для інфузії, що дорівнює загальному об’єму Наглазиму, який треба додати. Застосування інфузійних мішків об’ємом по 100 мл потрібно розглянути для пацієнтів, що сприйнятливі до перевантаження рідиною і мають вагу менш ніж 20 кг; у цьому випадку швидкість інфузії (мл/год) має бути зменшена таким чином, щоб загальна тривалість інфузії становила не менше 4 годин. При використанні мішків об’ємом по
100 мл об’єм Наглазиму можна додавати безпосередньо до інфузійного мішка.
Наглазим слід повільно додавати до розчину натрію хлориду 9 мг/мл (0,9 %) для інфузій.
Перед інфузією розчин слід обережно змішати.
Перед застосуванням слід візуально перевірити розчин щодо вмісту механічних включень. Слід використовувати лише прозорі і безбарвні розчини без видимих часток.
Розведені розчини: хімічна і фізична стабільність при використанні була підтверджена протягом терміну до 4 днів при кімнатній температурі (23°C -27 °C).
З точки зору мікробіологічної безпеки Наглазим слід використовувати відразу. Якщо препарат не використовується відразу, користувач є відповідальним за терміни і умови зберігання при використанні; зазвичай препарат слід зберігати не довше 24 годин при температурі 2 °C -8 °C, а потім до 24 годин при кімнатній температурі (23 °C -27 °C) протягом введення.
Будь-який невикористаний продукт або відходи підлягають утилізації відповідно до місцевих вимог.
Діти.
Препарат застосовують для лікування дітей, включно з віковою групою до 5 років, які мають тяжку форму мукополісахаридозу VI типу (МПС VI), хоча діти цієї вікової групи не були включені до базового дослідження 3 фази.
Дані щодо застосування дітям віком до 1 року обмежені.
Обґрунтування особливостей застосування Наглазиму дітям відсутнє.
Передозування.
Деякі пацієнти отримали сумарну дозу Наглазиму, коли швидкість інфузії була приблизно удвічі більша від рекомендованої, без видимих побічних ефектів.
Побічні реакції.
У зв’язку з невеликою кількістю пацієнтів у клінічних дослідженнях, дані усіх досліджень Наглазиму щодо побічних реакцій були об’єднані і розглянуті в одному аналізі даних клінічних досліджень з безпеки.
У всіх пацієнтів, що отримували Наглазим (59 з 59), була відзначена принаймні одна побічна реакція. У більшості (42 з 59; 71 %) пацієнтів була відзначена принаймні одна небажана побічна реакція. Найбільш частими небажаними реакціями були лихоманка, висип, свербіж, кропив’янка, озноб, нудота, головний біль, біль у животі, блювання і задишка. Серйозні побічні реакції включали набряк гортані, апное, лихоманку, кропив’янку, порушення дихання, ангіоневротичний набряк, астму та анафілактоїдну реакцію.
Інфузійні реакції, визначені як побічні реакції, що виникають під час інфузії Наглазиму або до закінчення дня протягом якого вводили препарат, спостерігалися у 33 (56 %) з 59 пацієнтів, що отримували Наглазим у п’яти клінічних дослідженнях. Інфузійні реакції спостерігалися починаючи з тижня 1 та закінчуючи тижнем 146 терапії Наглазимом, і виникали при багатократних інфузійних введеннях, хоча й не завжди протягом послідовних тижнів. Дуже частими симптомами цих інфузійних реакцій були лихоманка, озноб, висип, кропив’янка й задишка. Частими симптомами інфузійних реакцій були свербіж, блювання, біль у животі, нудота, гіпертензія, головний біль, біль у грудній клітці, еритема, кашель, гіпотензія, ангіоневротичний набряк, порушення дихання, тремор, кон’юнктивіт, нездужання, бронхоспазм і біль в суглобах.
Побічні реакції, інформація про які наведена нижче, класифіковані за органами та системами та за частотою виникнення. За частотою виникнення побічні реакції розподілені на такі категорії: дуже часті - реакції з частотою ≥1/10; часті - реакції з частотою від ≥1/100 до <1/10. Враховуючи малу популяцію пацієнтів, побічні реакції у одного пацієнта класифіковані як часті. У кожній групі побічні реакції наведені у порядку зменшення їх тяжкості. Побічні реакції, зареєстровані протягом післяреєстраційного періоду, визначені як «частота невідома» (частоту не можна визначити за наявними даними).
У цілому, протягом усіх клінічних досліджень спостерігався один випадок апное уві сні.
З боку імунної системи: невідома частота - анафілаксія, шок.
Інфекції та інвазії: дуже часто - фарингіт1, гастроентерит1.
Порушення з боку нервової системи: дуже часто - арефлексія1, головний біль; часто - тремор; невідома частота - парестезія.
З боку органів зору: дуже часто - кон’юнктивіт1, помутніння рогівки1.
Кардіологічні порушення: невідома частота - брадикардія, тахікардія, ціаноз.
З боку органів слуху та рівноваги:дуже часто - біль у вухах1, порушення слуху1.
З боку судинної системи: дуже часто - гіпертензія1; часто - гіпотензія; невідома частота - блідість.
Респіраторні, торакальні та медіастинальні порушення: дуже часто - задишка1, закладеність носа1; часто - апное1, кашель, порушення дихання, астма, бронхоспазм; невідома частота - набряк гортані, гіпоксія, тахіпное.
З боку травної системи:дуже часто - біль у животі1, пупкова грижа1, блювання, нудота.
З боку шкіри та підшкірної клітковини: дуже часто - ангіоневротичний набряк1, висип1, кропив’янка, свербіж; часто - еритема.
Системні порушення та ускладнення у місці введення: дуже часто - біль1, біль у грудній клітці1, озноб 1, нездужання1, лихоманка.
З боку кістково-м’язової системи та сполучної тканини: дуже часто - біль у суглобах.
Примітки:
1 Реакції, що відмічалися частіше в активній групі плацебо-контрольованого дослідження, ніж у групі плацебо; частота визначалася у 39 пацієнтів сліпого дослідження 3 фази.
Інші реакції з відомою частотою реєструвалися у 59 пацієнтів, що отримували Наглазим у всіх п’яти клінічних дослідженнях.
Реакції з невідомою частотою реєструвалися протягом післяреєстраційного періоду.
У чотирьох пацієнтів віком до 1 року загальний профіль безпеки більш високої дози (2мг/кг/тиждень) не мав клінічно значущої відмінності від профілю рекомендованої дози 1мг/кг/тиждень і відповідав профілю безпеки Наглазиму у дітей старшого віку.
Імуногенність
З 59 пацієнтів, що отримували Наглазим у клінічних дослідженнях, 54 були протестовані на наявність антитіл IgG. 53 з 54 пацієнтів (98 %) мали позитивний тест на наявність антитіл IgG до галсульфази.
Всебічний аналіз антитіл на основі даних трьох клінічних досліджень було проведено у 48 пацієнтів.
Хоча у більшої частки пацієнтів з високим загальним титром антитіл відзначалися повторні інфузійні реакції, титр антитіл до галсульфази не дозволяє прогнозувати їх частоту та тяжкість. Крім того, розвиток антитіл не є прогностичною ознакою зниженої ефективності, хоча пацієнти з обмеженою відповіддю щодо параметрів витривалості або сечових глікозаміногліканів (ГАГ) мають тенденцію до більш високих пікових анти-галсульфазних титрів, ніж пацієнти з доброю відповіддю.
Термін придатності.3 роки.
Умови зберігання.
Зберігати при температурі 2 °C -8 °C.
Не заморожувати.
Зберігати в недоступному для дітей місці.
Несумісність.
Цей лікарський засіб не можна змішувати з іншими лікарськими засобами, за винятком розчину натрію хлориду 9 мг/мл (0,9 %) для інфузії.
Упаковка.
По 5 мл у флаконі, закупореному пробкою та обтисненому алюмінієвим ковпачком з поліпропіленовим диском типу «flip-off». По 1 флакону у картонній коробці.
Категорія відпуску.За рецептом.
Заявник. БіоМарин Юроуп Лімітед.
Місцезнаходження.10 Блумсбурі Вей, Лондон WC1A 2SL, Велика Британія.
Виробник .
1) Джубілант ХоллістерСтер ЛЛС
(виробництво балку, наповнення в первинну упаковку та контроль балку).
2) Веттер Фарма-Фертігунг ГмбХ і Ко. КГ
(виробництво балку, наповнення в первинну упаковку, контроль балку та контроль якості готового лікарського засобу).
3) АндерсонБрекон (ЮК) Лімітед
(маркування та вторинне пакування готового лікарського засобу).
4) Енвіго Аналітикс Лімітед
(контроль якості готового лікарського засобу).
5) Каталент ЮК Пекеджинг Лімітед
(маркування та вторинне пакування готового лікарського засобу, виробник відповідальний за випуск серії).
6) БіоМарин Інтернешнл Лімітед
(контроль якості готового лікарського засобу, маркування, вторинне пакування, відповідальний за випуск серії).
Місцезнаходження.
1) 3525 Вулиця Північний Регал, Споукене, 99207, США.
2) - Айзенбанштр. 2-4, 88085, Лангенарген, Баден-Вюртемберг, Німеччина;
- Мусвайсен 2, 88214 Равенсбург, Німеччина;
- Хельмут-Веттер-Штрассе 10, 88213 Равенсбург, Німеччина.
3) Юнітс 2-7, Вай Валлі Бізнес Парк, Брекон Роад, Хей-он-Вай Герефорд HR3 5PG, Велика Британія.
4) Вуллей Роад, Алконбарі, PE28 4HS, Велика Британія.
5) Ланкастер Вей, Вінгейтс Індастріал Естейт, Вестоутон, Болтон, Ланкашир BL5 3XX, Велика Британія.
6) Шанбаллі, Рінгаскідді, Ко. Корк, Ірландія.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО

