САЙЗЕН® 8 МГ КЛІК.ІЗІ
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.

ІНСТРУКЦІЯ
для медичного застосування препарату
САЙЗЕН ® 8 мг клік.ізі
( SAIZEN ® 8 mg click . easy ® )
Склад :
діюча речовина: соматропін;
1флакон з порошком містить 8 мг соматропіну (рекомбінантного людського гормону росту);
допоміжні речовини: сахароза, кислота фосфорна та натрію гідроксид (для доведення рН);
розчинник: 1 картридж з бактеріостатичним розчинником містить 1,37 мл 0,3 % (м./об.) розчину м-крезолу у воді для ін’єкцій.
Лікарська форма Порошок для приготування розчину для ін’єкцій.
Основні фізико-хімічні властивості: препарат представляє собою білу або майже білу ліофілізовану речовину, розчинник - прозорий безбарвний розчин.
Фармакотерапевтична група
Гормони передньої долі гіпофіза та їх аналоги. Соматропін.Код АТС Н01А С01.
Фармакологічні властивості
Препарат Сайзен® містить рекомбінантний гормон росту людини (соматропін), вироблений за допомогою генно-інженерних методів із клітин ссавців. Соматропін - це пептид, який складається з 191 амінокислоти та є ідентичним до людського гіпофізарного гормону росту за амінокислотною послідовністю та складом, а також за картою пептидів, ізоелектричною точкою, молекулярною вагою, ізомерною структурою та біологічною активністю.
Соматропіну притаманні анаболічні та антикатаболічні властивості, тобто він впливає не лише на ріст, але й на будову тіла та метаболізм. Соматропін взаємодіє зі специфічними рецепторами на клітинах різного типу, включаючи міоцити, гепатоцити, адипоцити, лімфоцити та гематопоетичні клітини. Деякі з таких ефектів опосередковуються іншим класом гормонів, відомим як соматомедини (IGF-1 та IGF-2).
Залежно від величини дози, введення препарату призводить до підвищення рівнів IGF-1 (інсуліноподібний фактор росту 1), IGFBP-3 (білок 3, що зв’язує інсуліноподібний фактор росту), неетирифікованих жирних кислот та гліцерину і зниження рівнів сечовини в крові, а також до зменшення сечового виведення азоту, натрію та калію. Тривалість підвищення рівнів гормону росту може відігравати важливу роль у визначенні ступеня його ефективності. Для високих доз соматропіну ймовірно існування явища відносного насичення ефекту, але це не стосується глікемії та сечового виведення С-пептиду, які суттєво зростають лише після введення високих доз препарату (20 мг).
Фармакокінетика препарату має лінійний характер щонайменше при застосуванні доз до 8 МО (2,67 мг). При застосуванні вищих доз (60 МО/20 мг) не можна виключати деякої нелінійності відповіді, яка, однак, не має клінічного значення.
Після внутрішньовенного введення препарату здоровим добровольцям об’єм розподілу у рівноважному стані становить приблизно 7 л, загальний метаболічний кліренс − приблизно 15 л/годину, тоді як нирковий кліренс є незначним. Період напіввиведення препарату становить 20-35 хвилин.
Після разового підшкірного або внутрішньом’язового введення препарату уявний кінцевий період напіввиведення триваліший і становить приблизно від 2 до 4 годин, що зумовлено процесом абсорбції, який обмежує швидкість виведення.
Максимальні сироваткові концентрації соматропіну досягаються приблизно через 4 години після введення, після чого сироватковий рівень гормону росту повертається до базового протягом 24 годин, що свідчить про відсутність кумуляції соматропіну при повторних введеннях.
Абсолютна біодоступність соматропіну при внутрішньом’язовому та підшкірному введенні становить 70-90 %.
Ураження нирок
Відомо, що кліренс соматропіну у пацієнтів з ураженням нирок зменшується. Однак, за клінічними даними, це не потребує регулювання дози препарату.
Ураження печінки
Відомо, що кліренс соматропіну у пацієнтів з ураженням печінки зменшується. Однак, клінічне значення цього факту невідоме, оскільки вплив препарату Сайзен® на пацієнтів з ураженням печінки не вивчався.
Клінічні характеристики
Показання.
Діти
- Затримка росту у дітей, спричинена зменшенням або відсутністю секреції ендогенного гормону росту.
- Затримка росту у дівчаток з дисгенезією гонад (синдром Тернера), підтвердженою хромосомним аналізом.
- Затримка росту у дітей препубертатного віку, спричинена хронічною нирковою недостатністю.
- Порушення росту у низькорослих дітей віком від 4 років (індекс стандартного відхилення (SDS) існуючого росту < -2,5 та з урахуванням росту батьків SDS < -1), які народились зі зростом, що не відповідає гестаційному віку, а маса тіла та/або довжина яких при народженні була менше -2 SD (стандартне відхилення), і які не наздогнали необхідний зріст (SDS швидкості росту < 0 протягом останнього року).
Дорослі
- Замісна терапія у дорослих з вираженим дефіцитом гормону росту, діагностованим за одним динамічним тестом на дефіцит гормону росту.
Дефіцит гормону росту, діагностований у дитинстві
Пацієнти, у яких недостатність гормону росту була діагностована у дитинстві, перед початком гормонозамісної терапії із застосуванням препарату Сайзен® повинні пройти повторне обстеження для підтвердження дефіциту гормону росту.
Дефіцит гормону росту, діагностований у дорослому віці
Пацієнтам має бути поставлений діагноз недостатності гормону росту внаслідок захворювань гіпоталамуса або гіпофіза та дефіциту щонайменше ще одного гормону (за винятком пролактину). Крім того, перед початком застосування соматропіну слід розпочати відповідну гормонозамісну терапію іншими гормонами.
Протипоказання.
- Гіперчутливість до діючої речовини або до будь-яких допоміжних речовин порошку або розчинника;
- закриття епіфізарних зон росту у дітей;
- наявність активних новоутворень; до початку лікування слід впевнитись, що будь-які існуючі новоутворення перебувають в неактивній формі і будь-яка протипухлинна терапія завершена; лікування слід припинити у разі наявності доказів росту пухлини;
- підтверджене прогресування або рецидив основного внутрішньочерепного об’ємного процесу;
- гострі критичні стани, які розвинулися внаслідок ускладнень після відкритої операції на серці, черевній порожнині, внаслідок множинних травм, гострої дихальної недостатності або подібних патологій;
- трансплантація нирки у дітей з хронічною нирковою недостатністю; застосування соматропіну необхідно припинити на час трансплантації нирки;
- проліферативна або передпроліферативна діабетична ретинопатія.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Одночасне застосування кортикостероїдів інгібує прискорення росту, спричинене препаратами, що містять соматропін. Для запобігання будь-якому інгібуючому впливу кортикостероїдів на дію гормону росту слід провести ретельне коригування замісної терапії пацієнтів з дефіцитом адренокортикотропного гормону.
Крім того, у деяких пацієнтів початок гормонозамісної терапії може призвести до проявлення замаскованої вторинної недостатності надниркових залоз за рахунок зниження активності 11β-гідроксистероїд-дегідрогенази типу 1 (11β-HSD1) - ферменту, який перетворює неактивний кортизон у кортизол. Початок застосування соматропіну у пацієнтів, які проходять курс замісної терапії кортикостероїдами, може призвести до появи дефіциту кортизолу. У таких випадках може бути потрібним коригування дози кортикостероїдів.
Оскільки пероральні препарати естрогенів можуть послаблювати відповідь на лікування соматропіном, що виражається у зниженні сироваткових рівнів IGF-1, пацієнтам, що проходять курс замісної терапії пероральними препаратами естрогенів, може бути потрібним збільшення дози соматропіну.
Дані, одержані у дослідженні лікарських взаємодій при лікуванні дорослих пацієнтів з дефіцитом гормону росту, дозволяють припустити, що введення соматропіну може збільшувати кліренс сполук, які метаболізуються ізоферментами системи цитохрому Р450. Кліренс сполук, що метаболізуються за участю системи цитохрому Р450 3А4 (наприклад статеві гормони, кортикостероїди, протисудомні препарати та циклоспорин), може суттєво зростати, що призводитиме до зниження рівня цих сполук у плазмі крові. Клінічне значення цього явища невідоме.
Особливості застосування.
Лікування препаратом слід проводити під постійним наглядом лікаря, який має досвід діагностування та лікування пацієнтів з дефіцитом гормону росту.
Новоутворення
Пацієнтів із внутрішньо- та зовнішньочерепними новоутвореннями в стадії ремісії, які лікуються гормоном росту, слід ретельно обстежувати з регулярними інтервалами. При лікуванні пацієнтів з дефіцитом гормону росту, зумовленим наявністю внутрішньочерепних пухлин, слід проводити часті медичні обстеження для виявлення можливого прогресування або рецидивів основного захворювання.
Існують лише обмежені дані щодо ризику розвитку пухлин під час лікування гормоном росту. Тому під час лікування препаратами соматропіну пацієнти повинні перебувати під ретельним наглядом.
Повідомлялося про зростання ризику розвитку вторинних новоутворень у дітей, які хворіли на рак і після виліковування первинного раку лікувались соматропіном. Серед цих вторинних новоутворень найпоширенішими були внутрішньочерепні пухлини, зокрема менінгіоми, які спостерігалися у пацієнтів після променевої терапії первинного новоутворення голови. Однак при лікуванні соматропіном дітей з вилікуваним раком не повідомлялося про збільшення ризику рецидиву. З урахуванням обмеженості даних, під час лікування препаратом пацієнти повинні знаходитись під ретельним наглядом для виявлення прогресування або рецидиву пухлин.
Синдром Прадера − Віллі
Препарат Сайзен® не показаний для тривалого лікування дітей, у яких затримка росту зумовлена генетично підтвердженим синдромом Прадера −Віллі, якщо у них також не діагностований дефіцит гормону росту. Існують повідомлення про синдром нічного апное та раптову смерть після початку лікування гормоном росту дітей з синдромом Прадера − Віллі, які мали один або декілька наступних факторів ризику: тяжка форма ожиріння, обструкція верхніх дихальних шляхів або синдром нічного апное в анамнезі та невизначена інфекція дихальних шляхів.
Лейкемія
У невеликої кількості пацієнтів з дефіцитом гормону росту, частина з яких лікувалась соматропіном, була діагностована лейкемія. Проте немає жодних доказів того, що у пацієнтів, які не мають предиктивних факторів, лікування соматропіном призводить до зростання частоти захворювання на лейкемію.
Резистентність до інсуліну
Оскільки соматропін може знижувати чутливість до інсуліну, під час лікування пацієнтів слід обстежувати щодо виявлення ознак непереносимості глюкози. Після початку терапії препаратами соматропіну пацієнтам із цукровим діабетом може потребуватися коригування дози інсуліну. Пацієнтам із цукровим діабетом або з випадками цукрового діабету у сім’ї, а також пацієнтам з непереносимістю глюкози препарат слід призначати з обережністю.
Ретинопатія
Розвиток стабільної фонової ретинопатії не є підставою для припинення замісної терапії із застосуванням соматропіну.
Функція щитовидної залози
Під час лікування гормоном росту підвищується рівень перетворення Т4 в Т3, що може призвести до маніфестації прихованої субклінічної форми гіпотиреозу. Таким чином, у всіх пацієнтів слід проводити моніторинг функції щитовидної залози до початку лікування і періодично надалі. Гіпотиреоз, що розвинувся при застосуванні препарату Сайзен®, потребує відповідного лікування. При призначенні соматропіну пацієнтам з гіпопітуїтаризмом (гіпоталамо-гіпофізарною недостатністю) проведення стандартної замісної терапії повинно ретельно контролюватися.
Д оброякісн а внутрішньочерепн а гіпертензі я
Для виключення діагнозу набряку диска зорового нерва слід провести офтальмоскопію перед початком лікування препаратом і повторно у разі розвитку клінічних симптомів, таких як тяжкий або періодичний головний біль, порушення зору, нудота та/або блювання, які дозволяють припустити наявність цього розладу. При підтвердженні набряку диска зорового нерва слід врахувати можливість діагнозу доброякісної внутрішньочерепної гіпертензії (або псевдопухлини мозку) і за необхідності припинити лікування препаратом Сайзен®. Лікування можна поновити із застосуванням нижчих доз препарату після зникнення симптомів доброякісної внутрішньочерепної гіпертензії, що швидко відбувається після припинення лікування.
Панкреатит
Слід враховувати ймовірність розвитку панкреатиту у пацієнтів, що застосовують соматропін, зокрема у дітей при появі абдомінального болю.
Антитіла
Як і для інших препаратів соматропіну, у невеликого відсотка пацієнтів можуть утворюватись антитіла до соматропіну. Зв’язуюча здатність цих антитіл низька, і вони не впливають на швидкість росту. При відсутності відповіді на лікування у будь-якого пацієнта слід провести тестування на наявність антитіл до соматропіну.
Епіфізеоліз голівки стегнової кістки
Епіфізеоліз голівки стегнової кістки часто пов’язаний з ендокринними розладами, такими як дефіцит гормону росту та гіпотиреоз, або зі стрімким ростом. У дітей, що лікуються гормоном росту, епіфізеоліз голівки стегнової кістки може бути спричинений або основними ендокринними розладами, або зростанням швидкості росту завдяки лікуванню. Стрімкий ріст може збільшувати ризик появи проблем із суглобами, оскільки стегновий суглоб знаходиться під особливим навантаженням під час препубертатного періоду стрімкого росту. Лікарі та батьки дітей, що лікуються препаратом Сайзен®, повинні уважно стежити за своєчасним виявленням у дітей кульгавості або скарг на біль у стегнах та колінах.
Пацієнти із затримкою росту, спричиненою хронічною нирковою недостатністю
Пацієнтів із затримкою росту, спричиненою хронічною нирковою недостатністю, слід періодично обстежувати щодо виявлення ознак прогресування ниркової остеодистрофії. У дітей з прогресуючою нирковою остеодистрофією може спостерігатись епіфізеоліз або аваскулярний некроз голівки стегнової кістки, хоча ще не з’ясовано, чи пов’язані ці проблеми із застосуванням гормону росту. У таких випадках до початку терапії слід провести рентгенологічне обстеження стегнового суглоба.
Дітям із хронічною нирковою недостатністю препарат призначають лише у тих випадках, коли до початку лікування ниркова функція знижена більше ніж на 50 % від норми. Для підтвердження порушень росту до початку терапії слід спостерігати за ростом пацієнта протягом року. Упродовж 1 року до початку лікування слід підібрати консервативне лікування ниркової недостатності (контроль ацидозу, гіперпаратиреозу та обмеження у харчуванні), яке надалі слід проводити під час лікування гормоном росту. Лікування препаратом слід припинити на час трансплантації нирки.
Низькорослі діти, що народились зі зростом, який не відповідає гестаційному віку (НГВ)
Для низькорослих дітей, що народились з НГВ, до початку лікування слід виключити інші медичні умови та методи лікування, які можуть пояснювати існуюче порушення росту.
У пацієнтів з НГВ рекомендується вимірювати натще рівні інсуліну та глюкози у крові до початку лікування та щорічно надалі. У пацієнтів з підвищеним ризиком розвитку цукрового діабету (наприклад, захворювання на діабет у сім’ї, ожиріння, підвищений індекс маси тіла, тяжка форма резистентності до інсуліну, акантокератодермія) слід проводити тестування пероральної переносимості глюкози. Гормон росту не слід призначати при явному цукровому діабеті.
У пацієнтів з НГВ рекомендується вимірювати рівень IGF-1 до початку лікування і надалі двічі на рік. Якщо при повторних вимірюваннях рівень IGF-1 перевищує +2 SD порівняно зі значеннями, що відповідають віку та стадії статевого дозрівання, слід провести регулювання дози препарату з урахуванням співвідношення IGF-І/ІGFBP-3.
Досвід лікування пацієнтів з НГВ, початок якого наближається до настання статевої зрілості, обмежений. Тому починати лікування незадовго до настання статевої зрілості не рекомендується. Досвід лікування пацієнтів з НГВ та синдромом Сильвера − Рассела обмежений.
Збільшення росту, одержане при лікуванні соматропіном низькорослих дітей з НГВ, може бути деякою мірою втрачено, якщо лікування було припинено до досягнення пацієнтом кінцевого росту.
Затримка рідини
У дорослих під час замісної терапії із застосуванням гормону росту слід очікувати розвитку явищ затримки рідини.
У випадку тривалого набряку або тяжкої парестезії слід зменшити дозування препарату для того, щоб попередити розвиток зап’ястного тунельного синдрому.
Пацієнти, що перебувають у гострому критичному стані
При лікуванні препаратом пацієнтів, що перебувають у гострому критичному стані, слід оцінити можливі переваги застосування гормону росту над потенційним ризиком.
Загальні рекомендації
Для запобігання розвитку ліпоатрофії кожного разу слід змінювати місце ін’єкції.
Дефіцит гормону росту у дорослих є довічним станом, який потребує відповідного лікування, однак досвід лікування пацієнтів віком понад 60 років та досвід тривалого застосування препарату обмежені.
Застосування у період вагітності або годування груддю.
Вагітність
Клінічні дані щодо застосування препарату у період вагітності відсутні. Тому препарати соматропіну не рекомендується застосовувати у період вагітності, а також у жінок репродуктивного віку, які не вживають належних заходів з контрацепції.
Годування груддю
Клінічних досліджень застосування соматропіну у жінок, що годують груддю, не проводилось. Невідомо, чи виділяється соматропін у грудне молоко людини. Тому жінкам, що годують груддю, препарати соматропіну слід призначати з обережністю.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.Препарати соматропіну не впливають на здатність пацієнта керувати автомобілем або працювати з механізмами.
Спосіб застосування та дози.
Препарат Сайзен® 8 мг клік.ізі призначений для багаторазового використання.
Дозування препарату Сайзен® слід підбирати індивідуально для кожного пацієнта, залежно від площі поверхні тіла або маси тіла.
Лікування дітей
Препарат Сайзен® рекомендується вводити перед сном у наступних дозах:
Затримка росту, спричинена недостатн істю секреці ї ендогенного гормону рост у
Підшкірно вводять по 0,7 - 1,0 мг/м2 площі поверхні тіла на добу або по 0,025-0,035 мг/кг маси тіла на добу.
Затримка росту у дівчаток, спричинена дис ге незією гонад (синдром Тернера)
Підшкірно вводять по 1,4 мг/м2 площі поверхні тіла на добу або по 0,045-0,050 мг/кг маси тіла на добу.
Проведення одночасної терапії із застосуванням неандрогенних анаболічних стероїдів у пацієнток із синдромом Тернера може призводити до посилення відповіді на введення гормону росту.
Затримка росту у дітей препубертатного віку, спричинена хронічною нирковою недостатністю
Підшкірно вводять по 1,4 мг/м2 площі поверхні тіла на добу, що приблизно становить 0,045-0,050 мг/кг маси тіла на добу.
Порушення росту у низькоросли х дітей, що народились з і з ростом, який не відповідає гестаційному віку (НГВ)
Рекомендується щоденно вводити по 0,035 мг/кг маси тіла (або по 1 мг/м2 площі поверхні тіла на добу, що становить 0,1 МО/кг/добу або 3 МО/м2/добу) підшкірно.
Тривалість лікування
Лікування слід припинити при досягненні пацієнтом росту, достатнього для дорослих, або при закритті епіфізарних зон росту.
Лікування порушень росту у низькорослих дітей, що народилися з НГВ, зазвичай рекомендується продовжувати до досягнення ними кінцевого росту. Лікування слід припинити після 1-го року лікування, якщо SDS швидкості росту менше +1. Лікування слід припинити при досягненні пацієнтом кінцевого росту (визначається за швидкістю росту < 2 см/рік). Потребується підтвердження необхідності лікування, якщо вік кісток відповідає віку > 14 років (дівчата) або > 16 років (хлопці), що відповідає закриттю епіфізарних зон росту.
Дефіцит гормону росту у дорослих
На початку терапії рекомендується підшкірно вводити низькі дози препарату, які становлять 0,15-0,3 мг соматропіну на добу. Дозу слід поступово регулювати та контролювати за рівнями IGF-1. Рекомендована остаточна доза гормону росту рідко перевищує 1,0 мг/добу. Загалом слід вводити найнижчі ефективні дози препарату. Для пацієнтів літнього віку або пацієнтів з надлишковою масою тіла може бути необхідним зменшення доз препарату.
Спосіб приготування розчину та в веде ння ін’єкцій
Препарат слід розчиняти бактеріостатичним розчинником, що додається до упаковки, використовуючи пристрій для розчинення «клік.ізі».
Розведений розчин призначений для підшкірного введення; він повинен бути прозорим і не містити частинок. Якщо розчин містить частинки, його не можна вводити. Розведений розчин має концентрацію 5,83 мг/мл та містить 8 мг соматропіну загалом.
Пацієнта слід детально проінструктувати щодо проведення процедури розчинення препарату.
Підготовчий етап
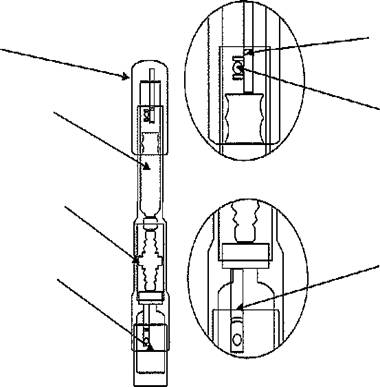
· Переконайтеся, що пристрій для розчинення «клік.ізі» має повну комплектацію, тобто наявні флакон із препаратом Сайзен® (а), стерильна перехідна канюля (b) та картридж із розчинником (с).
· Перевірте, що захисні «язички» на корпусі пристрою «клік.ізі» (d) та на ковпачку (е) не пошкоджені. Якщо будь-який з «язичків» пошкоджений, препарат не можна використовувати.
· На чисту поверхню покладіть усі предмети, необхідні для приготування розчину.
· Вимийте руки водою з милом.
Приготування розчину для ін’єкцій та наступне введення розчину препарату слід проводити відповідно до наступних інструкцій:
1. Помістіть пристрій для розчинення «клік.ізі» вертикально на рівну поверхню таким чином, щоб флакон знаходився знизу, а ковпачок (g) - зверху.
2. Натискайте на ковпачок рухом донизу доти, поки він не припинить рухатись далі. (примітка: зараз захисний «язичок» на корпусі пристрою «клік.ізі» зруйнований).
3. Злегка поверніть ковпачок за годинниковою стрілкою таким чином, щоб зелена позначка (f) була розташована у вертикальному отворі.
4. Для перенесення розчинника з картриджа у флакон продовжуйте дуже повільно натискати на ковпачок, поки він не припинить рухатись далі (примітка: зараз захисний «язичок» на ковпачку зруйнований). Для запобігання утворенню піни у флаконі важливо, щоб натискання було повільним. Перевірте, чи увесь розчинник перенесений до флакона.
5. Розчиніть порошок у розчиннику, обережно обертаючи пристрій «клік.ізі» (примітка: уникайте енергійного струшування для запобігання утворенню піни). Залишіть розчин на деякий час для повного розчинення порошку. Натискайте на ковпачок рухом донизу доти, поки він не припинить рухатись далі, та залишіть його в цьому положенні.
g. ковпачок c. картридж із розчинником b. стерильна перехідна канюля a. флакон із препаратом Сайзен® |
| e. захисний «язичок» f. зелена позначка d. захисний «язичок» |
6. Переверніть пристрій «клік.ізі» флаконом догори та повільно відтягуйте ковпачок донизу, поки розчин повністю не потрапить до картриджа.
7. Перевірте, що у флаконі залишилось не більше однієї або двох крапель розчину. Якщо у флаконі залишилось більше розчину, повільно натискайте на ковпачок, поки деяка частина розчину не потрапить назад до флакона, і обережно постукайте пальцем по пристрою «клік.ізі». Потім повільно втягніть розчин назад до картриджа.
8. Видаліть повітря, що потрапило до картриджа, повільно натискаючи на ковпачок. (Примітка: слід уникати занадто швидкого відтягування ковпачка, оскільки це призведе до потрапляння повітря до картриджа).
9. Утримуючи пристрій «клік.ізі» у цьому положенні (флакон зверху), відгвинтіть ковпачок та зніміть його. Утримуючи пристрій «клік.ізі» у такому ж положенні (флакон зверху), видаліть із пристрою «клік.ізі» картридж, який містить розведений розчин для ін’єкцій.
10. Обережно зніміть зовнішню етикетку за допомогою «язичка». На прозорій внутрішній етикетці картриджа запишіть дату розведення. Обережно позбавтеся використаного пристрою «клік.ізі».
Введення приготованого розчину проводять з використанням автоматичного інжектора Оne.clickтм чи Easypodтм, або безголкового автоматичного інжектора Сool.clickтм відповідно до інструкції з використання обраного автоматичного інжектора.
Інжектор Easypodтм призначений для використання насамперед дітьми, починаючи із 7-річного віку, і дорослими. Діти завжди повинні використовувати інжектор під наглядом дорослих.
Діти.
Препарат Сайзен® 8 мг клік.ізі застосовується в педіатричній практиці.
Передозування.
Перевищення рекомендованих доз може спричинити розвиток побічних ефектів. Передозування може призводити до розвитку гіпоглікемії з наступною гіперглікемією. Крім того, ймовірно, що передозування соматропіну може призвести до розвитку явищ затримки рідини.
Побічні реакції.
До 10 % пацієнтів можуть відчувати почервоніння та свербіж у місці ін’єкції.
При проведенні гормонозамісної терапії із застосуванням гормону росту у дорослих очікується розвиток явищ затримки рідини. Клінічно затримка рідини може проявлятися периферичним набряком, набряком суглобів, артралгією, міалгією та парестезією. Однак ці симптоми та ознаки зазвичай мають тимчасовий і дозозалежний характер.
При лікуванні дорослих пацієнтів з дефіцитом гормону росту, у яких цей діагноз був встановлений у дитинстві, повідомляється про меншу частоту розвитку побічних реакцій порівняно з тими, у кого дефіцит гормону росту почався у дорослому віці.
У невеликого відсотка пацієнтів можуть утворюватись антитіла до соматропіну. До цього часу повідомлялось про низьку зв’язуючу здатність таких антитіл, а їхнє утворення не призводило до послаблення росту, за винятком пацієнтів з делеціями генів. У вкрай поодиноких випадках, коли низькорослість пов’язана з делецією генного комплексу гормону росту, лікування соматропіном може індукувати розвиток антитіл, що послаблюють процес росту.
У невеликої кількості пацієнтів з дефіцитом гормону росту, частина з яких лікувалась соматропіном, була діагностована лейкемія. Проте немає жодних доказів того, що у пацієнтів, які не мають предиктивних факторів, лікування соматропіном призводить до зростання частоти захворювання на лейкемію.
Побічні реакції, про які повідомлялось у зв’язку із застосуванням препарату і які перелічені нижче, класифікуються за частотою таким чином: дуже поширені (³ 1/10), поширені (від ≥ 1/100 до < 1/10), непоширені (від ≥ 1/1000 до < 1/100), рідко поширені (від ≥ 1/10000 до < 1/1000), дуже рідко поширені (< 1/10 000), частота невідома (частота не може бути встановлена на підставі наявних даних).
Розлади нервов ої систем и
Поширені: головний біль (ізольований), зап’ястний тунельний синдром (у дорослих).
Непоширені :ідіопатична внутрішньочерепна гіпертензія (доброякісна внутрішньочерепна гіпертензія), зап’ястний тунельний синдром (у дітей).
М’язово-скелетні розлади та розлади з боку сполучної тканини
Дуже рідко поширені: епіфізеоліз голівки стегнової кістки або аваскулярний некроз голівки стегнової кістки.
Розлади імунної системи
Частота невідома: локалізовані або генералізовані реакції гіперчутливості.
Ендокринні розлади
Дуже рідко поширені : гіпотиреоз.
Розлади метаболізму та харчуванняПоширені (у дорослих)/непоширені (у дітей): затримка рідини, що проявляється як периферичний набряк, скутість суглобів, артралгія, міалгія, парестезія.
Частота невідома: резистентність до інсуліну, яка може призводити до гіперінсулінемії, у поодиноких випадках − до гіперглікемії.
Розлади з боку репродуктивної системи та молочних залоз
Непоширені: гінекомастія.
Загальні розлади та реакції у місці введення
Поширені:реакції у місці введення; локалізована ліпоатрофія, яку можна попередити, щоразу змінюючи ділянку для ін’єкції.
Шлунково-кишкові розлади
Частота невідома: панкреатит.
Несумісність.
Оскільки спеціальних досліджень сумісності не проводилось, препарат не можна змішувати з іншими лікарськими засобами.
Термін придатності 3 роки.
Не застосовувати після закінчення терміну придатності, зазначеного на упаковці.
Готовий розчин слід зберігати при температурі 2-8 ºC (у холодильнику) максимально впродовж 28 днів. Не заморожувати.
Умови зберігання.
Зберігати при температурі не вище 25 ºС в оригінальній упаковці.
Зберігати у недоступному для дітей місці.
Автоматичні інжектори Оne.clickтм або Easypodтм, які містять картридж із розведеним розчином препарату Сайзен®, слід зберігати при температурі 2-8 ºC (у холодильнику). При використанні безголкового автоматичного інжектора Сool.clickтм у холодильнику при температурі 2-8 ºC слід зберігати лише картридж із розведеним розчином препарату Сайзен®.
Упаковка.
- По 1 флакону з порошком для приготування розчину для ін’єкцій у комплекті з 1 картриджем з 1,37 мл бактеріостатичного розчинника для парентерального застосування (0,3 % (м./об.) розчин м-крезолу у воді для ін’єкцій), які попередньо зібрані в 1 пристрій для розчинення (клік.ізі), що складається з 1 корпусу пристрою та 1 стерильної перехідної канюлі, вміщують у картонну коробку.
- По 5 флаконів з порошком для приготування розчину для ін’єкцій у комплекті з 5 картриджами з 1,37 мл бактеріостатичного розчинника для парентерального застосування (0,3 % (м./об.) розчин м-крезолу у воді для ін’єкцій), які попередньо зібрані в 5 пристроїв для розчинення (клік.ізі), що складаються з 5 корпусів пристрою та 5 стерильних перехідних канюль, вміщують у картонну коробку.
Категорія відпуску. За рецептом.
Виробник.
Мерк Сероно С.п.А./Merck Serono S.p.A.
Місцезнаходження виробників та адреси місця провадження їх діяльності.
Віа делле Магноліє 15 (р-н Промислова Зона), 70026 Модуньо (Барі), Італія/
Via delle Magnolie 15 (loc. frazione Zona Industriale), 70026 Modugno (Bari), Italy.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО