ЕМЕНД®
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.
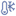 від 2 °С до 8 °С
від 2 °С до 8 °С
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ЕМЕНД®
( EMEND ® )
Склад:
діюча речовина: fosaprepitant;
1 флакон містить фосапрепітанту димеглюміну 245,3 мг, що еквівалентно 150 мг фосапрепітанту.
Після відновлення та розведення 1 мл розчину містить 1 мг фосапрепітанту (1 мг/мл);
допоміжні речовини: динатрію едетат, полісорбат-80, лактоза безводна, натрію гідроксид, кислота хлористоводнева концентрована, газ азот.
Лікарська форма Порошок для розчину для інфузій.
Основні фізико-хімічні властивості: біла або майже біла тверда речовина
Фармакотерапевтична група
Протиблювальні засоби та препарати, що усувають нудоту. Код АТС А04А D12.
Фармакологічні властивості
Фоcапрепітант – це проліки апрепітанту, які при внутрішньовенному введенні швидко перетворюються на апрепітант (див. розділ «Фармакокінетика»). Внесок фосапрепітанту у загальний протиблювальний ефект у повному обсязі не був визначений, але перехідний внесок під час початкової фази не може бути виключений. Апрепітант є селективним антагоністом рецепторів нейрокініну 1 (NK1) з високим ступенем спорідненості з речовиною Р людини. Фармакологічна дія фоcапрепітанту визначається апрепітантом.
Хіміотерапія з високим ступенем еметогенності
У ході рандомізованого паралельного подвійно-сліпого, активно-контрольованого дослідження було порівняно застосування фосапрепітанту (препарату Еменд® порошок для розчину для інфузій) у дозі 150 мг при участі 1147 пацієнтів із застосуванням апрепітанту (препарату Еменд® капсули) при участі 1175 пацієнтів, які отримували хіміотерапію з високим ступенем еметогенності, що включала цисплатин ≥70мг/м2. Схема лікування фосапрепітантом складалась із призначення фосапрепітанту в дозі 150 мг в день 1 в комбінації з ондансетроном − 32 мг внутрішньовенно в день 1, та дексаметазоном − в день 1 − 12 мг, в день 2 − 8 мг та в день 3 та день 4 − по 8 мг двічі на добу. Схема лікування апрепітантом складалась із призначення апрепітанту в дозі 125 мг в день 1 та 80 мг на добу в день 2 та день 3 в комбінації з ондансетроном − 32 мг внутрішньовенно в день 1, та дексаметазоном − в день 1 − 12 мг, та в день 2, день 3 та день 4 − по 8 мг на добу. Плацебо фосапрепітанту, апрепітанту та дексаметазону (ввечері у день 3 та у день 4) було застосовано для забезпечення засліплення (див. розділ «Спосіб застосування та дози»). Також ондансетрон внутрішньовенно у дозі 32 мг було застосовано у ході клінічного дослідження, яка вже не є рекомендованою дозою. Слід ознайомитися з інструкцією на вибраний 5-НТ3 антагоніст для отримання інформації про належне дозування препарату.
Ефективність встановлена за оцінкою наступного складеного показника: повна відповідь в обох фазах – як в загальній, так і в відстроченій, та відсутність блювання упродовж загальної фази. Застосування фосапрепітанту (препарату Еменд® порошок для розчину для інфузій) у разовій дозі 150 мг було не менш ефективним за триденне застосування апрепітанту (препарату Еменд® капсули).
Короткий виклад первинних та кінцевих точок дослідження зазначений у таблиці 1.
Таблиця 1.
Відсоток пацієнтів, які отримували хіміотерапію з високим ступенем еметогенності, та відповідали на лікування груп та фази – Цикл 1.
Кінцеві точки* | Схема лікування фосапрепітантом (1106 пацієнтів)** % | Схема лікування апрепітантом (1134 пацієнта)** % | Різниця (95 % інтервал довіри)† |
Повна відповідь†† | |||
Загалом§ | 71,9 | 72,3 | −0,4 (−4,1, 3,3) |
Відстрочена фаз১ | 74,3 | 74,2 | 0,1 (−3,5, 3,7) |
Відсутність блювання | |||
Загалом§ | 72,9 | 74,6 | −1,7 (−5,3, 2,0) |
* Первинні кінцеві точки виділені жирним шрифтом.
** Кількість пацієнтів, яких включено в первинний аналіз повної відповіді.
†Різниця та інтервал довіри були розраховані за допомогою методів Miettinen та Nurminen та відкориговані щодо статі.
†† Повна відповідь = відсутність блювання та застосування невідкладної терапії.
§ Загалом = від 0 до 120 годин після застосування хіміотерапії цисплатином.
§§Відстрочена фаза = від 25 до 120 годин після застосування хіміотерапії цисплатином.
Хіміотерапія з помірним ступенем еметогенності
У ході рандомізованого паралельного подвійно-сліпого, активно-контрольованого дослідження було порівняно застосування фосапрепітанту (препарату Еменд® порошок для розчину для інфузій) в дозі 150 мг у комбінації з ондансетроном і дексаметазоном при участі 502 дорослих пацієнтів із застосуванням тільки ондансетрону і дексаметазону при участі 498 дорослих пацієнтів (контрольна група), які отримували хіміотерапію з помірним ступенем еметогенності. Схема лікування фосапрепітантом складалась із призначення фосапрепітанту в дозі 150 мг в День 1 у комбінації з ондансетроном перорально 8 мг для 2 доз, та дексаметазоном перорально 12 мг.
У День 2 та в День 3 пацієнти групи фосапрепітанту отримували плацебо ондансетрону кожні 12 годин. Режим контрольної групи складався з застосування плацебо фосапрепітанту 150 мг внутрішньовенно в День 1, в комбінації з ондансетроном перорально 8 мг для 2 доз, та дексаметазоном перорально 20 мг. У День 2 та День 3 пацієнти контрольної групи отримували 8 мг ондансетрону перорально кожні 12 годин. Плацебо фосапрепітанту та плацебо дексаметазону (в День 1) було застосовано для забезпечення засліплення.
Ефективність фосапрепітанту оцінювалась на підставі первинних і вторинних кінцевих точок, які зазначено в Таблиці 2, таким чином було показано перевагу над режимом контрольної групи щодо повної відповіді у відстроченій фазі та загалом.
Таблиця 2.
Відсоток пацієнтів, які отримували хіміотерапію з помірним ступенем еметогенності, та відповідали на лікування груп та фази
Кінцеві точки* | Схема лікування фосапрепітантом (502 пацієнтів)** % | Схема лікування апрепітантом (498 пацієнта)** % | Значення імовірності |
Повна відповідь† | |||
Відстрочена фаза†† | 78,9 | 68,5 | <0,001 |
Повна відповідь† | |||
Загалом§ | 77,1 | 66,9 | <0,001 |
Гостра фаз১ | 93,2 | 91 | 0,184 |
* Первинні кінцеві точки виділені жирним шрифтом.
** Кількість пацієнтів, яких включено в наміри щодо терапії популяції.
†Повна відповідь = відсутність блювання та застосування невідкладної терапії.
†† Відстрочена фаза = від 25 до 120 годин після застосування хіміотерапії.
§ Загалом = від 0 до 120 годин після застосування хіміотерапії.
§§Гостра фаза = від 0 до 24 годин після застосування хіміотерапії.
Приблизний час до першого блювання зображено на графіку Каплана-Мейера на Малюнку 1.
Малюнок 1. Відсоток пацієнтів, які отримували хіміотерапію з помірним ступенем еметогенності, та в них не було відзначено блювання протягом тривалого часу.
![]()
Час (години) з моменту першого застосування фосапрепітанту |
група, в якій застосовували фосапрепітант (N=502) контрольна група (N=498) |

Діти
Дослідження щодо оцінки застосування фосапрепітанту у педіатричних пацієнтів тривають (див. розділ «Спосіб застосування та дози»).
Фосапрепітант як проліки апрепітанту, при введенні внутрішньовенно, швидко перетворюється на апрепітант. Плазмові концентрації фосапрепітанту знаходяться нижче рівнів, що піддаються кількісному визначенню, протягом 30 хвилин після завершення інфузії.
Апрепітант після введення фосапрепітанту
Після одноразового інфузійного введення фосапрепітанту 150 мг протягом 20 хвилин здоровим добровольцям середня AUC0-∞ апрепітанту становила 35,0 мкг•год/мл, а середня максимальна концентрація апрепітанту − 4,01 мкг/мл.
Розподіл
Апрепітант активно зв’язується з білками плазми, в середньому на 97 %. Геометричний середній об'єм розподілу апрепітанту у рівноважному стані (Vdss) оцінювався за одноразовою дозою 150 мг фосапрепітанту і приблизно становив 82 л у людини.
Біотрансформація
Фосапрепітант швидко перетворюється на апрепітант при інкубаціїin vitro з препаратами печінки людини. Більше того, фосапрепітант піддається швидкому та майже повному перетворенню на апрепітант у препараті S9 з інших тканин людини, включаючи нирки, легені та клубову кишку. Таким чином, перетворення фосапрепітанту на апрепітант може відбуватися в різних тканинах. У людини фосапрепітант, введений внутрішньовенно, швидко перетворювався на апрепітант протягом 30 хвилин після закінчення інфузії. Апрепітант піддається екстенсивному метаболізму. Після одноразової дози 100 мг міченого [14C]-фосапрепітанту (як проліків апрепітанту), введеної внутрішньовенно, у здорової молодої людини апрепітант становить приблизно 19 % радіоактивності у плазмі крові протягом 72 годин, демонструючи значну присутність метаболітів у плазмі. У плазмі крові людини було виявлено дванадцять метаболітів апрепітанту. Метаболізм апрепітанту відбувається значною мірою шляхом окиснення у морфоліновому кільці та його бокових ланцюгах, утворені метаболіти мають слабку активність. Дослідження in vitro з використанням мікросом печінки людини показали, що апрепітант первинно метаболізується за допомогою CYP3A4 та потенційно з невеликою участю CYP1A2 і CYP2C19. Усі метаболіти, які виявляли в сечі, калі та плазмі після внутрішньовенної дози 100 мг [14C]-фосапрепітанту, виявлялися і після пероральної дози [14C]-апрепітанту. При перетворенні 245,3 мг фосапрепітанту димеглуміну (еквівалентних 150 мг фосапрепітанту) на апрепітант вивільнюється 23,9 мг фосфорної кислоти та 95,3 мг меглуміну.
Елімінація
Апрепітант не виводиться незмінним із сечею. Метаболіти виводяться з сечею та шляхом екскреції жовчі з калом. Після внутрішньовенного введення одноразової дози 100 мг [14C]-фосапрепітанту здоровим особам 57 % радіоактивності виводилося з сечею і 45 % з калом.
Фармакокінетика апрепітанту у діапазоні клінічних доз нелінійна. Період напіввиведення апрепітанту після внутрішньовенної дози фосапрепітанту 150 мг − приблизно 11 годин. Середній геометричний плазмовий кліренс апрепітанту після внутрішньовенної дози фосапрепітанту 150 мг становить близько 73 мл/хв.
Порушення функції печінки
Фосапрепітант метаболізується у різних позапечінкових тканинах, тому печінкова недостатність не змінює перетворення фосапрепітанту на апрепітант. Порушення функції печінки легкого ступеня (клас А за шкалою Чайлда-П’ю) не проявляє клінічно значущого впливу на фармакокінетику апрепітанту. У пацієнтів з незначним порушенням функції печінки коригувати дозу не потрібно. Немає достовірних даних щодо впливу порушення функції печінки середнього ступеня (клас В за шкалою Чайлда-П’ю) на фармакокінетику апрепітанту. Немає клінічних або фармакокінетичних даних відносно пацієнтів з порушенням функції печінки тяжкого ступеня (клас С за шкалою Чайлда-П’ю).
Ниркова недостатність
Разова доза 240 мг апрепітанту перорально призначалася пацієнтам з тяжкою нирковою недостатністю (кліренс креатиніну <30 мл/хв) і пацієнтам з термінальною фазою захворювання нирок (ESRD), які потребують гемодіалізу.
У пацієнтів з тяжкою нирковою недостатністю AUС0-¥ загальної кількості апрепітанту (не зв’язаного і зв’язаного з білками) зменшувалася на 21 %, а Сmax зменшувалася на 32 %, порівняно з показниками здорових добровольців. У пацієнтів з нирковим захворюванням останньої стадії (ESRD), які перебувають на гемодіалізі, AUС0-¥ загальної кількості апрепітанту зменшувалася на 42 %, а Сmax − на 32 %. Через незначне зв’язування апрепітанту з білками плазми у пацієнтів із захворюванням нирок AUС фармакологічно активного незв’язаного препарату не зазнавала значного впливу у пацієнтів з нирковою недостатністю порівняно з такою у здорових добровольців. Гемодіаліз, який проводився через 4 або 48 годин після прийому дози, значною мірою не впливав на фармакокінетику апрепітанту; менше 0,2 % дози було виявлено в діалізаті.
Змінювати режим дозування фосапрепітанту для пацієнтів з нирковою недостатністю та пацієнтів з нирковим захворюванням останньої стадії (ESRD), які перебувають на гемодіалізі, немає необхідності.
Взаємозв'язок між концентрацією та ефектом.
У ході дослідження з використанням позитронно-емісійної томографії (ПЕТ), де зображення отримували за допомогою високо-специфічного індикатора NK1-рецепторів, у здорових молодих чоловіків після введення одноразової внутрішньовенної дози 150 мг фосапрепітанту (N = 8) продемонстровано зв`язування з NK1-рецепторами мозку ≥100 % у Tmax та впродовж 24 годин, ≥97 % впродовж 48 годин, та в межах 41 %-75 % упродовж 120 годин після введення дози. Зв`язування з NK1-рецепторами мозку, вивчене в цьому дослідженні, добре корелює з концентрацією апрепітанту у плазмі крові.
Клінічні характеристики
Показання.
У складі комбінованої терапії:
- профілактика гострої та відстроченої нудоти та блювання, пов’язаних з проведенням протиракової хіміотерапії на основі цисплатину з високим еметогенним ризиком;
- профілактика нудоти та блювання, пов’язаних із застосуванням протиракової хіміотерапії з помірним еметогенним ризиком.
Протипоказання.
Гіперчутливість до активної речовини або полісорбату-80, або до будь-якої допоміжної речовини, що входить до складу препарату.
Одночасне застосування з пімозидом, терфенадином, астемізолом або цизапридом (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
При внутрішньовенному введенні фосапрепітант швидко перетворюється на апрепітант.
При внутрішньовенному введенні фосапрепітанту може виникнути взаємодія з препаратами, що містять активні речовини, які взаємодіють з пероральним апрепітантом. Наступну інформацію отримано з досліджень, проведених з пероральним застосуванням апрепітанту, та досліджень, проведених з внутрішньовенним застосуванням фосапрепітанту, який вводився з дексаметазоном, мідазоламом або дилтіаземом.
Фосапрепітант 150 мг, введений в одноразовій дозі, є слабким інгібітором CYP3A4. Вважається, що фосапрепітант не взаємодіє з таким транспортером як Р-глікопротеїн, що було продемонстровано відсутністю взаємодії перорального апрепітанту з дигоксином. Очікується, що фосапрепітант спричинить меншу або не більшу індукцію CYP2C9 і CYP3A4 та глюкуронідацію, ніж апрепітант перорального введення. Дані про вплив на ізоферменти CYP2C8 та CYP2C19 відсутні.
Вплив фосапрепітанту на фармакокінетику інших активних речовин.
Пригнічення активності CYP 3 A 4
Як помірний інгібітор CYP3A4 фосапрепітант (150 мг) в одноразовій дозі при супутньому застосуванні може тимчасово підвищувати плазмові концентрації активних речовин, які метаболізуються через CYP3A4. Загальна експозиція субстратів CYP3A4, що приймаються перорально, може підвищуватися приблизно вдвічі у 1-й та 2-й дні після одночасного введення з разовою дозою 150 мг фосапрепітанту. Фосапрепітант не слід приймати одночасно з пімозидом, терфенадином, астемізолом або цизапридом. Пригнічення активності CYP3A4 фосапрепітантом може призводити до підвищення плазмових концентрацій цих активних речовин, потенційно спричиняючи розвиток побічних реакцій, що загрожують життю (див. розділ «Протипоказання»). Рекомендовано з обережністю приймати фосапрепітант одночасно з активними речовинами, які метаболізуються більшою мірою через CYP3A4 та мають вузький терапевтичний діапазон: циклоспорин, такролімус, сиролімус, еверолімус, алфентаніл, діерготамін, ерготамін, фентаніл та хінідин (див. розділ «Особливості застосування»).
Кортикостероїди
Дексаметазон. При сумісному застосуванні з разовою дозою 150 мг фосапрепітанту у 1-й день пероральну дозу дексаметазону у 1-й та 2-й слід зменшити приблизно на 50 % для досягнення експозиції дексаметазону, подібної до експозиції, отриманої при введенні без фосапрепітанту 150 мг.
Фосапрепітант 150 мг, введений одноразово внутрішньовенно у 1-й день, підвищував площу під кривою «концентрація − час» (AUC 0-24 год) дексаметазону, субстрату CYP3A4, на 100 % у 1-й день, на 86 % на 2-й день та на 18 % на 3-й день при одночасному введенні дексаметазону в одноразовій дозі 8 мг перорально у 1-й, 2-й та 3-й день.
Хіміотерапевтичні препарати
Дослідження взаємодії фосапрепітанту 150 мг та хіміотерапевтичних препаратів не проводили, однак на підставі досліджень апрепітанту для перорального застосування, доцетакселу та вінорелбіну не очікується, що Еменд® (фосапрепітант) 150 мг буде мати клінічно значущу взаємодію з доцетакселом та вінорелбіном, які вводили внутрішньовенно. Взаємодію фосапрепітанту з хіміотерапевтичними препаратами, які вводяться пероральним шляхом та метаболізуються в основному або частково CYP3A4 (наприклад етопозид, вінорелбін), не можна виключати. Пацієнтам, які приймають препарати, що метаболізуються головним чином або частково CYP3A4, рекомендовано бути обережними та проводити додатковий моніторинг (див. розділ «Особливості застосування»). Повідомлялося про випадки нейротоксичності у пост-маркетинговому періоді, що пов’язують з потенціальною побічною дією іфосфаміду після його сумісного застосування с апрепітантом.
Імуносупресанти
Після одноразової дози фосапрепітанту 150 мг очікується тимчасове (на два дні) підвищення, за яким настає легке зниження експозиції імуносупресантів, які метаболізуються CYP3A4 (наприклад циклоспорин, такролімус, еверолімус та сіролімус). Базуючись на принципах Моніторингу Терапевтичних Доз, враховуючи коротку тривалість курсу та обмежені експозиції, знижувати дозу імуносупресантів не рекомендується в день застосування, та в наступний день після застосування препарату Еменд® (фосапрепітанту).
Мідазолам
Фосапрепітант 150 мг, що вводився одноразово у 1-й день, підвищив AUC мідазоламу на 77 % у 1-й день і не мав впливу на цей показник на 4-й день, коли мідазолам одночасно вводили перорально у дозі 2 мг у 1-й та 4-й день. Фосапрепітант 150 мг є слабким інгібітором CYP3A4, оскільки одноразова доза, введена в 1-й день, не показала інгібування або індукції CYP3A4 на 4-й день.
Слід враховувати потенційні ефекти підвищених плазмових концентрацій мідазоламу або інших бензодіазепінів, які метаболізуються CYP3A4 (алпразолам, тріазолам), при сумісному прийомі цих препаратів з препаратом Еменд® (фосапрепітант).
Дилтіазем
Дослідження взаємодії фосапрепітанту 150 мг та дилтіазему не проводили. Однак потрібно брати до уваги результати дослідження застосування фосапрепітанту 100 мг при застосування препарату Еменд® (фосапрепітант) 150 мг із дилтіаземом. У пацієнтів з легкою та помірною гіпертензією, інфузія фосапрепітанту у дозі 100 мг протягом 15 хвилин сумісно з дилтіаземом у дозі 120 мг 3 рази на добу підвищує AUC дилтіазему в 1,5 4 разарази та зменшує кров’яний тиск дуже помірно, але клінічно значуще, та клінічно значуще не впливає на серцевий ритм, або PR-інтервал.
Індукція
Згідно з результатами дослідження взаємодії з мідазоламом, фосапрепітант 150 мг, що вводиться одноразово, не спричиняє індукції CYP3A4 у 1-й та 4-й день.
Очікується, що фосапрепітант спричинить меншу або не більшу індукцію CYP2C9 і CYP3A4 та глюкуронізацію, ніж спричиняє триденне застосування апрепітанту перорально, при якому спостерігається короткочасна індукція з максимальним ефектом на 6-8-й день після першої дози апрепітанту. Триденний режим перорального застосування апрепітанту показує зменшення AUC субстратів CYP2C9 приблизно на 30-35 % і знижує залишкові концентрації етинілестрадіолу до 64 %. Інформації відносно впливу на CYP2С8 та CYP2С19 немає. Рекомендовано з обережністю застосовувати сумісно з препаратом Еменд® (фосапрепітант) в даний період часу варфарин, аценокумарол, толбутамід, фенітоїн або інші активні речовини, про які відомо, що вони метаболізуються CYP2С9.
Варфарин
У пацієнтів, які отримують тривалу терапію варфарином, під час лікування препаратом Еменд® (фосапрепітант) та впродовж 2 тижнів після застосування фосапрепітанту, який застосовується для профілактики нудоти та блювання, спричинених хіміотерапією, слід проводити пильний моніторинг протромбінового часу (див. розділ «Особливості застосування»).
Гормональні контрацептиви
Під час та протягом 28 днів після застосування препарату фосапрепітанту ефективність гормональних контрацептивів може знижуватися. Під час лікування фосапрепітантом та впродовж 2 місяців після останньої дози фосапрепітанту слід застосовувати альтернативні негормональні методи контрацепції.
Антагоністи 5-НТ3
Дослідження взаємодії фосапрепітанту 150 мг та антагоністів 5-HT3 не проводили. Однак у клінічних дослідженнях апрепітант, що застосовувався перорально, не проявляв клінічно значущого впливу на фармакокінетику ондансетрону, гранісетрону або гідродоласетрону (активний метаболіт доласетрону). Таким чином, немає доказів взаємодії застосування препарату Еменд® (фосапрепітант) та антагоністів 5-HT3.
Вплив інших препаратів на фармакокінетику апрепітанту в результаті застосування фосапрепітанту 150 мг.
Слід з обережністю застосовувати фосапрепітант паралельно з активними речовинами, які пригнічують активність CYP3A4 (наприклад, кетоконазол, ітраконазол, вориконазол, позаконазол, кларитроміцин, телітроміцин, нефазодон та інгібітори протеаз), оскільки очікується, що така комбінація призводить до підвищення плазмових концентрацій апрепітанту в кілька разів (див. розділ «Особливості застосування»). Кетоконазол збільшує період напіввиведення перорального апрепітанту приблизно в 3 рази.
Слід уникати супутнього застосування фосапрепітанту з активними речовинами, які інтенсивно індукують активність CYP3A4 (наприклад, рифампіцин, фенітоїн, карбамазепін, фенобарбітал), оскільки така комбінація призводить до зниження плазмових концентрацій апрепітанту, що може спричиняти зниження ефективності. Сумісне застосування фосапрепітанту з рослинними препаратами, що містять звіробій (Hypericum perforatum), не рекомендоване. Рифампіцин знижує середній кінцевий період напіввиведення апрепітанту на 68 %.
Дилтіазем.
Дослідження взаємодії з фосапрепiтантом 150 мг та дилтіаземом не проводились; однак, при застосуванні препарату Еменд® (фосапрепiтант) 150 мг з дилтиаземом слід враховувати наступне дослідження з 100 мг фосапрепiтанту. Інфузія 100 мг фосапрепітанту протягом 15 хвилин з дилтіаземом по 120 мг 3 рази на добу призвела до збільшення AUC апрепітанта в 1,5 рази. Цей ефект не вважався клінічно значущим.
Особливості застосування.
Пацієнти з помірним та тяжким порушенням функції печінки
Інформація щодо застосування препарату пацієнтам з помірним порушенням функції печінки обмежена, інформація стосовно застосування пацієнтам з порушенням функції печінки тяжкого ступеня відсутня. Тому цим пацієнтам слід з обережністю застосовувати препарат Еменд® (фосапрепітант) (див. розділ «Фармакокінетика»).
Взаємодії зCYP3A4
Препарат Еменд® (фосапрепітант) слід з обережністю застосовувати пацієнтам, які одночасно приймають лікарські засоби, що перш за все метаболізуються системою CYP3A4 та мають вузький терапевтичний діапазон, такі як циклоспорин, такролімус, сиролімус, еверолімус, алфентаніл, похідні алкалоїдів ріжків, фентаніл та хінідин (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»). Крім того, сумісне застосування с іринотеканом потребує особливої обережності, оскільки така комбінація може підвищити токсичність.
Одночасне застосування з варфарином (субстрат CYP 2 C 9)
У пацієнтів, які отримують постійну терапію варфарином, слід проводити ретельний моніторинг міжнародного нормалізованого відношення (МНВ) протягом 14 днів після курсу терапії фосапрепітантом (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Сумісне застосування з гормональними контрацептивами
Під час застосування та протягом 28 днів після закінчення застосування фосапрепітанту ефективність гормональних контрацептивів може знижуватися. Під час лікування фосапрепітантом та впродовж 2 місяців після останньої дози фосапрепітанту слід застосовувати альтернативні негормональні методи контрацепції (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»)
Реакції підвищеної чутливості
Під час або невдовзі після інфузії фосапрепітанту мали місце випадки негайної реакції підвищеної чутливості, включаючи припливи, еритему, задишку та анафілаксію/анафілактичний шок. Такі реакції підвищеної чутливості зазвичай з’являлися при припиненні інфузії та застосуванні відповідної терапії. Не рекомендується повторно розпочинати інфузію пацієнтам, у яких з’являються реакції підвищеної чутливості.
Місцеві реакції на введення та інфузію (МРВІ)
Еменд® (фосапрепітант) не слід вводити ударною дозою, його обов'язково необхідно розводити та застосовувати шляхом повільної внутрішньовенної інфузії (див. розділ «Спосіб застосування та дози»). Еменд® (фосапрепітант) не вводити внутрішньом'язово або підшкірно.
Про виникнення місцевих реакцій на введення та інфузію (МРВІ) повідомлялося при застосуванні препарату Еменд® (фосапрепітант) (див. розділ «Побічні реакції»). Про більшість тяжких МРВІ, включаючи тромбофлебіт та васкуліт, повідомлялося при застосуванні супутньої хіміотерапії, що призвела до наривів шкіри (наприклад на основі антрацикліну), особливо у випадках, коли це було пов'язано з екстравазацією. Про некроз також повідомлялося у деяких пацієнтів з супутньою хіміотерапією, що призвела до наривів шкіри.
Пацієнтам рекомендовано звертатися по медичну допомогу, якщо у них з'являються нові або погіршуються наявні ознаки або симптоми МРВІ, такі як еритема, набряк, біль, некроз, васкуліт або тромбофлебіт в місці введення або поблизу нього.
Застосування у період вагітності або годування груддю.
Контрацепція у чоловіків та жінок.Ефективність гормональних контрацептивів може знижуватися під час та протягом 28 днів після застосування фосапрепітанту. Під час лікування фосапрепітантом та впродовж 2 місяців після останньої дози фосапрепітанту слід застосовувати альтернативні негормональні методи контрацепції (див. розділи «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Вагітність.Немає клінічних даних про застосування фосапрепітанту та апрепітанту у період вагітності. Можливість репродуктивної токсичності фосапрепітанту та апрепітанту повністю не встановлена, оскільки рівні експозиції, що перевищують терапевтичну експозицію у людини, не можуть бути досягнуті в дослідженнях на тваринах. Ці дослідження не показали прямого або непрямого шкідливого впливу на перебіг вагітності, розвиток ембріона/плода, пологи або постнатальний розвиток. Потенційний вплив нейрокінінової регуляції на репродуктивну функцію невідомий. Препарат Еменд® (фосапрепітант) не слід застосовувати у період вагітності, окрім випадків нагальної потреби.
Годування груддю.Апрепітант проникає у молоко лактуючих щурів після внутрішньовенного застосування фосапрепітанту так само, як і при застосуванні апрепітанту внутрішньо. Невідомо, чи проникає препарат у грудне молоко у жінок, тому протягом лікування препаратом Еменд® (фосапрепітант) годування груддю не рекомендоване.
Фертильність.Можливість впливу фосапрепітанту та апрепітанту на фертильність повністю не вивчена, оскільки рівні експозиції, що перевищують терапевтичну експозицію у людини, не можуть бути досягнуті у дослідженнях на тваринах. Дослідження фертильності на тваринах не продемонстрували прямого або непрямого несприятливого впливу на спаровування, фертильність, розвиток ембріона/плода, а також на кількість сперми і її рухливість.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Препарат Еменд® (фосапрепітант) може незначним чином впливати на здатність керувати автотранспортом і працювати з механізмами. Після застосування препарату Еменд® (фосапрепітант) можуть виникати запаморочення і втома (див. розділ «Побічні реакції»).
Спосіб застосування та дози.
Препарат Еменд® (фосапрепітант) вводити внутрішньовенно і не можна вводити внутрішньом'язово або підшкірно. Фосапрепітант 150 мг вводити шляхом інфузії протягом 20-30 хвилинтільки у перший день, починаючи приблизно за 30 хвилин до хіміотерапії. Не вводити препарат Еменд® (фосапрепітант) ударною дозою або у вигляді нерозведеного розчину.
Препарат Еменд® (фосапрепітант) застосовувати як частину схеми, що включає кортикостероїд і антагоніст 5-НТ3 відповідно до даних наведених у таблиці нижче.
Для запобігання нудоті та блюванню, що пов'язані з еметогенною протипухлинною хіміотерапією, рекомендується наступний режим дозування:
Курс для хіміотерапії з високим еметогенним ризиком
День 1 | День 2 | День 3 | День 4 | |
Препарат Еменд® (фосапрепітант) | 150 мг внутрішньовенно | Немає | Немає | Немає |
Дексаметазон | 12 мг перорально | 8 мг перорально | 8 мг перорально двічі на добу | 8 мг перорально двічі на добу |
Антагоніст 5-НТ3 | Стандартна доза антагоніста 5-НТ3. Див. інструкцію на препарат щодо дозування обраного антагоніста 5-НТ3 | Немає | Немає | Немає |
Дексаметазонпризначається за 30 хвилин до проведення хіміотерапії у перший день та вранці на 2-й, 3-й та 4-й день. Дексаметазон необхідно також вводити увечері на 3-й та 4-й день. Дозу дексаметазону визначати з урахуванням взаємодії активних речовин.
Курс для хіміотерапії з помірним еметогенним ризиком
1-й день | |
Препарат Еменд® (фосапрепітант) | 150 мг внутрішньовенно |
Дексаметазон | 12 мг перорально |
Антагоніст 5-НТ3 | Стандартна доза антагоніста 5-НТ3. Див. інструкцію на препарат щодо дозування обраного антагоніста 5-НТ3 |
Дексаметазон призначати за 30 хвилин до хіміотерапії в 1-й день. Доза дексаметазону була обрана, враховуючи взаємодію препаратів.
Інформація щодо ефективності комбінації з іншими кортикостероїдами та антагоністами 5-НТ3 дуже обмежена (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Щодо комбінованого застосування з антагоністами 5-НТ3 слід звернутися до Інструкцій з медичного застосування цих препаратів.
Перед введенням препарату Еменд® порошок для приготування розчину для інфузій необхідно відновити і розвести.
Спосіб приготування розчину для внутрішньовенного введення:
1. Ввести 5 мл фізіологічного розчину 9 мг/мл (0,9 %) для ін'єкцій у флакон. Доливати фізіологічний розчин 9 мг/мл (0,9 %) для ін’єкцій у флакон вздовж його стінки, щоб не було спінювання. Обережно обертати флакон навколо своєї осі. Уникати струшування та вприскування фізіологічного розчину 9 мг/мл (0,9 %) для ін’єкцій у флакон.
2. Підготувати інфузійний мішок/флакон, заповнений145 млфізіологічного розчину9 мг/мл (0,9 %) для ін’єкцій (наприклад, видаліть 105 мл фізіологічного розчину 9 мг/мл (0,9 %) для ін’єкцій з інфузійного мішка/флакона з фізіологічним розчином 9 мг/мл (0,9 %) для ін’єкцій об’ємом 250 мл).
3. Вилучити весь об’єм з флакона та ввести в інфузійний мішок, що містить 145 мл фізіологічного розчину 9 мг/мл (0,9 %) для ін’єкцій, щоб отримати загальний об’єм 150 мл. Обережно перевернути мішок/флакон 2-3 рази.
Лікарський засіб не можна розводити або змішувати з розчинами, для яких фізична та хімічна сумісність не встановлена.
Відновлений розчин має такий самий вигляд, як і розчин для розведення.
Відновлений та розбавлений препарат перед введенням необхідно візуально перевірити на наявність твердих часток та зміни кольору.
Немає спеціальних вимог щодо утилізації препарату.
Стать
Коригування дози залежно від статі не потрібно.
Пацієнти літнього віку (≥ 65 років).
Для осіб літнього віку коригування дози не потрібно.
Пацієнти із порушенням функції нирок
Для хворих з нирковою недостатністю або для пацієнтів з термінальною фазою захворювання нирок, які перебувають на гемодіалізі, корекція дози не потрібна.
Пацієнти із порушенням функції печінки
Для пацієнтів з порушенням функції печінки легкого ступеня корекція дози не потрібна. Кількість інформації відносно застосування у пацієнтів з помірним порушенням функції печінки обмежена, та інформація стосовно застосування у пацієнтів з порушенням функції печінки тяжкого ступеня відсутня. Таким пацієнтам препарат Еменд® (фосапрепітант) потрібно застосовувати з обережністю (див. розділи «Особливості застосування» та «Фармакокінетика»).
Діти.
Безпека та ефективність застосування препарату Еменд® (фосапрепітант) для лікування дітей віком до 18 років не встановлені. Існуючі на цей час дані не дозволяють зробити рекомендації щодо застосування.
Передозування.
У разі передозування слід припинити застосування фосапрепітанту і призначити загальну підтримуючу терапію, а також здійснювати моніторинг. Через протиблювальну активність апрепітанту препарати, що спричиняють блювання, будуть неефективними. Апрепітант не може бути видалений шляхом гемодіалізу.
Побічні реакції.
У ході клінічних досліджень різні лікарські форми фосапрепітанту застосовували загалом 2687 пацієнтам, включаючи 371 здорового пацієнта та 2084 пацієнтів, які проходили хіміотерапію, з ризиком виникнення нудоти та блювання.
Оскільки фосапрепітант перетворюється на апрепітант, побічні реакції, пов’язані з апрепітантом, можуть виникнути і з фосапрепітантом.
Профіль безпеки для апрепітанту оцінювали приблизно у 6500 пацієнтів.
Апрепітант, що застосовували перорально
Під час проведення хіміотерапії з високим ризиком еметогенності (ВРЕ), у пацієнтів, які лікувалися апрепітантом, частіше, ніж у пацієнтів, які отримували стандартну терапію, виникали такі побічні реакції: гикавка (4,6 % порівняно з 2,9 %), підвищення рівня аланінамінотрансферази (2,8 % порівняно з 1,1 %), диспепсія (2,6 % порівняно з 2,0 %), запор (2,4 % порівняно з 2,0 %), головний біль (2,0% порівняно з 1,8 %), зниження апетиту (2,0 % порівняно з 0,5 %). При проведенні хіміотерапії з помірним ризиком еметогенності (ПРЕ) при застосуванні апрепітанту порівняно зі стандартною терапією найчастіше виникала втома (1,4 % порівняно з 0,9 %).
Нижчезазначені побічні реакції відзначалися в об'єднаному аналізі досліджень хіміотерапії з ВРЕ або ПРЕ з більшою частотою у пацієнтів, які отримували апрепітант, ніж у тих, хто отримував стандартне лікування, а також у ході постмаркетингового застосування.
Частота визначена як: дуже часто (≥ 1/10); часто (від ≥ 1/100 до < 1/10); нечасто (від ≥ 1/1000 до < 1/100); рідко (від ≥ 1/10000 до < 1/1000); дуже рідко (< 1/10000); невідомо (частоту неможливо визначити, виходячи з наявних даних).
Система органів | Побічна реакція | Частота |
Інфекції та інвазії | Кандидоз, стафілококова інфекція | Рідко |
З боку системи крові та лімфатичної системи | Фебрильна нейтропенія, анемія | Нечасті |
З боку імунної системи | Реакції підвищеної чутливості, включаючи анафілактичні реакції | Невідомо |
Порушення обміну речовин, метаболізму | Анорексія | Часто |
Полідипсія | Рідко | |
Психічні розлади | Занепокоєння | Нечасто |
Дезорієнтація, ейфорія | Рідко | |
З боку нервової системи | Головний біль | Часто |
Запаморочення, сонливість | Нечасто | |
Когнітивні порушення, летаргія, спотворення смаку | Рідко | |
З боку органів зору | Кон’юнктивіт | Рідко |
З боку органів слуху та вестибулярного апарату | Шум у вухах | Рідко |
З боку серцево-судинної системи | Відчуття серцебиття, припливи | Нечасто |
Брадикардія, кардіоваскулярні розлади | Рідко | |
З боку респіраторної системи, органів грудної клітки та середостіння | Гикавка | Часто |
Біль у ротоглотці, чхання, кашель, постназальний затік, подразнення горла | Рідко | |
З боку травної системи | Запор, диспепсія | Часто |
Відрижка, нудота*, блювання*, гастроезофагеальна рефлюксна хвороба, біль у животі, сухість у роті, метеоризм | Нечасто | |
Перфорація дуоденальної виразки, стоматит, здуття живота, твердий кал, нейтропенічний коліт | Рідко | |
З боку шкіри та підшкірної клітковини | Висип, акне | Нечасто |
Світлочутливість, гіпергідроз, себорея, пошкодження шкіри, сверблячі висипання, синдром Стівенса-Джонсона/токсичний епідермальний некроліз | Рідко | |
Свербіж, кропив’янка | Невідомо | |
З боку опорно-рухової системи та сполучної тканини | М’язові судоми, м’язова слабкість | Рідко |
З боку сечовидільної системи | Дизурія | Нечасто |
Полакіурія | Рідко | |
Порушення загального стану та пов’язані зі способом застосування препарату | Втомлюваність | Часто |
Астенія, нездужання | Нечасто | |
Набряк, дискомфорт у ділянці грудної клітки, порушення ходи | Рідко | |
Дані лабораторних досліджень | Підвищення аланінамінотрансферази (АЛТ) | Часті |
Підвищення аспартатамінотрансферази (АСТ), підвищення лужної фосфатази | Нечасті | |
Наявність червоних клітин крові в сечі, зниження кількості натрію в крові, зниження маси тіла, зниження кількості нейтрофілів, наявність глюкози в сечі, посилення діурезу | Рідко |
*Нудота та блювання були параметрами ефективності протягом перших 5 днів пост-хіміотерапевтичного лікування та враховувались як побічні реакції тільки після цього періоду.
Характер несприятливих явищ, які виникали при багаторазових циклах (до 6 циклів) хіміотерапії в ході досліджень ВРЕ та ПРЕ, були в цілому подібними до тих, що спостерігалися в 1-му циклі.
У додатковому клінічному дослідженні у 1169 пацієнтів, які отримували апрепітант і хіміотерапію з високим ступенем еметогенності, профіль побічних реакцій був загалом аналогічний профілю, що спостерігався в інших дослідженнях хіміотерапії з високим ступенем еметогенності при застосуванні апрепітанту.
Додаткові побічні реакції спостерігалися у пацієнтів, які отримували апрепітант для лікування післяопераційної нудоти і блювання, а також з більшою частотою, ніж при застосуванні ондансетрону: біль у верхній частині живота, патологічні шуми в кишечнику, запор*, дизартрія, диспное, гіпестезія, безсоння, міоз, нудота, сенсорні порушення, дискомфорт у шлунку, часткова кишкова непрохідність*, зниження гостроти зору, хрипи.
* Повідомлялося у пацієнтів, які приймали апрепітант у високих дозах.
Фосапрепітант.
В активно контрольованому клінічному дослідженні з залученням пацієнтів, які отримували хіміотерапію з високим ступенем еметогенності, безпеку було оцінено у 1143 пацієнтів, які отримували одноденний курс препарату Еменд® (фосапрепітант) 150 мг, порівняно з 1169 пацієнтами, які отримували триденний курс апрепітанту. Додатково у ході плацебо-контрольованих клінічних досліджень із залученням пацієнтів, які отримували хіміотерапію з помірним ступенем еметогенності, безпеку було оцінено для 504 пацієнтів, які отримували одноденний курс препарату Еменд® (фосапрепітант) 150 мг порівняно з 497 пацієнтами, які отримували призначення групи контролю.
Профіль безпеки був загалом аналогічний профілю, що спостерігався при застосуванні апрепітанту (наведено у таблиці вище).
Таблиця з переліком побічних реакцій − фосапрепітант.
Нижче наведені клінічно значущі побічні реакції, про які повідомлялося у пацієнтів, які отримували фосапрепітант, у клінічних дослідженнях або постмаркетингових спостереженнях, про які не повідомлялося стосовно апрепітанту, як зазначено вище.
Частота визначена як: дуже часто (≥ 1/10); часто (від ≥ 1/100 до < 1/10); нечасто (від ≥ 1/1000 до < 1/100); рідко (від ≥ 1/10000 до < 1/1000); дуже рідко (< 1/10000); невідомо (частоту неможливо визначити, виходячи з наявних даних).
Система органів | Побічна реакція | Частота |
З боку судинної системи | Припливи, тромбофлебіт (переважно в місці інфузії) | Нечасто |
З боку шкіри та підшкірної клітковини | Еритема | Нечасто |
Загальні порушення та локальні реакції у місці введення препарату | Еритема в місці інфузії, біль у місці інфузії, свербіж у місці інфузії | Нечасто |
Затвердіння в місці інфузії | Рідко | |
Негайні реакції підвищеної чутливості, включаючи припливи, еритему, диспное, анафілактичні реакції/ анафілактичний шок | Невідомо | |
Об’єктивні дослідження | Підвищення артеріального тиску | Нечасто |
Термін придатності.
Невідкритий флакон – 2 роки.
Після відновлення та розведення хімічна та фізична стабільність розчину при застосуванні була підтверджена протягом 24 годин при температурі 25 °С.
З мікробіологічної точки зору препарат необхідно використати негайно.
У разі неможливості негайного використання відповідальність за умови та час зберігання препарату перед його використанням несе користувач, але звичайно час використання не має бути довшим ніж 24 години при температурі 2-8 °С.
Умови зберігання.
Зберігати в недоступному для дітей місці.
Зберігати в холодильнику при температурі 2-8 °С.
Приготований розчин слід використати негайно.
Якщо розчин не використаний негайно, його слід зберігати в холодильнику при температурі 2-8 °С не більше 24 годин.
Несумісність.Препарат не повинен відновлюватися або змішуватися з розчинами, хімічна та фізична сумісність яких не була встановлена. Препарат Еменд® (фосапрепітант) несумісний з будь-якими розчинами, що містять двовалентні катіони (наприклад, Ca2+, Mg2+), включаючи розчини Хартмана та Рінгера. Препарат не слід змішувати з іншими препаратами, за винятком зазначених у розділі «Спосіб застосування та дози».
Упаковка.
Порошок для розчину для інфузій у скляному флаконі місткістю 10 мл. По1 флакону у картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
Мерк Шарп і Доум Б.В., Нідерланди/
Merck Sharp & Dohme B.V., the Netherlands.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Ваардервег 39, 2031 БН Хаарлем, Нідерланди/
Waarderweg 39, 2031 BN Haarlem, the Netherlands.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО

