РЕПАТА
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.
 від 2 °С до 8 °С. Не заморожувати
від 2 °С до 8 °С. Не заморожувати 

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
РЕПАТА
(REPATHA®)
Склад :
діюча речовина:еволокумаб;
Репата, 140мг, розчин для ін’єкцій у попередньо наповненому шприці-ручці
1 попередньо наповнений шприц-ручка містить 140мг еволокумабу в 1мл розчину.
Репата - це моноклональне антитіло людини IgG2, що виробляється з використанням технології рекомбінантної ДНК у клітинах яєчника китайського хом’ячка (ЯКХ).
допоміжні речовини:пролін, оцтова кислота льодяна, полісорбат80, натрію гідроксид (для регулювання pH), вода для ін’єкцій.
Розчин для ін’єкцій.
Основні фізико-хімічні властивості:прозора або опалесцентна рідина, безбарвна або жовтуватого кольору, практично без часток.
Фармакотерапевтична група
Ліпідомодифікувальні засоби, прості. Інші ліпідомодифікувальні засоби.
Код АТС C10AX13.
Фармакологічні властивості
Механізм дії
Еволокумаб селективно зв’язується з пропротеїнконвертазою9-го субтилізин-кексинового типу (PCSK9) та інгібує зв’язування циркулюючої PCSK9 з рецептором ліпопротеїну низької щільності (Р-ЛПНЩ) на поверхні клітин печінки, таким чином запобігаючи PCSK9-опосередкованому розпаду Р-ЛПНЩ. Підвищення рівнів Р-ЛПНЩ у печінці призводить до зниження сироваткової концентрації холестерину ліпопротеїнів низької щільності (ХС-ЛПНЩ).
Фармакодинамічні властивості.
У клінічних випробуваннях лікарський засіб Репата знижував концентрації незв’язаної PCSK9, ХС-ЛПНЩ, загального холестерину (ЗХ), аполіпопротеїну В (АпоВ), холестерину ліпопротеїнів невисокої щільності (ХС не-ЛПВЩ), ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1, холестерину ліпопротеїнів дуже низької щільності (ХС-ЛПДНЩ), тригліцеридів (ТГ) та ліпопротеїну(а) [Лп(а)] та підвищував холестерин ліпопротеїдів високої щільності (ХС-ЛПНЩ) та АпоА1 у пацієнтів з первинною гіперхолестеринемією та змішаною дисліпідемією.
Однократне підшкірне застосування лікарського засобу Репата 140мг або 420мг призводив до максимальної супресії циркулюючої незв’язаної PCSK9 через 4години, що супроводжувалося зниженням ХС-ЛПНЩ, що досягав середньої найнижчої межі до 14 та 21дня відповідно. Зміни концентрації незв’язаної PCSK9 та сироваткових ліпопротеїнів були оборотними після відміни лікарського засобу Репата. Жодного збільшення концентрації незв’язаної PCSK9 та ХС-ЛПНЩ порівняно з початковим рівнем під час виведення еволокумабу не спостерігалося, що свідчить про те, що компенсаторні механізми для підвищення продукування PCSK9 та ХС-ЛПНЩ під час лікування не з’являються.
Режими підшкірного застосування 140мг кожні 2тижні та 420мг один раз на місяць були еквівалентними за середнім зниженням ХС-ЛПНЩ (середнє значення на тижнях 10 та 12), що призводило до зниження від -72 до -57% від початкового рівня порівняно з плацебо. Лікування за допомогою лікарського засобу Репата призвело до подібного зниження ХС-ЛПНЩ при застосуванні у вигляді монотерапії або в комбінації з іншою гіполіпідемічною терапією.
Клінічна ефективність при первинній гіперхолестеринемії та змішаній дисліпідемії
Зниження рівня ХС-ЛПНЩ приблизно від 55% до 75% за допомогою лікарського засобу Репата досягалося вже на тижні1 та підтримувалося протягом тривалої терапії. Загалом максимальна відповідь досягалася протягом 1-2тижнів після введення дози 140мг кожні 2тижні та 420мг 1раз на місяць. Лікарський засіб Репата був ефективним в усіх підгрупах порівняно з плацебо та езетимібом, при цьому між підгрупами суттєвих відмінностей, пов’язаних, наприклад, з віком, расою, статтю, регіоном, індексом маси тіла, ризиком за Національною освітньою програмою з холестерину, палінням, фактором ризику ішемічної хвороби серця (ІХС) на початковому етапі, сімейним анамнезом ранньої ІХС, статусом толерантності до глюкози (наприклад, цукровий діабет 2типу, метаболічний синдром або ні те, ні інше), артеріальною гіпертензією, дозою статину та інтенсивністю, початковою незв’язаною PCSK9, початковим рівнем ХС-ЛПНЩ та початковим рівнем ТГ, не постерігалося.
У 80-85% всіх пацієнтів з первинною гіперхолестеринемією, що приймали одну з доз, лікарський засіб Репата демонстрував зниження на ≥50% рівня ХС-ЛПНЩ у середньому на тижнях 10 та 12. До 99% пацієнтів, що приймали одну з доз лікарського засобу Репата, досягали концентрації ХС-ЛПНЩ <2,6ммоль/л, а до 95% — досягали рівня ХС-ЛПНЩ <1,8ммоль/л в середньому на тижнях 10 та 12.
Комбінація зі статином і статином з іншими гіполіпідемічними препаратами
LAPLACE-2 - міжнародне багатоцентрове подвійно сліпе рандомізоване 12-тижневе дослідження за участю 1896 пацієнтів з первинною гіперхолестеринемією або змішаною дисліпідемією, яких у довільному порядку було розподілено між групами прийому лікарського засобу Репата у комбінації зі статинами (розувастатин, симвастатин або аторвaстатин). Лікарський засіб Репата порівнювали з плацебо у групах прийому розувастатину та симвастатину і з плацебо та езетимібом у групі прийому аторвaстатину.
Лікарський засіб Репата суттєво знижував рівень ХС-ЛПНЩ від початкового рівня до середнього значення на тижнях10 та 12 порівняно з плацебо у групах прийому розувастатину та симвастатину та порівняно з плацебо та езетимібом у групі аторвaстатину (p<0,001). Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1, ХС-ЛПДНЩ, рівні ТГ та Лп(а), підвищував рівень ХС-ЛПВЩ від початкового рівня до середнього значення на тижнях 10 та 12 порівняно з плацебо у групах прийому розувастатину та симвастатину (p<0,05) і суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1 та Лп(а), порівняно з плацебо та езетимібом у групі аторвaстатину (p<0,001) (див. таблиці1 та 2).
RUTHERFORD-2 - міжнародне багатоцентрове подвійно сліпе рандомізоване плацебо-контрольоване 12-тижневе дослідження за участю 329пацієнтів з гетерозиготною сімейною гіперхолестеринемією, що проходили гіполіпідемічну терапію. Лікарський засіб Репата суттєво знижував рівні ХС-ЛПНЩ від початкового рівня до середнього значення на тижнях10 та 12 порівняно з плацебо (p<0,001). Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1, ХС-ЛПДНЩ, ТГ та Лп(а) і підвищував рівні ХС-ЛПВЩ та АпоА1 від початкового рівня до середнього значення на тижнях10 та 12 порівняно з плацебо (p<0,05) (див. таблицю1).
Таблиця1. Ефекти від лікування лікарським засобом Репата порівняно з плацебо у пацієнтів з первинною гіперхолестеринемією та змішаною дисліпідемією - середнє значення процентної зміни від початкового рівня до середнього значення на тижнях10 та 12 (%, 95% Довірчий інтервал (ДІ))
Дослідження | Режим засто-сування | ХС- ЛПНЩ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ЗХ (%) | Лп(а) (%) | ХС- ЛПДНЩ (%) | ХС- ЛПВЩ (%) | ТГ (%) | АпоА1 (%) | Співвід- ношення ЗХ/ХС- ЛПВЩ % | Співвід- ношення АпоВ/ АпоА1 % |
LAPLACE-2 (HMD) (комбіновані групи прийому розувастатину, симвастатину та аторвастатину) | 140мг Q2W (N=555) | -72b (-75, -69) | -60b (-63, -58) | -56b (-58, -53) | -41b (-43, -39) | -30b (-35, -25) | -18b (-23, -14) | 6b (4, 8) | -17b (-22, -13) | 3b (1, 5) | -45b (-47, -42) | -56b (-59, -53) |
420мг QM (N=562) | -69b (-73, -65) | -60b (-63, -57) | -56b (-58, -53) | -40b (-42, -37) | -27b (-31, -24) | -22b (-28, -17) | 8b (6, 10) | -23b (-28, -17) | 5b (3, 7) | -46b (-48, -43) | -58b (-60, -55) | |
RUTHERFORD-2 (HeFH) | 140мг Q2W (N=110) | -61b (-67, -55) | -56b (-61, -51) | -49b (-54, -44) | -42b (-46, -38) | -31b (-38, -24) | -22b (-29, -16) | 8b (4, 12) | -22b (-29, -15) | 7a (3, 12) | -47b (-51, -42) | -53 (-58, -48) |
420мг QM (N=110) | -66b (-72, -61) | -60b (-65, -55) | -55b (-60, -50) | -44b (-48, -40) | -31b (-38, -24) | -16b (-23, -8) | 9b (5, 14) | -17b (-24, -9) | 5a (1, 9) | -49b (-54, -44) | -56b (-61, -50) |
Умовні позначення:
Q2W = 1раз кожні 2тижні
QM = 1раз на місяць
HMD = первинна гіперхолестеринемія та змішана дисліпідемія
HeFH = гетерозиготна сімейна гіперхолестеринемія
а значення р<0,05 порівняно з плацебо
b значення р<0,001 порівняно з плацебо
Пацієнти з непереносимістю статинів
GAUSS-2 - міжнародне багатоцентрове подвійне сліпе рандомізоване езетиміб-контрольоване 12-тижневе дослідження за участю 307 пацієнтів, які мали непереносимість статинів або не могли переносити ефективну дозу статину. Лікарський засіб Репата суттєво знижував рівень ХС-ЛПНЩ порівняно з езетимібом (p<0,001). Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1 та Лп(а) від початкового рівня до середнього значення на тижнях10 та 12 порівняно з езетимібом (p<0,001) (див. таблицю2).
Лікування за відсутності статину
MENDEL-2 - міжнародне багатоцентрове подвійно сліпе рандомізоване плацебо- та езетиміб-контрольоване 12-тижневе дослідження лікарського засобу Репата за участю 614 пацієнтів з первинною гіперхолестеринемією та змішаною дисліпідемією. Лікарський засіб Репата суттєво знижував рівень ХС-ЛПНЩ від початкового рівня до середнього значення на тижнях10 та 12 порівняно з плацебо та езетимібом (p<0,001). Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1 та Лп(а) від початкового рівня до середнього значення на тижнях10 та 12 порівняно з плацебо та езетимібом (p<0,001) (див. таблицю2).
Таблиця2. Ефекти від лікування лікарським засобом Репата порівняно з езетимібом у пацієнтів з первинною гіперхолестеринемією та змішаною дисліпідемією - середнє значення процентної зміни від початкового рівня до середнього значення на тижнях10 та 12 (%, 95% ДІ)
Дослідження | Режим засто-сування | ХС- ЛПНЩ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ЗХ (%) | Лп(а) (%) | ХС- ЛПДНЩ (%) | ХС- ЛПВЩ (%) | ТГ (%) | АпоА1 (%) | Співвід- ношення ЗХ/ХС- ЛПВЩ % | Співвід- ношення АпоВ/ АпоА1 % |
LAPLACE-2 (HMD) (комбіновані групи прийому аторвастатину) | 140мг Q2W (N=219) | -43с (-50, -37) | -34с (-39, -30) | -34с (-38, -30) | -23с (-26, -19) | -30с (-35, -25) | -1 (-7, 5) | 7с (4, 10) | -2 (-9, 5) | 7с (4, 9) | -27с (-30, -23) | -38с (-42, -34) |
420мг QM (N=220) | -46с (-51, -40) | -39с (-43, -34) | -40с (-44, -36) | -25с (-29, -22) | -33с (-41, -26) | -7 (-20, 6) | 8с (5, 12) | -8 (-21, 5) | 7с (2, 11) | -30с (-34, -26) | -42с (-47, -38) | |
GAUSS-2 (непереносимість статинів) | 140мг Q2W (N=103) | -38b (-44, -33) | -32b (-36, -27) | -32b (-37, -27) | -24b (-28, -20) | -24b (-31, -17) | -2 (-10, 7) | 5 (1, 10) | -3 (-11, 6) | 5a (2, 9) | -27b (-32, -23) | -35b (-40, -30) |
420мг QM (N=102) | -39b (-44, -35) | -35b (-39, -31) | -35b (-40, -30) | -26b (-30, -23) | -25b (-34, -17) | -4 (-13, 6) | 6 (1, 10) | -6 (-17, 4) | 3 (-1, 7) | -30b (-35, -25) | -36b (-42, -31) | |
MENDEL-2 (лікування за відсутності статину) | 140мг Q2W (N=153) | -40b (-44, -37) | -36b (-39, -32) | -34b (-37, -30) | -25b (-28, -22) | -22b (-29, -16) | -7 (-14, 1) | 6а (3, 9) | -9 (-16, -1) | 3 (0, 6) | -29b (-32, -26) | -35b (-39, -31) |
420мг QM (N=153) | -41b (-44, -37) | -35b (-38, -33) | -35b (-38, -31) | -25b (-28, -23) | -20b (-27, -13) | -10 (-19, -1) | 4 (1, 7) | -9 (-18, 0) | 4a (1, 7) | -28b (-31, -24) | -37b (-41, -32) |
Умовні позначення:
Q2W = 1раз кожні 2тижні
QM = 1раз на місяць
HMD = первинна гіперхолестеринемія та змішана дисліпідемія
а значення р<0,05 порівняно з езетимібом
b значення р<0,001 порівняно з езетимібом
с номінальне значення р<0,001 порівняно з езетимібом
Тривала ефективність при первинній гіперхолестеринемії та змішаній дисліпідемії
DESCARTES - міжнародне багатоцентрове подвійно сліпе рандомізоване плацебо-контрольоване 52-тижневе дослідження за участю 901пацієнта з гіперліпідемією, які застосовували лише дієту, аторвaстатин або комбінацію аторвaстатину та езетимібу. Лікарський засіб Репата у дозі 420мг 1 раз на місяць суттєво знижував рівень ХС-ЛПНЩ від початкового значення на тижні52 порівняно з плацебо (p<0,001). Ефекти від лікування підтримувалися протягом 1року, що демонструвалося зниженням рівня ХС-ЛПНЩ з тижня12 до тижня52. Зниження рівня ХС-ЛПНЩ від початкового значення на тижні52 порівняно з плацебо узгоджувалося протягом фонової гіполіпідемічної терапії, оптимізованої щодо ХС-ЛПНЩ та серцево-судинного ризику.
Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1, ХС-ЛПДНЩ, ТГ та Лп(а) і підвищував рівні ХС-ЛПВЩ та АпоА1 на тижні 52 порівняно з плацебо (p<0,001) (див. таблицю3).
Таблиця3. Ефекти від лікування лікарським засобом Репата порівняно з плацебо у пацієнтів з первинною гіперхолестеринемією та змішаною дисліпідемією - середнє значення процентної зміни від початкового рівня до тижня52 (%, 95% ДІ)
Дослідження | Режим засто- сування | ХС- ЛПНЩ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ЗХ (%) | Лп(а) (%) | ХС- ЛПДНЩ (%) | ХС- ЛПВЩ (%) | ТГ (%) | АпоА1 (%) | Співвід ношення ЗХ/ХС- ЛПВЩ % | Співвід ношення АпоВ/ АпоА1 % |
DESCARTES | 420мг QM (N=599) | -59b (-64, -55) | -50b (-54, -46) | -44b (-48, -41) | -33b (-36, -31) | -22b (-26, -19) | -29b (-40, -18) | 5b (3, 8) | -12b (-17, -6) | 3a (1, 5) | -37b (-40, -34) | -46b (-50, -43) |
Умовні позначення:
QM = 1раз на місяць
а номінальне значення р<0,001 порівняно з плацебо
b значення р<0,001 порівняно з плацебо
OSLER та OSLER-2 були два рандомізованих контрольованих відкритих розширених дослідження з оцінки безпеки та ефективності лікарського засобу Репата за участю пацієнтів, які завершили лікування в початковому дослідженні. У кожному розширеному дослідженні пацієнтів було у довільному порядку розподілено у співвідношенні2:1 у групи прийому лікарського засобу Репата + стандартне лікування (група прийому еволокумабу) або лише стандартного лікування (контрольна група) протягом першого року дослідження. Наприкінці першого року (тиждень52 у дослідженні OSLER та тиждень 48 у дослідженні OSLER-2) пацієнти продовжили участь у лікуванні лікарським засобом Репата, коли всі пацієнти отримували незамаскований лікарський засіб Репата протягом ще 4років (OSLER) або 2років (OSLER-2).
Усього в дослідження OSLER було включено 1324пацієнти. Лікарський засіб Репата у дозі 420мг 1раз на місяць суттєво знижував рівень ХС-ЛПНЩ від початкового значення на тижні12 та тижні52 порівняно з контролем (номінальне значення p<0,001). Ефекти від лікування підтримувалися протягом 272тижнів, що демонструвалося зниженням рівня ХС-ЛПНЩ з тижня12 у початковому дослідженні до тижня260 у відкритому розширеному дослідженні. Усього в дослідження OSLER-2 було включено 3 681пацієнт. Лікарський засіб Репата суттєво знижував рівень ХС-ЛПНЩ від початкового рівня на тижні12 та тижні 48 порівняно з контролем (номінальне значення p<0,001). Ефекти від лікування підтримувалися, що демонструвалося зниженням рівня ХС-ЛПНЩ з тижня12 до тижня104 у відкритому розширеному дослідженні. Лікарський засіб Репата суттєво знижував рівні ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ, АпоВ/АпоА1, ХС-ЛПДНЩ, ТГ та Лп(а) та підвищував рівні ХС-ЛПВЩ та АпоА1 від початкового значення до тижня52 у дослідженні OSLER та до тижня48 у дослідженні OSLER-2 порівняно з контролем (номінальне значення p<0,001). Рівень ХС-ЛПНЩ та інші параметри ліпідів поверталися до початкових значень протягом 12тижнів після припинення прийому лікарського засобу Репата на початку дослідження OSLER або OSLER-2 без прояву синдрому «рикошету».
TAUSSIG було поточним багатоцентровим відкритим 5-річним розширеним дослідженням з оцінки тривалої безпеки та ефективності лікарського засобу Репата як додаткової терапії до інших гіполіпідемічних препаратів за участю пацієнтів з тяжкою сімейною гіперхолестеринемією (СГ), включаючи гомозиготну сімейну гіперхолестеринемію. Усього в дослідження TAUSSIG було включено 194пацієнти з тяжкою сімейною гіперхолестеринемією (не-ГоСГ) та 106пацієнтів з гомозиготною сімейною гіперхолестеринемією. Усіх пацієнтів у дослідженні спочатку лікували лікарським засобом Репата у дозі 420мг 1раз на місяць, за винятком пацієнтів, які отримували аферез на момент включення і почали лікування лікарським засобом Репата у дозі 420мг 1раз кожні 2тижні. Частоту прийому лікарського засобу у пацієнтів, що не отримували ліпідний аферез, можна було збільшити до 420мг 1раз кожні 2тижні на підставі відповіді рівнів ХС-ЛПНЩ та PCSK9. Тривале застосування лікарського засобу Репата демонструвало стабільний ефект від лікування, що підтверджувалося зниженням рівня ХС-ЛПНЩ у пацієнтів з тяжкою сімейною гіперхолестеринемією (не-ГоСГ) (див. таблицю4).
Зміни в інших параметрах ліпідів (ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ та АпоВ/АпоА1) також демонстрували стабільний ефект від тривалого прийому лікарського засобу Репата у пацієнтів з тяжкою сімейною гіперхолестеринемією (не-ГоСГ).
Таблиця4. Ефект лікарського засобу Репата на ХС-ЛПНЩ у пацієнтів з тяжкою сімейною гіперхолестеринемією (не-ГоСГ) - медіанне значення процентної зміни від початкового рівня до тижня216 ВРД (та асоційовані 95% ДІ)
Популяція пацієнтів (N) | Тиждень 12 ВРД (n = 191) | Тиждень 24 ВРД (n = 191) | Тиждень 36 ВРД (n = 187) | Тиждень 48 ВРД (n = 187) | Тиждень 96 ВРД (n = 180) | Тиждень 144 ВРД (n = 180) | Тиждень 192 ВРД (n = 147) | Тиждень 216 ВРД (n = 96) |
Тяжка СГ (не‑ГоСГ) (N=194) | -54.9 (-57.4, -52.4) | -54.1 (-57.0, -51.3) | -54.7 (-57.4, -52.0) | -56.9 (-59.7, -54.1) | -53.3 (-56.9, -49.7) | -53.5 (-56.7, -50.2) | -48.3 (-52.9, -43.7) | -47.2 (-52.8, -41.5) |
Умовні позначення:
ВРД = відкрите розширене дослідження
СГ = сімейна гіперхолестеринемія
N (n) = кількість пацієнтів, що піддаються оцінці (N), та пацієнтів зі значеннями ЛПНЩ, що спостерігалися під час спеціального запланованого візиту (n) у проміжній аналізованій вибірці пацієнтів з тяжкою сімейною гіперхолестеринемією (не-ГоСГ).
Тривала безпека стабільних дуже низьких рівнів ХС-ЛПНЩ (а саме: <0,65ммоль/л [<25мг/дл]) ще не було встановлено. Наявні дані демонструють, що немає клінічно значимої різниці між профілями безпеки у пацієнтів з рівнями ХС-ЛПНЩ <0,65ммоль/л та пацієнтів з вищими рівнями ХС-ЛПНЩ (див. розділ «Побічні реакції»).
Лікування гомозиготної сімейної гіперхолестеринемії
TESLA було міжнародним багатоцентровим подвійно сліпим рандомізованим плацебо-контрольованим 12-тижневим дослідженням за участю 49пацієнтів з гомозиготною сімейною гіперхолестеринемією віком від 12 до 65років. Лікарський засіб Репата у дозі 420мг 1раз на місяць, як допоміжна терапія до інших гіполіпідемічних терапій (наприклад, статини, секвестранти жовчних кислот), суттєво знижував рівні ХС-ЛПНЩ та АпоВ на тижні12 порівняно з плацебо (p<0,001) (див. таблицю5). Зміни в інших параметрах ліпідів (ЗХ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ та АпоВ/АпоА1) також демонстрували ефект від лікування лікарським засобом Репата у пацієнтів з гомозиготною сімейною гіперхолестеринемією.
Таблиця5. Ефекти від лікування лікарським засобом Репата порівняно з плацебо у пацієнтів з гомозиготною сімейною гіперхолестеринемією - середнє значення процентної зміни від початкового рівня до тижня 12 (%, 95% ДІ)
Дослідження | Режим засто- сування | ХС- ЛПНЩ (%) | ХС не- ЛПВЩ (%) | АпоВ (%) | ЗХ (%) | Лп(а) (%) | ХС- ЛПДНЩ (%) | ХС- ЛПВЩ (%) | ТГ (%) | Співвід ношення ЗХ/ХС- ЛПВЩ % | Співвід ношення АпоВ/ АпоА1 % |
TESLA (ГоСГ) | 420мг QM (N=33) | -32b (-45, -19) | -30a (-42, -18) | -23b (-35, -11) | -27a (-38, -16) | -12 (-25, 2) | -44 (-128, 40) | -0,1 (-9, 9) | 0,3 (-15, 16) | -26a (-38, -14) | -28а (-39, -17) |
Умовні позначення:
ГоСГ = гомозиготна сімейна гіперхолестеринемія
QM = 1 раз на місяць
а номінальне значення р<0,001 порівняно з плацебо
b значення р<0,001 порівняно з плацебо.
Тривала ефективність при гомозиготній сімейній гіперхолестеринемії
У дослідженні TAUSSIG тривале застосування лікарського засобу Репата продемонструвало стабільний ефект лікування, що підтверджувався зниженням рівня ХС-ЛПНЩ приблизно від 20% до 30% у пацієнтів з гомозиготною сімейною гіперхолестеринемією, що не отримували аферез, та приблизно від 10% до 30% у пацієнтів з гомозиготною сімейною гіперхолестеринемією, що отримували аферез (див. таблицю6). Зміни в інших параметрах ліпідів (ЗХ, АпоВ, ХС не-ЛПВЩ, ЗХ/ХС-ЛПВЩ та АпоВ/АпоА1) також демонстрували стабільний ефект тривалого прийому лікарського засобу Репата у пацієнтів з гомозиготною сімейною гіперхолестеринемією. Зниження в рівні ХС-ЛПНЩ та зміни в інших параметрах ліпідів у 14пацієнтів-підлітків (віком ≥12 і <18 років) з гомозиготною сімейною гіперхолестеринемією були порівнянними зі значеннями в загальній популяції пацієнтів з гомозиготною сімейною гіперхолестеринемією.
Таблиця6. Ефект лікарського засобу Репата на ХС-ЛПНЩ у пацієнтів з гомозиготною сімейною гіперхолестеринемією - середнє значення процентної зміни від початкового рівня до тижня216 ВРД (та асоційовані 95% ДІ)
Популяція пацієнтів (N) | Тиждень 12 ВРД | Тиждень 24 ВРД | Тиждень 36 ВРД | Тиждень 48 ВРД | Тиждень 96 ВРД | Тиждень 144 ВРД | Тиждень 192 ВРД | Тиждень 216 ВРД |
ГоСГ (N=106) | -21.2 (-26.0, -16.3) (n=104) | -21.4 (-27.8, -15.0) (n=99) | -27.0 (-32.1, -21.9) (n=94) | -24.8 (-31.4, -18.3) (n=93) | -25.0 (-31.2, -18.8) (n=82) | -27.7 (-34.9, -20.5) (n=79) | -27.4 (-36.9, -17.8) (n=74) | -24.0 (-34.0, -14.0) (n=68) |
Не отримували аферез (N=72) | -22.7 (-28.1, -17.2) (n=70) | -25.8 (-33.1, -18.5) (n=69) | -30.5 (-36.4, -24.7) (n=65) | -27.6 (-35.8, -19.4) (n=64) | -23.5 (-31.0, -16.0) (n=62) | -27.1 (-35.9, -18.3) (n=60) | -30.1 (-37.9, -22.2) (n=55) | -23.4 (-32.5, -14.2) (n=50) |
Отримували аферез (N=34) | -18.1 (-28.1, -8.1) (n=34) | -11.2 (-24.0, 1.7) (n=30) | -19.1 (-28.9, -9.3) (n=29) | -18.7 (-29.5, -7.9) (n=29) | -29.7 (-40.6, -18.8) (n=20) | -29.6 (-42.1, -17.1) (n=19) | -19.6 (-51.2, 12.1) (n=19) | -25.9 (-56.4, 4.6) (n=18) |
Умовні позначення:
ВРД = відкрите розширене дослідження
N (n) = кількість пацієнтів, що піддаються оцінці (N), та пацієнтів зі значеннями ЛПНЩ, що спостерігалися під час спеціального запланованого візиту (n) у фінальній аналізованій вибірці пацієнтів з гомозиготною сімейною гіперхолестеринемією (ГоСГ).
Вплив на атеросклероз
Вплив лікарського засобу Репата у дозі 420мг 1раз на місяць на перебіг атеросклерозу, що вимірюється внутрішньосудинним ультразвуковим дослідженням (ВСУЗД (IVUS)), оцінювали у межах 78-тижневого подвійно сліпого рандомізованого плацебо-контрольованого дослідження за участю 968пацієнтів з ішемічною хворобою серця на фоні оптимальної терапії статином у стабільній дозі. Лікарський засіб Репата зменшив як відносний об’єм атероми (ВОА (PAV); 1,01% [95% ДІ 0,64, 1,38], p<0,0001), так і загальний об’єм атероми (ЗОА (TAV); 4,89мм3 [95% ДІ 2,53, 7,25], p<0,0001) у порівнянні з плацебо. При вимірюванні ВОА атеросклеротична регресія спостерігалася у 64,3% (95% ДІ 59,6, 68,7) та 47,3% (95% ДІ 42,6, 52,0) пацієнтів, які отримували лікарський засіб Репата або плацебо відповідно При вимірюванні ЗОА атеросклеротична регресія спостерігалася у 61,5% (95% ДІ 56,7, 66,0) та 48,9% (95% ДІ 44,2, 53,7) пацієнтів, які отримували лікарський засіб Репата або плацебо відповідно. У дослідженні не вивчали взаємозв’язок між регресією атеросклеротичних бляшок та явищами з боку серцево-судинної системи.
Зниження серцево-судинного ризику у дорослих зі встановленим атеросклерозом серцево-судинної системи
Дослідження результатів застосування лікарського засобу Репата «Repatha Outcomes Study (FOURIER)» було рандомізованим подвійно сліпим дослідженням типу «випадок-контроль» за участю 27564 суб’єктів, віком від 40 до 86років (середній вік 62,5років) зі встановленим атеросклерозом серцево-судинної системи; 81% мали попередній епізод інфаркту міокарда (ІМ), 19% — епізод інсульту, 13% — епізод захворювання периферичних артерій. Понад 99% пацієнтів отримували середньо- та високоінтенсивну терапію статинами та принаймні один інший серцево-судинний лікарський засіб, наприклад, антитромбоцитарні засоби, бета-блокатори, інгібітори АПФ або блокатори рецепторів ангіотензину; медіана рівня холестерину ЛПНЩ (1-йквартал, 3-йквартал) на вихідному рівні становила 2,4ммоль/л (2,1, 2,8). Абсолютний серцево-судинний (СС) ризик був збалансований між групами лікування, на додачу до індексної події всі пацієнти мали щонайменше 1значущий або 2незначущих фактори СС ризику; 80% мали гіпертонічну хворобу, 36% мали цукровий діабет, 28% палили щоденно. Пацієнти були рандомізовані у співвідношенні 1:1 до групи терапії лікарським засобом Репата (140мг кожні 2тижні або 420мг 1раз на місяць) або у групу відповідного плацебо; середня тривалість подальшого спостереження за пацієнтом становила 26місяців.
Значне зниження рівня холестерину ЛПНЩ спостерігалось протягом усього дослідження, при цьому досягався медіанний діапазон рівня холестерину ЛПНЩ від 0,8 до 0,9ммоль/л при кожній оцінці; 25% пацієнтів досягли концентрації холестерину ЛПНЩ менше 0,5ммоль/л. Незважаючи на досягнення дуже низького рівня холестерину ЛПНЩ, нових проблем безпеки не спостерігалося (див. розділ «Побічні реакції»); частота випадків вперше виявленого цукрового діабету та когнітивних подій була порівнянна у пацієнтів, які досягли рівнів холестерину ЛПНЩ <0,65ммоль/л, та у пацієнтів з більш високим рівнем холестерину ЛПНЩ.
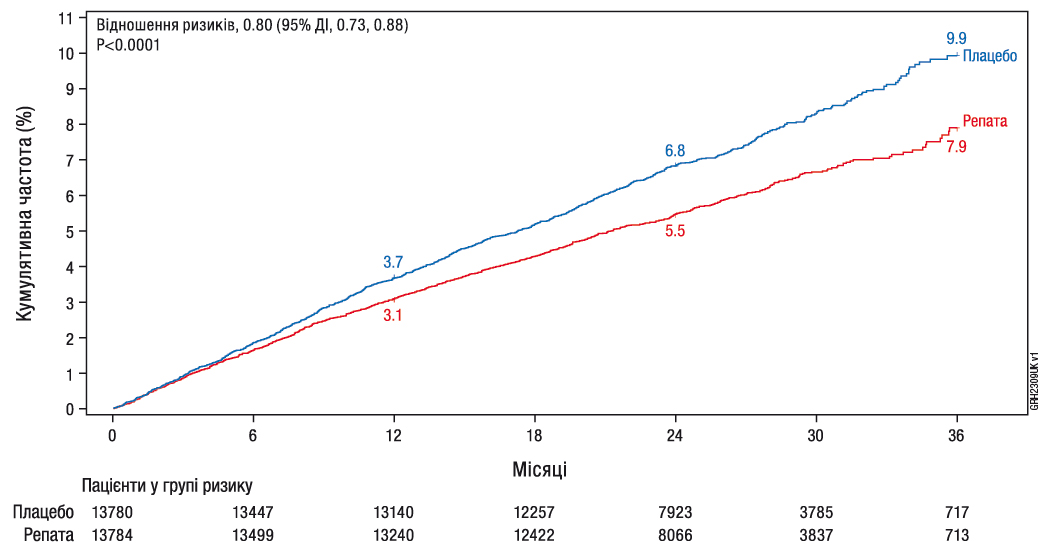
Лікарський засіб Репата значно знизив ризик явищ з боку серцево-судинної системи, визначених як композитна кінцева точка, що включає час до першої смерті через СС патологію, ІМ, інсульт, коронарну реваскуляризацію або госпіталізації з приводу нестабільної стенокардії (див. таблицю7); криві Каплана-Мейєра для первинної та ключової вторинної композитних кінцевих точок, між якими було приблизно 5місяців (трирічну криву Каплана-Мейєра для значного небажаного серцево-судинного явища (ЗНССЯ (MACE)) наведено на рисунку1). Відносний ризик композитної кінцевої точки ЗНССЯ (смерть через СС патологію, ІМ або інсульт) був значно знижений на 20%. Ефект лікування був послідовним у всіх підгрупах (включаючи вік, тип захворювання, вихідний рівень холестерину ЛПНЩ, рівень інтенсивності терапії статинами, застосування езетимібу та наявність цукрового діабету) і був зумовлений зменшенням ризику інфаркту міокарда, інсульту та коронарної реваскуляризації; не спостерігалося значущої різниці щодо смертності через СС патологію та з усіх причин, однак дизайн дослідження не передбачав виявлення такої різниці.
Таблиця7. Ефект лікарського засобу Репата на значущі явища з боку серцево-судинної системи
Значущі явища | Плацебо (N=13780) n (%) | Репата (N=13784) n (%) | Відношення ризиківa (95% ДІ) | p-значенняb | |||||
ЗНССЯ+ (композитна ЗНССЯ, коронарної реваскуляризації або госпіталізації з приводу нестабільної стенокардії) | 1563 (11,34) | 1344 (9,75) | 0,85 (0,79, 0,92) | <0,0001 | |||||
ЗНССЯ (композитна смерті через СС патологію, ІМ або інсульт) | 1013 (7,35) | 816 (5,92) | 0,80 (0,73, 0,88) | <0,0001 | |||||
Смерть через серцево-судинну патологію | 240 (1,74) | 251 (1,82) | 1,05 (0,88, 1,25) | 0,62 | |||||
Смертність з усіх причин | 426 (3,09) | 444 (3,22) | 1,04 (0,91, 1,19) | 0,54 | |||||
Інфаркт міокарда (смертельний/несмертельний) | 639 (4,64) | 468 (3,40) | 0,73 (0,65, 0,82) | <0,0001c | |||||
Інсульт (смертельний/несмертельний) d | 262 (1,90) | 207 (1,50) | 0,79 (0,66, 0,95) | 0,0101c | |||||
Коронарна реваскуляризація | 965 (7,00) | 759 (5,51) | 0,78 (0,71, 0,86) | <0,0001c | |||||
Госпіталізація з приводу нестабільної стенокардії e | 239 (1,7) | 236 (1,7) | 0,99 (0,82, 1,18) | 0,89 | |||||
a На основі моделі Кокса, стратифікованої за факторами стратифікації рандомізації, зібраними за допомогою Системи інтерактивної голосової відповіді (IVRS).
b Двобічний лог-ранговий критерій стратифікований за факторами стратифікації рандомізації, зібраними за допомогою Системи інтерактивної голосової відповіді (IVRS).
c Номінальна значущість.
d Вплив лікування на інсульт був зумовлений зменшенням ризику ішемічного інсульту; не було відмічено впливу на геморагічний або невизначений інсульт.
e Оцінка часу до госпіталізації при нестабільній стенокардії була ситуативною.
Рис.1. Час до явища ЗНССЯ (композитна смерті через СС патологію, ІМ або інсульт); 3‑річний розрахунок за методом Каплана-Мейєра
Діти
Європейське агентство лікарських засобів відмовилося від права вимагати виконання зобов’язання подавати результати досліджень з лікарським засобом Репата в усіх субпопуляціях дітей для лікування змішаної дисліпідемії.
Європейське агентство лікарських засобів відстрочило зобов’язання подавати результати досліджень з лікарським засобом Репата в одній або більше субпопуляції дітей для лікування підвищеного рівня холестерину.
Наявні дані щодо застосування лікарського засобу Репата дітям обмежені. 14пацієнтів-підлітків віком ≥12 і <18 років з гомозиготною сімейною гіперхолестеринемією було включено в клінічні дослідження. Жодної загальної різниці у безпеці або ефективності між пацієнтами-підлітками та дорослими з гомозиготною сімейною гіперхолестеринемією не спостерігалося.
Інформація про застосування дітям наведена в розділі «Спосіб застосування та дози».
Абсорбція та розподіл
Після однократного підшкірного введення 140мг або 420мг лікарського засобу Репата здоровим дорослим медіанні пікові концентрації в сироватці досягалися через 3-4дні. Застосування однократної підшкірної дози 140мг спричиняло середнє значення (СКВ) Cmax 13,0(10,4)мкг/мл і середнє значення (СКВ) AUClast 96,5 (78,7)добу•мкг/мл. Застосування однократної підшкірної дози 420мг спричиняло середнє значення (СКВ) Cmax 46,0(17,2)мкг/мл і середнє значення (СКВ) AUClast 842 (333)добу•мкг/мл. 3 підшкірні дози 140мг були біоеквівалентними 1 підшкірній дозі 420мг. Абсолютна біодоступність після підшкірного введення дози становила 72% від фармакокінетичних (ФК) моделей.
Після однократної внутрішньовенної дози 420мг лікарського засобу Репата середній (СКВ) обсяг розподілу в рівноважному стані становив 3,3 (0,5)л, що свідчило про те, що еволокумаб має обмежений розподіл у тканинах.
Біотрансформація
Лікарський засіб Репата складається лише з амінокислот та вуглеводів, як природний імуноглобулін, та навряд чи буде виводитися через метаболічні механізми печінки. Очікується, що його метаболізм та виведення будуть здійснюватися шляхом розкладання на невеликі пептиди та окремі амінокислоти.
Виведення
Вважається, що еволокумаб має ефективний період напіввиведення від 11 до 17днів.
У пацієнтів з первинною гіперхолестеринемією або змішаною дисліпідемією, що приймають високу дозу статину, системний вплив еволокумабу був трохи нижчим, ніж у пацієнтів, що приймали низьку або середню дозу статину (співвідношення AUClast 0,74 [90% ДІ 0,29; 1,9]). Підвищення приблизно на 20% кліренсу частково опосередковане статинами, що збільшувало концентрацію PCSK9, але не впливало негативно на фармакодинамічний ефект еволокумабу на ліпіди. Фармакокінетичний аналіз популяції не вказував на суттєву різницю в сироваткових концентраціях еволокумабу у пацієнтів з гіперхолестеринемією (несімейною гіперхолестеринемією або сімейною гіперхолестеринемією), що одночасно приймали статини.
Лінійність/нелінійність
Після однократної внутрішньовенної дози 420мг середній (СКВ) системний кліренс становив 12 (2)мл/год. У клінічних дослідженнях з багатократним підшкірним введенням дози протягом 12 тижнів дозопропорційне збільшення експозиції спостерігалися при застосуванні дози 140мг і більше. Приблизно 2-3-кратна кумуляція спостерігалася при мінімальних сироваткових концентраціях [Cmin (СКВ) 7,21 (6,6)] після введення дози 140мг кожні 2тижні або після введення дози 420мг 1раз на місяць [Cmin (СКВ) 11,2 (10,8)], сироваткові мінімальні концентрації наближалися до рівноважного стану через 12тижнів після введення дози.
Часозалежні зміни не спостерігалися у сироваткових концентраціях протягом періоду 124тижні.
Порушення функції нирок
Для пацієнтів з порушенням функції нирок коригування дози не потрібне. Дані з клінічних досліджень лікарського засобу Репата не виявив різниці у фармакокінетиці еволокумабу у пацієнтів з порушенням функції нирок легкого або середнього ступеня порівняно з пацієнтами, які не мають порушення функції нирок.
У клінічному дослідженні за участю 18 пацієнтів з нормальною функцією нирок (розрахункова швидкість клубочкової фільтрації [eGFR] ≥ 90 мл/хв/1,73 м2, n = 6), або тяжким порушенням функції нирок (eGFR від 15 до 29 мл/хв/1,73 м2, n = 6), або захворюванням ниркової хвороби кінцевої стадії (ЗНХ), що отримували гемодіаліз (n = 6), вплив незв’язаного еволокумабу за оцінкою Cmax після одноразової підшкірної дози 140 мг зменшився на 30% у пацієнтів із тяжким порушенням функції нирок та на 45% у пацієнтів із ЗНХ, які отримували гемодіаліз. Експозиція, за оцінкою AUClast, зменшилася приблизно на 24% у пацієнтів із вираженим порушенням функції нирок та приблизно на 45% у пацієнтів із ЗНХ, які отримували гемодіаліз. Точний механізм відмінностей РК невідомий; однак різниці у вазі тіла не змогли надати пояснення цим відмінностям. При інтерпретації результатів слід враховувати деякі фактори, включаючи невеликий розмір вибірки та велику мінливість між суб'єктами. Фармакодинаміка та безпека еволокумабу у пацієнтів із вираженим порушенням функції нирок та ЗНХ були схожими на ті, що були у пацієнтів із нормальною функцією нирок, та клінічно значущих відмінностей у зниженні рівня ХС-ЛПНЩ не було. Тому коригування дози не потрібне пацієнтам із тяжким порушенням функції нирок або ЗНХ, які отримують гемодіаліз.
Порушення функції печінки
У пацієнтів з порушенням функції печінки легкого ступеня (класА за шкалою Чайлда - П’ю) коригування дози не потрібне. Однократні підшкірні дози 140мг лікарського засобу Репата вивчали у 8пацієнтів з порушенням функції печінки легкого ступеня, 8пацієнтів з порушенням функції печінки середнього ступеня та 8здорових учасників. Експозиція еволокумабу у пацієнтів з порушенням функції печінки була приблизно на 40-50% менше порівняно зі здоровими учасниками. Однак початкові рівні PCSK9 та ступінь і динаміка нейтралізації PCSK9 були подібними серед пацієнтів з порушенням функції печінки легкого або середнього ступеня та у здорових добровольців. Це обумовило подібну динаміку та ступінь абсолютного зниження рівня ХС-ЛПНЩ. Лікарський засіб Репата не вивчався у пацієнтів з порушенням функції печінки тяжкого ступеня (класС за шкалою Чайлда - П’ю) (див. розділ «Особливості застосування»).
Маса тіла
Маса тіла була суттєвою коваріатою у ФК аналізі популяції, що впливала на мінімальні концентрації еволокумабу, однак впливу на зниження рівня ХС-ЛПНЩ не було. Після багатократного підшкірного введення 140мг кожні 2тижні мінімальні концентрації на 12тижні були на 147% більші і на 70% нижче у пацієнтів вагою 69кг та 93кг відповідно, ніж у типового пацієнта вагою 81кг. Менший вплив маси тіла спостерігався при багатократному підшкірному введенні місячних доз еволокумабу 420мг.
Інші особливі групи пацієнтів
Фармакокінетичні аналізи популяції свідчать про те, що коригування дози за віком, расою або статтю не потрібні. На фармакокінетику еволокумабу впливала маса тіла без будь-якого суттєвого ефекту на зниження рівня ХС-ЛПНЩ. Тому коригування дози залежно від маси тіла не потрібне.
Клінічні характеристики
Показання.
Гіперхолестеринемія та змішана дисліпідемія
Лікарський засіб Репата показаний для дорослих з первинною гіперхолестеринемією (гетерозиготною сімейною та несімейною) або змішаною дисліпідемією як допоміжна терапія до дієти:
· у комбінації зі статином або статином та іншими гіполіпідемічними терапіями для пацієнтів, що не здатні досягти потрібних рівнів ХС-ЛПНЩ при максимальній переносимій дозі статину, або
· окремо або у комбінації з іншими гіполіпідемічними терапіями для пацієнтів, які мають непереносимість статинів або для яких статини протипоказані.
Гомозиготна сімейна гіперхолестеринемія
Лікарський засіб Репата показаний для дорослих та підлітків віком від 12років з гомозиготною сімейною гіперхолестеринемією у комбінації з іншими гіполіпідемічними терапіями.
Встановлений атеросклероз серцево-судинної системи
Лікарський засіб Репата показаний дорослим зі встановленим атеросклерозом серцево-судинної системи (інфаркт міокарда, інсульт або захворювання периферичних артерій) для зменшення серцево-судинного ризику за рахунок зниження рівня холестерину ЛПНЩ, як доповнення до коригування інших факторів ризику:
· у поєднанні з максимально переносимою дозою статину з або без інших методів зниження рівнів ліпідів, або
· самостійно чи у поєднанні з іншими гіполіпідемічними видами терапії у пацієнтів з непереносимістю статинів або у пацієнтів, яким протипоказаний статин.
Результати дослідження щодо впливу на рівень холестерину ЛПНЩ, явища з боку серцево-судинної системи та досліджувані популяції наведено у розділі «Фармакодинаміка».
Протипоказання.
Підвищена чутливість до діючої речовини або до будь-якої з допоміжних речовин, вказаних у розділі «Склад».
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Формальні дослідження взаємодії з іншими лікарськими засобами для лікарського засобу Репата не проводилися.
Фармакокінетичну взаємодію між статинами та еволокумабом оцінювали у клінічних дослідженнях лікарського засобу Репата. Підвищення кліренсу еволокумабу приблизно на 20% спостерігалося у пацієнтів, що одночасно приймали статини. Такий підвищений кліренс частково опосередкований статинами, які підвищують концентрацію пропротеїнконвертази9-го субтилізин-кексинового типу (PCSK9), що негативно не впливало на фармакодинамічний ефект еволокумабу на ліпіди. Коригування дози статину при застосуванні у комбінації з лікарським засобом Репата не потрібне.
Жодні дослідження фармакокінетичної та фармакодинамічної взаємодії між лікарським засобом Репата та гіполіпідемічними лікарськими засобами, іншими, аніж статини та езетиміб, не проводилися.
Особливості застосування.
Порушення функції печінки
У пацієнтів з порушенням функції печінки середнього ступеня спостерігалося зменшення загальної експозиції еволокумабу, що може зменшити ефект на зниження рівня ХС-ЛПНЩ. Тому для таких пацієнтів потрібен ретельний моніторинг.
Застосування лікарського засобу у пацієнтів з порушенням функції печінки тяжкого ступеня (класС за шкалою Чайлда - П’ю) не досліджувалося (див. розділ «Фармакокінетика»). Лікарський засіб Репата слід з обережністю застосовувати пацієнтам з порушенням функції печінки тяжкого ступеня.
Сухий натуральний каучук
Репата, 140мг, розчин для ін’єкцій у попередньо наповненому шприці-ручці
Ковпачок голки попередньо наповненого шприца-ручки виготовлено з сухого натурального каучуку (похідної латексу), який може викликати алергічні реакції.
Вміст натрію
Цей лікарський засіб містить менше 1ммоль натрію (23мг) на дозу, тобто практично вільний від натрію.
Застосування у період вагітності або годування груддю.
Вагітність
Даних про застосування лікарського засобу Репата вагітним жінкам дуже мало.
Дослідження на тваринах не вказують на прямі або непрямі ефекти щодо репродуктивної токсичності.
Лікарський засіб Репата не слід застосовувати під час вагітності, якщо тільки клінічний стан жінки не вимагає лікування еволокумабом.
Годування груддю
Невідомо, чи виділяється еволокумаб з молоком людини.
Ризик для немовляти/дитини, яку годують груддю, виключити не можна.
Слід прийняти рішення щодо того, чи припинити годувати груддю, чи припинити/утриматися від терапії лікарським засобом Репата, беручи до уваги користь від годування груддю для дитини та користь від терапії для жінки.
Репродуктивна функція
Немає даних про ефект еволокумабу на репродуктивну функцію людини. Дослідження на тваринах не вказували на жодні ефекти на кінцеві точки фертильності на площі під кривою концентрація/час (AUC) при рівнях експозиції набагато більших, ніж у пацієнтів, що приймають еволокумаб у дозі 420мг 1раз на місяць.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Немає відомостей про випадки впливу лікарського засобу Репата на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Спосіб застосування та дози.
Підшкірне застосування.
Лікарський засіб Репата призначений для підшкірного введення в ділянку живота, стегна або верхньої частини руки. Місця введення слід чергувати; ін’єкції не слід робити в ділянки шкіри з больовими відчуттями, синцями, почервонінням або ущільненням. Лікарський засіб Репата не слід вводити внутрішньовенно або внутрішньом’язово.
Репата, 140мг, розчин для ін’єкцій у попередньо наповненому шприці-ручці
Дозу 140мг слід вводити, використовуючи 1 попередньо наповнений шприц-ручку. Дозу 420мг слід вводити, використовуючи 3 попередньо наповнені шприци-ручки один за одним протягом 30 хвилин.
Лікарський засіб Репата призначений для самостійного введення пацієнтами після належного навчання. Лікарський засіб Репата може також вводитися іншою особою, що пройшла навчання з введення лікарського засобу.
Лікарський засіб призначений тільки для одноразового використання.
Див. також розділ «Особливі застереження щодо застосування та утилізації».
Дози.
Перед початком застосування лікарського засобу Репата слід виключити вторинні причини гіперліпідемії або змішаної дисліпідемії (наприклад, нефротичний синдром, гіпотиреоз).
Первинна гіперхолестеринемія та змішана дисліпідемія у дорослих
Рекомендована доза лікарського засобу Репата становить 140мг кожні 2тижні або 420мг 1раз на місяць; обидві дози є клінічно еквівалентними.
Гомозиготна сімейна гіперхолестеринемія у дорослих та підлітків віком від 12років
Початкова рекомендована доза становить 420мг 1раз на місяць. Через 12тижнів лікування частоту прийому лікарського засобу можна збільшити до 420мг 1раз кожні 2тижні, якщо клінічно значимої відповіді досягнуто не було. Пацієнти, що отримують аферез, можуть починати лікування з 420мг кожні 2тижні, щоб лікування відповідало графіку аферезу.
Встановлений атеросклероз серцево-судинної системи
Рекомендована доза лікарського засобу Репата становить 140мг кожні 2тижні або 420мг 1раз на місяць; обидві дози є клінічно еквівалентними.
Пацієнти з порушенням функції нирок
Коригування дози у пацієнтів з порушенням функції нирок не потрібно.
Пацієнти з порушенням функції печінки
Коригування дози у пацієнтів з порушенням функції печінки легкого ступеня не потрібно, для пацієнтів з порушенням функції печінки середнього та тяжкого ступеня див. розділ «Особливості застосування».
Пацієнти літнього віку (віком ≥65років)
Для пацієнтів літнього віку коригування дози не потрібне.
Діти.
Безпека та ефективність застосування лікарського засобу Репата дітям (віком до 18років) за показанням первинна гіперхолестеринемія та змішана дисліпідемія не встановлювалися. Немає жодних даних. Безпека та ефективність застосування лікарського засобу Репата дітям віком до 12 років за показанням гомозиготна сімейна гіперхолестеринемія не встановлювалися. Немає жодних даних.
Особливі застереження щодо застосування та утилізації.
Перед застосування розчин слід оглянути. Не вводьте розчин, якщо він містить частинки або є мутним чи знебарвленим. Задля уникнення неприємних відчуттів у місці введення доведіть лікарський засіб до кімнатної температури (до 25°C) перед введенням. Слід ввести весь вміст.
Невикористаний лікарський засіб або відходи слід утилізувати відповідно до місцевих вимог.
Введення лікарського засобу .
Репата, попередньо наповнений шприц-ручка одноразового використання SureClick
Складові частини шприца-ручки | |||
Перед застосуванням | Після застосування | ||
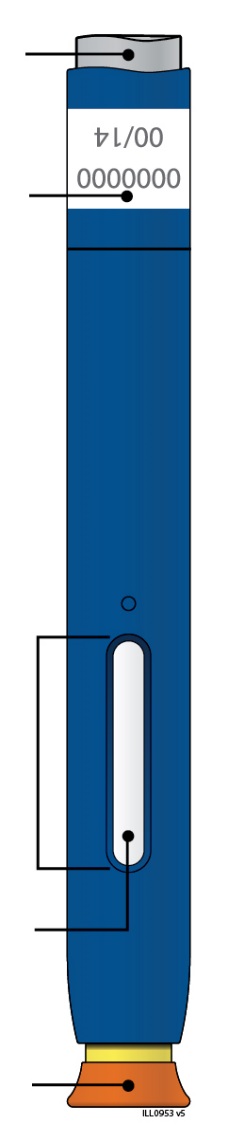
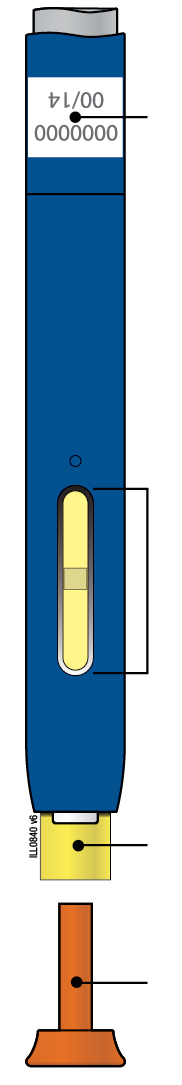
Сіра пускова кнопка Термін придатності Віконце Лікарський засіб Надітий помаранчевий захисний ковпачок |
|
| Термін придатності Жовте віконце (ін’єкцію завершено) Жовтий захисний пристрій Знятий помаранчевий захисний копачок |
Важливо: Голка всередині | |||
Важливо Перед застосуванням розчину для ін’єкцій Репата в одноразовому попередньо наповненому шприці-ручці прочитайте цю важливу інформацію: · Ваш лікар скаже Вам, скільки попередньо наповнених шприців-ручок з розчином Репата потрібно для Вашої дози. Якщо потрібно використати більше одного попередньо наповненого шприца-ручки, після доведення розчину до кімнатної температури ін’єкції потрібно зробити протягом 30хвилин. · Зберігайте попередньо наповнений шприц-ручку з розчином Репата в оригінальній картонній упаковці для захисту від світла. · Попередньо наповнений шприц-ручку слід зберігати у холодильнику (при температурі 2-8°C). · Важливо, щоб Ви не намагалися робити собі ін’єкцію, поки Ваш лікар не навчить Вас це робити. · Всередині помаранчевого захисного ковпачка, надітого на попередньо наповнений шприц-ручку, розміщений ковпачок голки, що складається із сухого натурального каучуку, виготовленого з латексу. Повідомте Вашого лікаря, якщо Ви маєте алергію на латекс. · Зберігайте попередньо наповнений шприц-ручку з розчином Репата у недоступному та непомітному для дітей місці. ·Не слід заморожувати попередньо наповнений шприц-ручку або використовувати шприц-ручку, який було заморожено; ·Не слідструшувати попередньо наповнений шприц-ручку; ·Не слідзнімати помаранчевий захисний ковпачок з попередньо наповненого шприца-ручки, поки Ви не будете готові вводити лікарський засіб; ·Не слідзастосовувати попередньо наповнений шприц-ручку, якщо він впав на тверду поверхню. Деталь шприца-ручки може бути зламана, навіть якщо Ви не бачите поломку; ·Не слідвикористовувати попередньо наповнений шприц-ручку після завершення терміну придатності. |
Етап 1. Підготовка | |
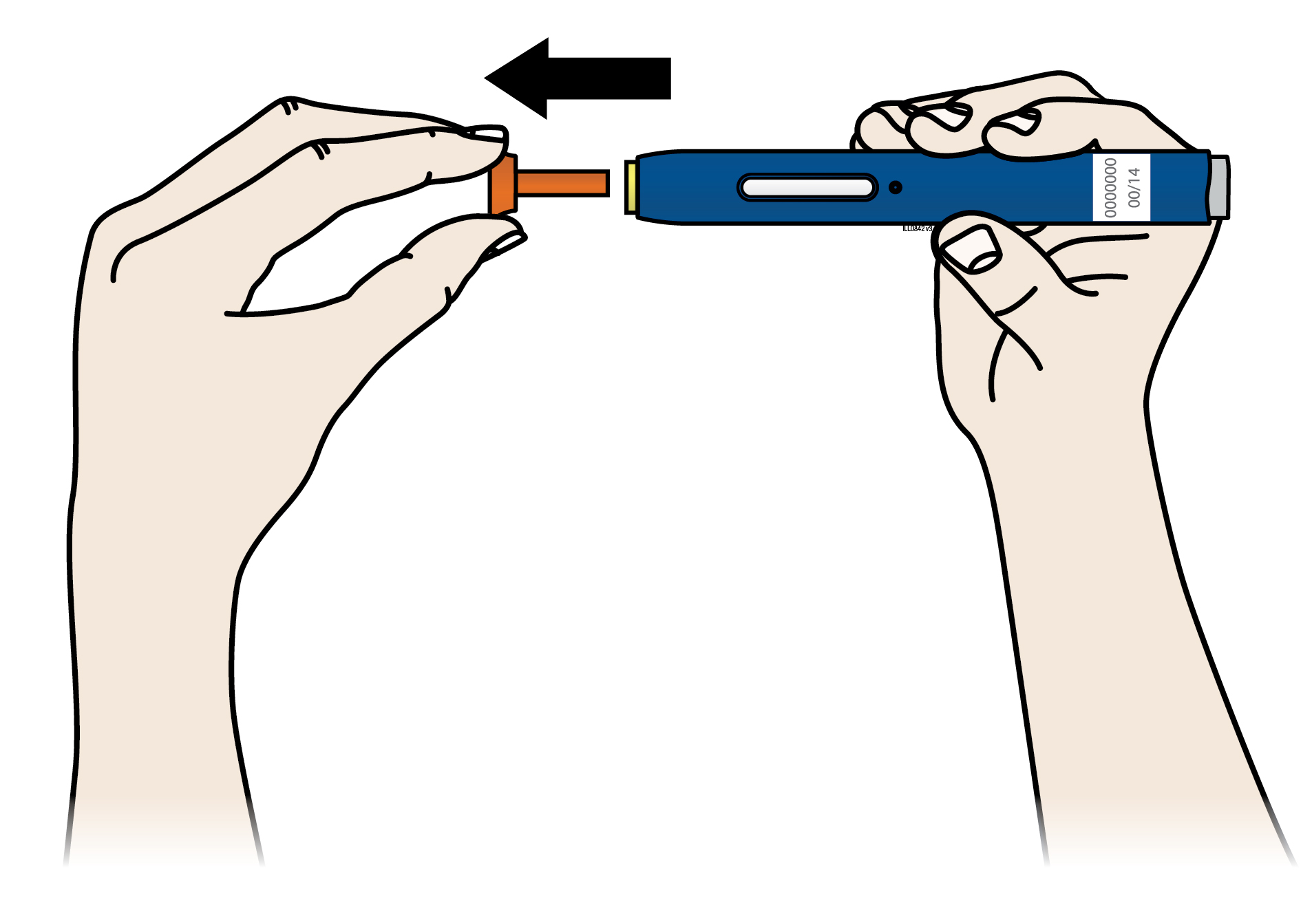
А | Вийміть один попередньо наповнений шприц-ручку з упаковки. |
1. Обережно вийміть попередньо наповнений шприц-ручку з коробки. 3. Зачекайте принаймні 30хвилин для того, щоб попередньо наповнений шприц-ручка природним шляхом досяг кімнатної температури перед введенням. Не сліднамагатися нагріти попередньо наповнений шприц-ручку, використовуючи джерело тепла, наприклад гарячу воду або мікрохвильову пічку; Не слідзалишати попередньо наповнений шприц-ручку під прямими сонячними променями; Не слідструшувати попередньо наповнений шприц-ручку; Не слід на цьому етапі знімати помаранчевий захисний ковпачок з попередньо наповненого шприца-ручки. | |
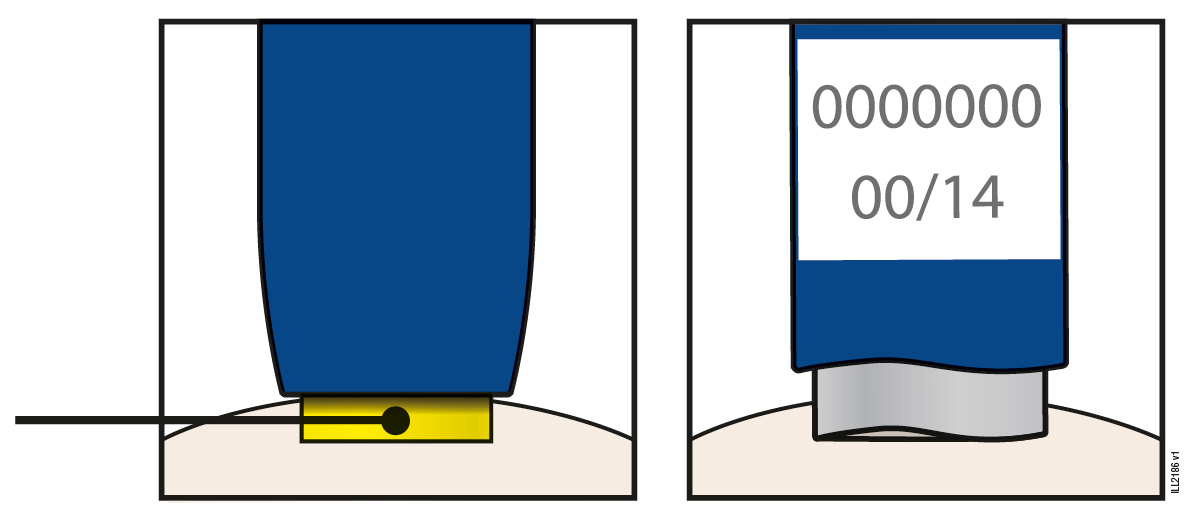
В | Огляньте попередньо наповнений шприц-ручку з розчином Репата. | ||
| |||
Надітий помаранчевий захисний ковпачок | Віконце | Лікарський засіб | |
Переконайтеся в тому, що лікарський засіб у віконці є прозорим та безбарвним або жовтуватого кольору. Перевірте термін придатності. ·Не слід використовувати попередньо наповнений шприц-ручку, якщо лікарський засіб є каламутним або змінив колір, чи містить великі згустки, пластівці або частинки; ·Не слідвикористовувати попередньо наповнений шприц-ручку, якщо якась деталь здається тріснутою або зламаною; ·Не слідвикористовувати, якщо попередньо наповнений шприц-ручка впав; ·Не слідвикористовувати попередньо наповнений шприц-ручку, якщо помаранчевий захисний ковпачок відсутній або ненадійно закріплений; ·Не слідвикористовувати попередньо наповнений шприц-ручку, якщо термін придатності закінчився. У всіх випадках використовуйте новий попередньо наповнений шприц-ручку. | |||
С | Підготуйте все необхідне для ін’єкції. |
Ретельно вимийте руки водою з милом. На чисту, добре освітлювану робочу поверхню помістіть: · Новий попередньо наповнений шприц-ручку. · Спиртові серветки. · Ватний тампон або марлеву серветку. · Пластир. · Контейнер для утилізації гострих предметів. | |
| |
D | Підготуйте та очистіть місце введення. | |
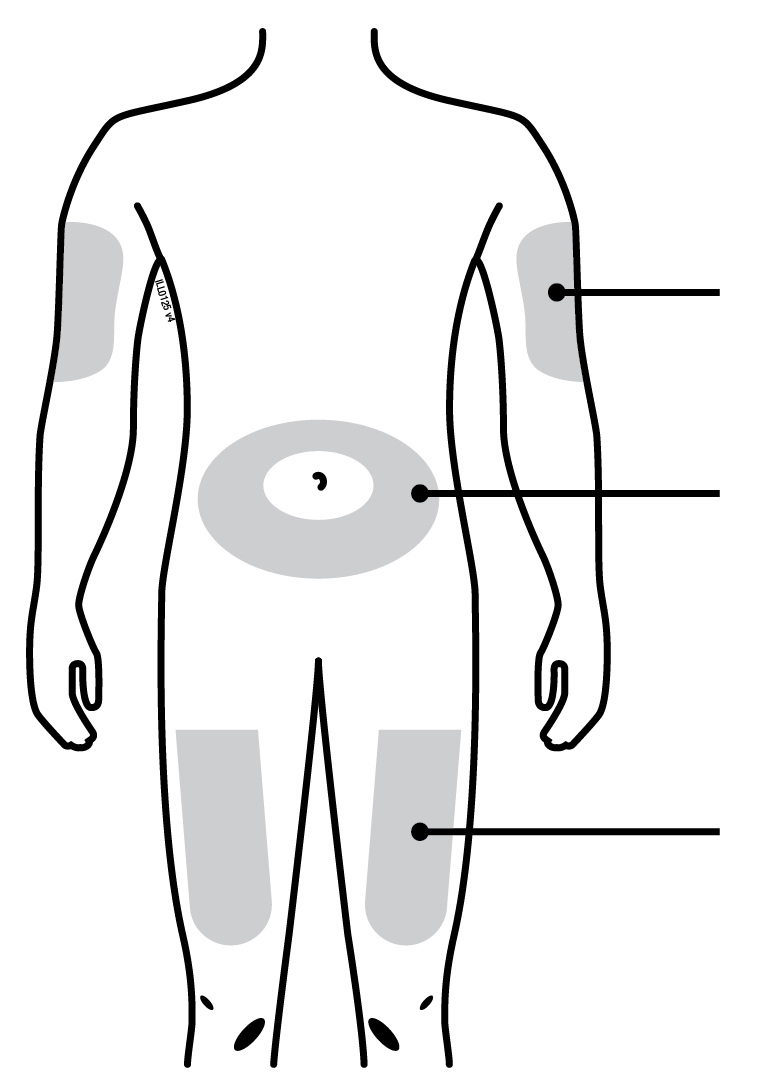
| Верхня частина руки Живіт Стегно | |
Ви можете вводити лікарський засіб у: · Стегно. · Живіт, за винятком ділянки радіусом 2дюйми (5см) навколо пупка. · Зовнішню поверхню верхньої частини руки (тільки якщо інша особа робить Вам ін’єкції). Очистіть місце введення за допомогою спиртової серветки. Дайте шкірі висохнути. | ||
·Не слід знову торкатися місця введення перед ін’єкцією. · Кожного разу, коли Ви робите собі ін’єкцію, обирайте іншу ділянку. Якщо Вам потрібно зробити ін’єкцію в одне і те саме місце, переконайтеся у тому, що Ви не вводите лікарський засіб у ту саму точку на цій ділянці, в яку Ви вводили минулого разу. ·Не слідобирати ділянку з больовими відчуттями, синцями, почервонінням або ущільненням на шкірі. Уникайте введення на ділянках зі шрамами або стріями. | ||
Етап 2. Приготування | |
А | Коли Ви готові робити ін’єкцію, зніміть помаранчевий захисний ковпачок. Не слід тримати шприц-ручку без помаранчевого захисного ковпачка протягом більше 5хвилин - це може призвести до випарування лікарського засобу. |
| |
Наявність краплі рідини на кінці голки або жовтого захисного пристрою є нормальним явищем. Не слід скручувати, згинати або відкручувати помаранчевий захисний ковпачок; Не слід надягати помаранчевий ковпачок назад на попередньо наповнений шприц-ручку; Не слід триматися пальцями за жовтий захисний пристрій. | |
Важливо: Не слід знімати помаранчевий захисний ковпачок з попередньо наповненого шприца-ручки, поки Ви не будете готові робити ін’єкцію. | |
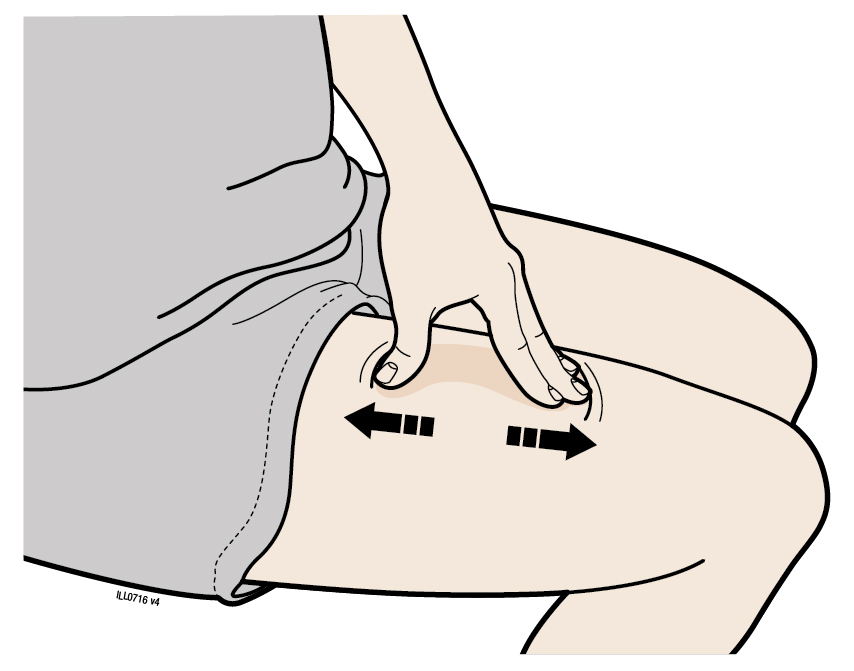
В | Розтягніть або затисніть місце введення для створення твердої поверхні. |
Метод розтягування
Сильно розтягніть шкіру рухом великого пальця та інших пальців в різні сторони, створюючи ділянку шириною приблизно 2дюйми (5см). АБО Метод затискання
Міцно затисніть шкіру між великим пальцем та іншими пальцями, створюючи ділянку шириною приблизно 2дюйми (5см). | |
Важливо:Важливо тримати шкіру розтягнутою або затиснутою під час введення препарату. | |
Етап 3. Введення | ||||
А | Тримайте розтягнуту або затиснуту шкіру, щоб поверхня була тверда. Зніміть захисний ковпачок, прикладіть попередньо наповнений шприц-ручку жовтим захисним пристроєм до шкіри під кутом 90°. | |||
Жовтий захисний пристрій |
| |||
Вірно | Невірно | |||
Не слідна цьому етапі торкатися сірої пускової кнопки |
| |||
В | Сильно ПРИТИСНІТЬ попередньо наповнений шприц-ручку до шкіри, щоб він був нерухомий. | |||
 |
| |||
Важливо: Ви маєте постійно притискати шприц-ручку, протене слідторкатися сірої пускової кнопки, поки Ви не будете готові зробити ін’єкцію. | ||||
С | Коли Ви будете готові зробити ін’єкцію, натисніть на сіру пускову кнопку. Ви почуєте клацання. | |
 | ||
D | Продовжуйте ПРИТИСКАТИ до шкіри. Потім ПІДНІМІТЬ великий палець. Введення може зайняти приблизно 15 секунд. | |||
 |
Коли ін’єкція завершиться, віконце стане жовтого кольору. | |||
| ПРИМІТКА.Після того, як Ви знімете попередньо наповнений шприц-ручку зі шкіри, голка автоматично сховається. | |||
Етап 4. Завершення | |
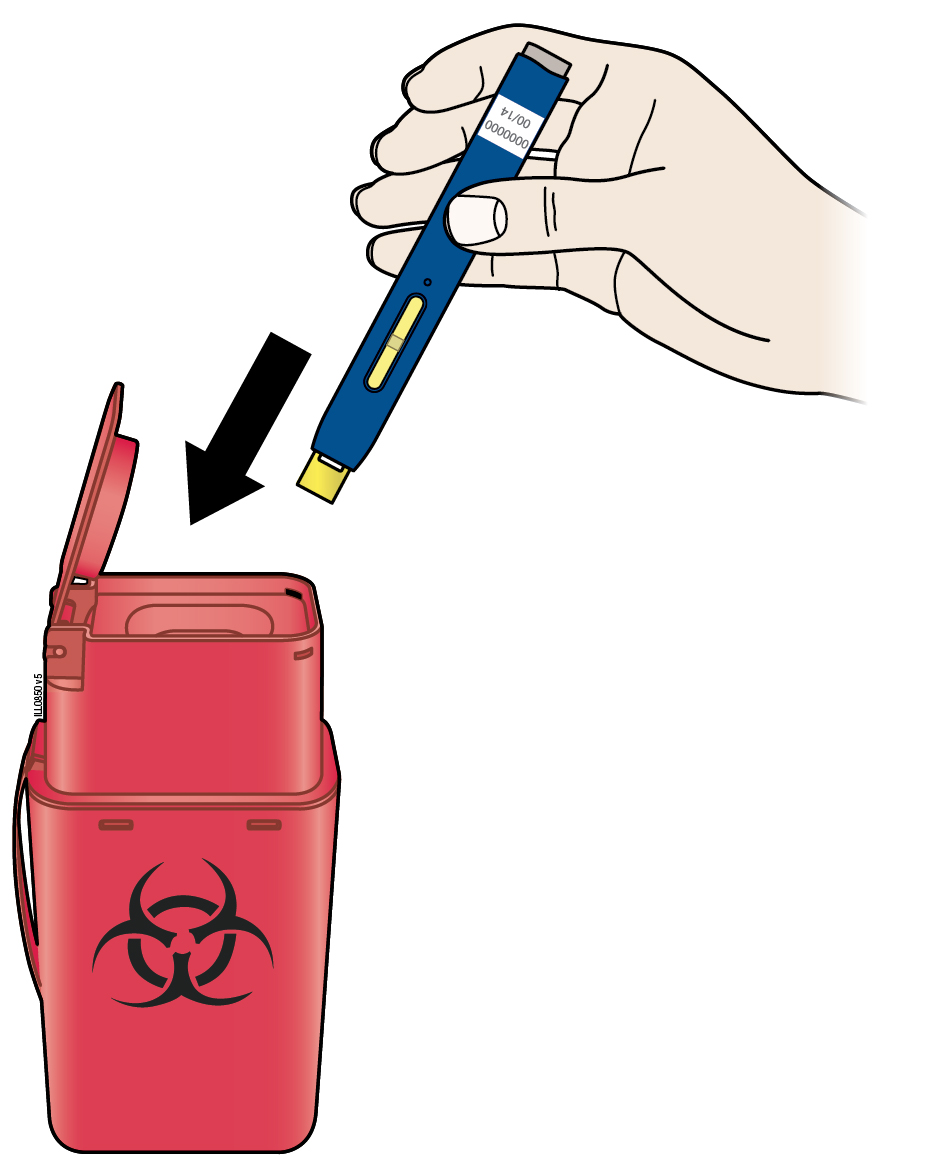
А | Викиньте використаний попередньо наповнений шприц-ручку та помаранчевий захисний ковпачок. |
Викиньте використаний попередньо наповнений шприц-ручку та помаранчевий захисний ковпачок у контейнер для утилізації гострих предметів. Дізнайтесь у Вашого лікаря, як потрібно належним чином утилізувати шприц. Можуть існувати місцеві настанови стосовно утилізації. Зберігайте використаний попередньо наповнений шприц-ручку та контейнер для утилізації гострих предметів у недоступному та непомітному для дітей місці. Не слід повторно використовувати попередньо наповнений шприц-ручку; Не сліднадягати назад захисний ковпачок на попередньо наповнений шприц-ручку або триматися пальцями за жовтий захисний пристрій; Не слід піддавати попередньо наповнений шприц-ручку чи контейнер для утилізації гострих предметів повторній переробці або викидати їх разом з побутовими відходами. | |
В | Огляньте місце введення. |
Якщо виступає кров, притисніть ватний тампон або марлеву серветку до місця введення. НЕ СЛІД розтирати місце введення. Накладіть пластир у разі необхідності. | |
Діти.
Безпека та ефективність застосування лікарського засобу Репата дітям (віком до 18років) за показанням первинна гіперхолестеринемія та змішана дисліпідемія не встановлювалися. Немає жодних даних.
Безпека та ефективність застосування лікарського засобу Репата дітям віком до 12років за показанням гомозиготна сімейна гіперхолестеринемія не встановлювалися. Немає жодних даних.
Передозування.
Жодні побічні реакції не спостерігалися в дослідженнях на тваринах при експозиціях, що майже у 300разів перевищували експозиції у пацієнтів, що приймають лікарський засіб Репата в дозі 420мг 1раз на місяць.
Специфічного лікування передозування лікарським засобом Репата немає. У разі передозування пацієнта слід лікувати симптоматично та вжити підтримувальних заходів, якщо необхідно.
Побічні реакції.
Резюме профілю безпеки
Найчастішими побічними реакціями під час опорних досліджень, в рекомендованих дозах, були ринофарингіт (7,4%), інфекція верхніх дихальних шляхів (4,6%), біль у спині (4,4%), артралгія (3,9%), грип (3,2%) та реакції у місці введення (2,2%). Профіль безпеки в популяції з гомозиготною сімейною гіперхолестеринемією узгоджувався з профілем, що спостерігався в популяції з первинною гіперхолестеринемією та змішаною дисліпідемією.
Зведена таблиця побічних реакцій
Побічні реакції, про які повідомлялося в опорних контрольованих клінічних дослідженнях та спонтанних повідомлень, класифіковано за системами органів та частотою у таблиці8 нижче з використанням такого умовного поділу: дуже часто (≥1/10), часто (≥1/100 і <1/10), нечасто (≥1/1000 і <1/100), рідко (≥1/10000 і <1/1000) та дуже рідко (<1/10000).
Таблиця8. Побічні реакції при застосуванні лікарського засобу Репата
Системи органів за класифікацією MedDRA | Побічні реакції | Частота |
Інфекції та інвазії | Грип | Часто |
Ринофарингіт | Часто | |
Інфекція верхніх дихальних шляхів | Часто | |
Порушення з боку імунної системи | Підвищена чутливість | Часто |
Висип | Часто | |
Кропив’янка | Нечасто | |
Порушення з боку шлунково-кишкового тракту | Нудота | Часто |
Порушення з боку шкіри та підшкірних тканин | Ангіоневротичний набряк | Рідко |
Порушення з боку кістково-м’язової системи та сполучної тканини | Біль у спині | Часто |
Артралгія | Часто | |
Загальні порушення та стан місця введення | Реакції у місці введення1 | Часто |
Грипоподібне захворювання | Нечасто |
1Див. розділ «Опис окремих побічних реакцій».
Опис окремих побічних реакцій
Реакції у місці введення
Найбільш частими реакціями у місцях введення були утворення синців у місці введення почервоніння, крововилив, біль у місці введення та набряк.
Діти
Досвід застосування лікарського засобу Репата дітям обмежений. У клінічні дослідження було включено 14пацієнтів віком ≥12 і <18років з гомозиготною сімейною гіперхолестеринемією. Різниця у безпеці між пацієнтами-підлітками та дорослими з гомозиготною сімейною гіперхолестеринемією не спостерігалася.
Безпека та ефективність застосування лікарського засобу Репата дітям з первинною гіперхолестеринемією та змішаною дисліпідемією не встановлювалися.
Пацієнти літнього віку
Із 18546 пацієнтів, яким застосовували лікарський засіб Репата у подвійно сліпих клінічних дослідженнях, 7656 (41,3%) були віком ≥65років, тоді як 1500 (8,1%) були віком ≥75років. Між цими пацієнтами та молодшими пацієнтами жодної загальної різниці у безпеці або ефективності не спостерігалося.
Імуногенність
У клінічних дослідженнях 0,3% пацієнтів (48 з 17992 пацієнтів), яким було введено принаймні одну дозу лікарського засобу Репата, мали позитивний результат випробування на вироблення зв’язуючих антитіл. Пацієнти, які мали позитивну реакцію сироватки крові на зв’язуючі антитіла, далі оцінювалися на нейтралізуючі антитіла, і жодний з пацієнтів не мав позитивного результату випробування на нейтралізуючі антитіла. Присутність анти-еволокумаб-зв’язуючих антитіл не впливала на фармакокінетичний профіль, клінічну відповідь або безпеку лікарського засобу Репата.
Повідомлення про підозрювані побічні реакції
Важливо повідомляти про підозрювані побічні реакції після реєстрації лікарського засобу. Це дозволяє постійно контролювати співвідношення користь/ризик лікарського засобу. Звертаємося до працівників охорони здоров’я із проханням повідомляти про будь-які підозрювані побічні реакції згідно з чинним законодавством у сфері фармаконагляду.
Термін придатності.
3роки.
Умови зберігання .
Зберігати в холодильнику (2-8°C). Не заморожувати.
Зберігати в оригінальній картонній упаковці для захисту від світла.
Після виймання з холодильника лікарський засіб Репата можна зберігати при кімнатній температурі (до 25°C) в оригінальній картонній упаковці протягом 1місяця.
Зберігати в недоступному для дітей місці.
Несумісність.
За відсутності досліджень сумісності цей лікарський засіб не слід змішувати з іншими лікарськими засобами.
Упаковка.
Репата, 140мг, розчин для ін’єкцій у попередньо наповненому шприці-ручці
По 1мл розчину в попередньо наповненому шприці-ручці одноразового використання, виготовленому зі скла Ітипу, з голкою із нержавіючої сталі 27-го калібру.
Ковпачок голки попередньо наповненого шприца-ручки виготовлено з сухого натурального каучуку (похідної латексу, див. розділ «Особливості застосування»).
По 1 або по 2попередньо наповнені шприци-ручки у картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
Амджен Європа Б.В.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Мінервум 7061, 4817 ZK, Бреда, Нідерланди.
Виробник.
Амджен Текнолоджі (Айеленд) Анлімітед Компані.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Поттері Роуд, Дан Лері, Ко. Дублін, Ірландія.
Дата останнього перегляду.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО








 15 Секунд
15 Секунд