ФЕЙБА


ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ФЕЙБА
(FEIBA)
Склад:
діюча речовина:білок плазми людини з активністю, шунтуючою інгібітори до фактора коагуляції крові людини VIII (Factor VIII Inhibitor Bypassing Activity);
1 флакон з порошком містить:
білок плазми людини - 200-600 мг з активністю, шунтуючою інгібітори до фактора коагуляції крові людини VIII, 500 Од.;
білок плазми людини - 400-1200 мг з активністю, шунтуючою інгібітори до фактора коагуляції крові людини VIII, 1000 Од.;
білок плазми людини - 1000-3000 мг з активністю, шунтуючою інгібітори до фактора коагуляції крові людини VIII, 2500 Од.
Після відновлення вмісту флакона за допомогою розчинника, що додається, активність препарату ФЕЙБА в кожному флаконі становить:
50 одиниць/мл (для дозування 2500 Од./50 мл, 1000 Од./20 мл та 500 Од./10 мл) або
25 одиниць/мл (для дозування 500 Од./20 мл).
Активність препарату ФЕЙБА виражається в умовних одиницях шунтуючої активності фактора VIII.
Одна одиниця активності визначається як кількість препарату ФЕЙБА, що скорочує активований частковий тромбопластиновий час (АЧТЧ) інгібітора фактора коагуляції крові людини VIII у високому титрі референтної плазми до 50% від холостої проби.
ФЕЙБА містить фактори згортання II, IX та X переважно в неактивованій і фактор VII переважно в активованій формі. Окрім того, наявні 1-6 одиниць антигену фактора згорання VIII (FVIII C: Ag) на 1 мл.
допоміжні речовини: натрію хлорид, натрію цитрат;
флакон з розчинником містить воду для ін’єкцій.
Лікарська форма. Порошок та розчинник для розчину для ін’єкцій.
Основні фізико-хімічні властивості: порошок або крихка речовина від білого до майже білого або блідо-зеленого кольору.
Фармакотерапевтична група. Антигеморагічні лікарські засоби. Фактори згортання крові. Білки з активністю, шунтуючою інгібітори до фактора крові людини VIII.
Код АТС В02В D03.
Фармакологічні властивості
Механізм дії
Згортання крові відбувається за рахунок активації фактора згортання Х і його перетворення на Ха, який разом із кофактором Va каталізує утворення тромбіну з протромбіну. Утворення достатньої кількості фактора Ха зазвичай вимагає комплексу факторів VIIIa та IXa. У людей (часто тих, хто хворіє на гемофілію А і В) можуть утворюватися інгібітори до факторів згортанні VIII або IX в процесі замісної терапії за допомогою факторів VIII або IX, що попереджує утворення комплексу, який каталізує утворення фактора Xа. ФЕЙБА призводить до утворення фактора Xa та тромбіну без участі комплексу факторів VIIIa-IXa, таким чином обходячи інгібуючу дію інгібітора фактора VIII (або фактора ІХ).
Клінічні дослідження
Дані на підтримку ефективності і безпеки застосування препарату ФЕЙБА отримано в трьох проспективних клінічних дослідженнях, в яких застосовували попередні версії препарату ФЕЙБА. Місцями кровотеч були суглоби - 117, м’язи - 29 та шкіра й слизові оболонки - 4.
Перше дослідження (Sjamsoedin L.J.M, 1981) - рандомізоване, подвійно сліпе, контрольоване випробування, в якому порівнювали ранню версію препарату ФЕЙБА, в якій не проводилася інактивація вірусів, із європейським неактивованим концентратом протромбінового комплексу. Медіана віку пацієнтів становила 12 років, межі - 3-37 років. У дослідженні Hilgartner 1983 три пацієнти страждали на гемофілію В із інгібіторами і в двох пацієнтів розвинулися набуті інгібітори до фактора VIII. Пацієнти були віком понад 4 роки. Загалом було залучено 15 пацієнтів із гемофілією А та інгібіторами до фактора VIII. Кожного пацієнта залежно від наступної кровотечі в певному місці рандомізували в групу лікування одним або двома препаратами. Загалом було проліковано 150 кровотеч. Препарат ФЕЙБА вводили в дозі 88 Од./кг (1-2 дози), а концентрат протромбінового комплексу - в дозі 48 Од. фактора ІХ/кг (1-2 дози). Згідно з оцінкою дослідника препарат ФЕЙБА був ефективним або частково ефективним у 64% епізодів у порівнянні з 52% епізодів, при яких використовували концентрат протромбінового комплексу.
Дані з двох інших неконтрольованих досліджень із залученням пацієнтів із гемофілією А або В із інгібіторами узагальнено в таблиці 1.
Таблиця 1
Результати неконтрольованих клінічних досліджень
Параметри дослідження | Hilgartner 1983 | Hilgartner 1990 | |
Застосований препарат ФЕЙБА | Без інактивації вірусів | Обробка гарячою парою | |
Доза | 50 Од./кг | 50-75 Од./кг | |
Кратність | кожні 12 годин | кожні 6-12 годин | |
Тривалість терапії | 3 дні | 1-5 доз | |
Кількість пацієнтів | 49 | 41 | |
Число кровотеч | 165 | 106* | |
% контрольованих епізодів кровотеч | 93% | 88% | |
* Піддається обчисленню. | |||
У дослідженні Hilgartner 1983 місцями кровотеч були суглоби - 102, м’язи/м’які тканини - 33, слизові оболонки - 20, операційні - 4, центральна нервова система - 3, ніс - 1, грудна стінка - 1 та слуховий канал -1. У дослідженні Hilgartner 1990 місцями кровотеч були суглоби - 73, м’язи/м’які тканини - 16, слизові оболонки - 9, операційні - 7, центральна нервова система - 1 та ще 12 епізодів кровотеч не були включені до аналізу внаслідок відхилень від протоколу дослідження. Більшість пацієнтів страждали на гемофілію А з інгібіторами: 44 учасники дослідження Hilgartner 1983 та всі учасники дослідження Hilgartner 1990.
Профілактика препаратом ФЕЙБА оцінювалася в глобальному багатоцентровому дослідженні за участю пацієнтів із гемофілією А або В із високим титром або низьким титром інгібіторів, що рефрактерні до лікування FVIII або FIX. Дослідження було рандомізоване, відкрите, з паралельними групами для порівняння профілактики із лікуванням препаратом ФЕЙБА «на вимогу». Пацієнти, які були рандомізовані в групу з профілактики, отримували 70-100 Од./кг через день. Якщо виникав епізод кровотечі, препарат ФЕЙБА застосовували на розсуд лікаря в обох групах лікування, враховуючи настанови з дозування за протоколом. Тривалість дослідження становила 12 місяців.
Тридцять шість пацієнтів розпочали участь в дослідженні, 17 з них були рандомізовані в групу з профілактики, а 19 - в групу лікування «на вимогу». Всі були включені в аналіз всіх рандомізованих пацієнтів. Дві групи були подібними за вихідними демографічними даними та характеристиками захворювання. Всі пацієнти були чоловічої статі. Медіана віку становила 23,5 роки, межі - 7-56 років.
Початкова кінцева точка - річна частота кровотеч в групі з профілактики у порівнянні з групою лікування «на вимогу». Профілактика за допомогою препарату ФЕЙБА значно знижувала річну частоту кровотеч (див. таблицю 2). Результати також були підтверджені негативною моделлю змішаних біномінальних ефектів. Більшість (79%) кровотеч лікували за допомогою 1-2 інфузій препарату ФЕЙБА. Гемостатична ефективність оцінена як відмінна або добра в 87% епізодів кровотеч, що виникли протягом 24 годин, в обох групах. Більшість кровотеч в обох групах уражали суглоби. Застосування препарату ФЕЙБА з профілактичною метою значно знижувало як кровотечі в суглоби, так і позасуглобові, а також спонтанні й травматичні кровотечі.
Профілактика препаратом ФЕЙБА також значно підвищувала загалом інтервал між кровотечами на медіану в 9 днів (таблиця 2). Щодо інтервалу між кровотечами в суглоби спостерігалася тенденція на користь профілактики.
Таблиця 2
Результати клінічного дослідження профілактики препаратом ФЕЙБА (090701). Аналіз ефективності на вибірці всіх рандомізованих пацієнтів
Змінна величина | Профілактика (n=17) | «На вимогу» (n=19) | Різниця р-значення |
Кількість пацієнтів із кровотечею, | 14 | 19 | |
епізоди (%) | (82%) | (100%) | |
Кількість епізодів кровотеч | |||
Всього | 196 | 629 | |
Суглоби | 171 | 572 | |
Інші локалізації, окрім суглобів | 25 | 57 | |
Медіана річної інтенсивності кровотеч | |||
Всього | 7,9 | 28,7 | Р=0,00031 |
Суглоби | 6,0 | 22,9 | P=0,00061 |
Інші локалізації, окрім суглобів | 0,5 | 2,9 | P=0,02271 |
Спонтанні | 5,6 | 18,9 | P=0,00081 |
Внаслідок травми | 2,5 | 4,7 | P=0,01991 |
Інтервал між кровотечами | |||
Медіана днів | |||
Всього | 20,0 | 11,0 | P=0,00972 |
Суглоби | 20,0 | 12,0 | |
Інші локалізації, окрім суглобів | Не встановлено | Не встановлено |
1 2-сторонній двовибірковий t-тест середньої перетвореної річної частоти кровотеч. Дані були перетворені в нормальний розподіл за допомогою X’=SQRT (X+0.5), де Х - кровотеч/рік.
2 2-сторонній тест Манна - Уітні (критерій рангової суми Уілкоксона) для різниці медіан.
Дані відсутні.
Клінічні характеристики
Показання.
Лікарський засіб ФЕЙБА показаний для рутинної профілактики, контролю епізодів спонтанних кровотеч та застосування при хірургічних втручаннях у пацієнтів із гемофілією А або В з інгібіторами до факторів коагуляції крові людини.
Протипоказання.
Застосування препарату ФЕЙБА протипоказане пацієнтам, у яких підтверджено нормальні механізми згортання крові. Препарат не слід застосовувати пацієнтам зі значними ознаками дисемінованого внутрішньосудинного згортання (ДВЗ) або фібринолізу. Пацієнтам із попереднім або заключним діагнозом ішемічної хвороби серця, а також пацієнтам із гострим тромбозом та/або емболією застосування препарату ФЕЙБА показане у випадках геморагічних ускладнень, що загрожують життю.
Препарат ФЕЙБА протипоказаний при хірургічних втручаннях на серці з проведенням серцево-легеневого шунтування або процедурах, що передбачають екстракорпоральну мембранну оксигенацію (ЕКМО), з причини високого ризику тромботичних ускладнень.
Препарат ФЕЙБА не слід застосовувати пацієнтам з гіперчутливістю до препарату, якщо є доступні терапевтичні альтернативи препарату ФЕЙБА.
Див. розділ «Особливості застосування».
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Застосування антифібринолітичних препаратів, таких як транексамова кислота та амінокапронова кислота, в комбінації з препаратом ФЕЙБА не рекомендовано з причини підвищеного ризику тромбоемболічних ускладнень. Якщо показане лікування як препаратом ФЕЙБА, так і антифібринолітичними препаратами, їх слід застосовувати з інтервалом щонайменше 12 годин.
Не проводилося жодних адекватних і належно контрольованих досліджень комбінованого або послідовного застосування препарату ФЕЙБА і рекомбінантного фактора згортання VIIa, фібринолітиків та еміцизумабу.
У разі супутнього застосування rFVIIa, згідно з доступними даними, отриманимиin vitro, та клінічними спостереженнями, можлива їхня потенційна взаємодія (що, ймовірно, призведе до виникнення такого побічного ефекту, як тромбоемболічне ускладнення).
Клінічний досвід, отриманий в ході клінічного дослідження еміцизумабу, свідчить про те, що потенційна взаємодія з лікарськими засобами може існувати для еміцизумабу при застосування препарату ФЕЙБА як частини схеми лікування при проривних кровотечах (див. розділи «Особливості застосування», «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Побічні реакції» в інструкції на препарат еміцизумаб (Hilgartner M.W, 1983)).
Існує теоретичний ризик відсутності розвитку активної імунної відповіді на живу атенуйовану вакцину внаслідок перешкоджання циркулюючих антитіл до вірусу вакцини. Антитіла будь-якого походження (трансплацентарного, після трансфузій) можуть перешкоджати реплікації організму вакцини та призвести до слабкої відповіді на вакцину чи її відсутності (також відомої як «неефективність вакцини»). Невідомо, чи цей тип взаємодії може виникнути при рівнях антитіл, наявних при пасивній передачі, пов’язаній із застосуванням препарату ФЕЙБА. Якщо відповідь на вакцину порушена, можуть бути потрібні додаткові дослідження і/або ревакцинація.
Особливості застосування.
Тромбоемболічні ускладнення
Тромбоемболічні ускладнення, в тому числі синдром дисемінованого внутрішньосудинного згортання (ДВЗ), венозний тромбоз, легенева емболія, інфаркт міокарда та інсульт, виникали в процесі лікування препаратом ФЕЙБА.
Деякі з цих ускладнень виникали при застосуванні доз понад 200 Од./кг/добу або у пацієнтів із іншими факторами ризику (включаючи ДВЗ, прогресуючі стадії атеросклерозу, пошкодження розчавленням або септицемію) щодо тромбоемболічних ускладнень. Супутнє лікування за допомогою рекомбінантного фактора VIIa (rFVIIa) може підвищувати ризик розвитку тромбоемболічних ускладнень. Можливу наявність таких факторів ризику завжди слід брати до уваги у пацієнтів із вродженою та набутою гемофілією.
Препарат ФЕЙБА слід застосовувати із особливою обережністю пацієнтам із ризиком ДВЗ, артеріальним або венозним тромбозом.
Про тромботичну мікроангіопатію (ТМА) не повідомлялось в ході клінічних досліджень препарату ФЕЙБА. Про випадки ТМА повідомлялося в клінічному випробувані еміцизумабу, в якому пацієнти отримували препарат ФЕЙБА як частину схеми лікування з приводу проривної кровотечі (див. розділи «Особливості застосування» та «Побічні реакції» в інструкції на препарат еміцизумаб (інформація про препарат еміцизумаб, затверджена в Австралії)). Безпека та ефективність застосування препарату ФЕЙБА щодо проривної кровотечі у пацієнтів, які отримують еміцизумаб, не встановлені. Слід враховувати користь і ризики у разі, коли є необхідність застосування препарату ФЕЙБА пацієнтам, які отримують профілактику еміцизумабом. Якщо прийнято рішення про необхідність лікування препаратом ФЕЙБА пацієнтів, які отримують еміцизумаб, лікар повинен проводити ретельне спостереження за станом таких пацієнтів.
При перших ознаках або симптомах тромбоемболічних ускладнень слід негайно припинити інфузію та розпочати відповідні діагностичні та лікувальні заходи.
Не слід перевищувати разову дозу 100 Од./кг маси тіла та добову дозу 200 Од./кг маси тіла, якщо тільки цього не вимагає тяжкість кровотечі та є обґрунтування застосування вищих доз.
При використанні з метою зупинки кровотечі препарат слід застосовувати тільки протягом того періоду часу, протягом якого це абсолютно необхідно для досягнення терапевтичної цілі.
Алергічні реакції
Препарат ФЕЙБА може стати причиною реакцій гіперчутливості алергічного типу, що включають кропив’янку, ангіоневротичний набряк, прояви з боку травного тракту, бронхоспазм та артеріальну гіпотензію. Ці реакції можуть бути тяжкими і можуть бути системними (наприклад, анафілаксія з кропив’янкою та ангіоневротичним набряком, бронхоспазм, гемодинамічний шок). Також повідомлялося про інші реакції на введення, такі як пропасниця, гарячка й гіпертензія.
При перших ознаках чи симптомах реакції на інфузію/ гіперчутливості слід припинити введення препарату ФЕЙБА і розпочати надання відповідної медичної допомоги.
При розгляді можливості повторного введення препарату ФЕЙБА пацієнтам із відомою гіперчутливістю до препарату або підозрою на неї слід ретельно зважити користь та ризик повторного введення, враховуючи тип відомої гіперчутливості пацієнта чи підозри на неї (алергічний або неалергічний), включаючи потенційну лікувальну та/або профілактичну терапію або альтернативні терапевтичні засоби.
Вірусна безпека
Препарат ФЕЙБА виготовлений із плазми крові людини. Препарати, виготовлені з плазми людини, можуть нести ризик трансмісії інфекційних агентів, таких як віруси, агенти варіантної хвороби Кройцфельда - Якоба (вХКЯ) і теоретично - агент хвороби Кройцфельда - Якоба (ХКЯ).
Стандартні заходи попередження інфекцій внаслідок використання препаратів - похідних плазми передбачають:
- відбір донорів;
- скринінг індивідуальних донацій і пулів плазми на специфічні маркери інфекцій;
- включення ефективних кроків виробництва з метою інактивації/усунення вірусів.
Процес виробництва препарату ФЕЙБА включає два етапи (обробка гарячою парою та нанофільтрація).
Незважаючи на це, при застосуванні препаратів - похідних плазми не можна повністю виключити вірогідність трансмісії інфекційних агентів. Це також стосується невідомих або нових вірусів та інших патогенів.
Застережні заходи, вжиті щодо препарату ФЕЙБА, вважаються ефективними проти оболонкових вірусів, таких як вірус імунодефіциту людини (ВІЛ), вірус гепатиту В (HBV) та вірус гепатиту С (HСV). Вони можуть мати обмежене застосування проти необолонкових вірусів, таких як вірус гепатиту А (HАV) і парвовірус В19. Інфекція, викликана парвовірусом B19, може бути небезпечною для вагітних жінок (інфекція плода) та людей з імунодефіцитом чи збільшеним еритропоезом (наприклад з гемолітичною анемією).
Слід розглянути проведення належної вакцинації (проти гепатиту А та В) пацієнтів, які отримують постійне/повторне лікування препаратом ФЕЙБА.
Рекомендується щоразу під час введення пацієнту препарату ФЕЙБА реєструвати назву та номер серії препарату для відстеження зв’язку між станом пацієнта та серією препарату.
Застосування при порушенні функції печінки
Безпека та ефективність застосування препарату ФЕЙБА пацієнтам із порушенням функції печінки не встановлені. Слід з обережністю застосовувати його таким пацієнтам.
Обмеження щодо натрію
Кількість натрію, яка отримується з максимальною добовою дозою, може перевищити рекомендовану добову норму аліментарного натрію для пацієнтів, які дотримують дієти з низьким вмістом натрію. У таких пацієнтів кількість натрію, отриманого із препаратом, слід обчислювати і враховувати при визначенні споживання натрію з їжею.
- ФЕЙБА 500 Од./1000 Од. містить близько 80мг натрію (розрахованого) у флаконі.
- ФЕЙБА 2500 Од. містить близько 200 мг натрію (розрахованого) у флаконі.
Моніторинг терапії та клінічної ефективності
Не слід перевищувати разові дози 100 Од./кг маси тіла та добові дози 200 Од./кг маси тіла. Стан пацієнтів, які отримують разові дози в кількості 100 Од./кг маси тіла, слід контролювати щодо розвитку ДВЗ, гострого коронарного синдрому й ознак і симптомів інших тромботичних чи тромбоемболічних ускладнень. Високі дози препарату ФЕЙБА слід застосовувати тільки протягом періоду, необхідного для зупинки кровотечі.
У разі значних клінічних змін артеріального тиску, частоти пульсу, респіраторного дистресу, болю в грудній клітці й кашлю слід негайно припинити інфузію й розпочати належні діагностичні й лікувальні заходи. Лабораторними ознаками ДВЗ є зниження рівня фібриногену, знижена кількість тромбоцитів і/або наявність продуктів деградації фібрину та фібриногену (ПДФ). Іншими ознаками ДВЗ є значно подовжений тромбіновий час, протромбіновий час або частковий тромбопластиновий час.
Внаслідок факторів, специфічних для кожного окремого пацієнта, відповідь на шунтуючий агент може відрізнятися і в кожній окремій ситуації при кровотечі пацієнти, які виявляють недостатню відповідь на один препарат, можуть демонструвати відповідь на інший препарат. У разі недостатньої реакції на один шунтуючий агент слід розглянути застосування іншого агента.
Аналізиіn vitro з метою контролю ефективності, такі як АЧТЧ, час згортання цільної крові й тромбоеластограма (ТЕГ) можуть не демонструвати кореляції з клінічним покращенням. Таким чином, намагання нормалізувати ці показники шляхом підвищення дози препарату ФЕЙБА можуть бути неуспішними та наполегливо не рекомендуються, оскільки існує потенційна небезпека розвитку ДВЗ при передозуванні.
У разі неадекватної відповіді на лікування препаратом рекомендовано контролювати рівень тромбоцитів, оскільки вважається, що достатня кількість функціонально інтактних тромбоцитів необхідна для ефективності препарату.
Застосування препарату ФЕЙБА у пацієнтів із інгібіторами може призвести до початкового «анамнестичного» зростання рівнів інгібіторів. При подальшому застосування препарату ФЕЙБА рівень інгібіторів із часом може знизитися.
Застосування пацієнтам літнього віку
Дані відсутні.
Вплив на результати лабораторних аналізів
ФЕЙБА містить групові ізогемаглютиніни (анти-А та анти-В). Пасивна трансмісія антитіл до еритроцитарних антигенів, як-от А, В, D, може впливати на деякі серологічні дослідження на виявлення антитіл до еритроцитів, таких як антиглобуліновий тест (проба Кумбса).
Після введення високих доз препарату ФЕЙБА транзиторне підвищення пасивно переданих поверхневих антитіл до гепатиту В може призвести до хибної інтерпретації позитивних результатів серологічного дослідження.
Застосування у період вагітності або годування груддю.
Застосування у період вагітності
Препарати застосовувалися тільки обмеженою кількістю вагітних жінок і жінок репродуктивного віку без спостереження підвищення частоти вроджених вад чи інших прямих або опосередкованих впливів на плід людини. Дослідження із залученням тварин є невідповідними або ж їх недостатньо, проте наявні дані демонструють відсутність доказів підвищення частоти ураження плода.
Вплив препарату ФЕЙБА на репродукцію і розвиток не вивчався. Препарат ФЕЙБА застосовують під час вагітності тільки тоді, коли справді необхідно, враховуючи, що під час вагітності й післяпологового періоду існує підвищений ризик тромбоемболічних ускладнень та декількох ускладнень вагітності, пов’язаних із підвищеним ризиком ДВЗ.
Застосування у період годування груддю
Невідомо, чи інгредієнти препарату ФЕЙБА виділяються із грудним молоком. Безпечне застосування препарату ФЕЙБА під час годування груддю не встановлене. Слід з обережністю застосовувати препарат ФЕЙБА жінкам, які годують груддю.
Вплив на фертильність
Щодо впливу на фертильність із препаратом ФЕЙБА не проводилося жодних досліджень.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Вплив цього препарату на швидкість реакції людини при керуванні автотранспортом або іншими механізмами не було оцінено.
Спосіб застосування та дози.
Дозування
Прийнятою рекомендованою дозою препарату ФЕЙБА є від 50 до 100 Од./кг маси тіла. Однак загальна добова доза не повинна перевищувати 200 Од./кг маси тіла.
Лікування слід розпочинати і продовжувати протягом часу перебування під наглядом лікаря, який має досвід лікування розладів згортання крові.
Дозування не залежить від титру інгібіторів у пацієнта. Оскільки відповідь на лікування може відрізнятися у кожного окремого пацієнта, рекомендації з дозування мають характер настанов. Коагуляційні тести, такі як час згортання цільної крові, тромбоеластограма (ТЕГ, величина r) та АЧТЧ, зазвичай демонструють тільки незначне скорочення, і не слід проводити кореляцію між ними та клінічною ефективністю. З огляду на це зазначені тести мають обмежене значення для моніторингу ефективності лікування препаратом ФЕЙБА (див. розділ «Особливості застосування»).
У таблиці 3 наведено рекомендації з дозування препарату ФЕЙБА.
Таблиця 3
Рекомендації з дозування
Доза (одиниці/кг) | Кратність введення доз (години) | Тривалість терапії | |
Контроль і профілактика кровотеч | |||
Крововиливи в суглоби, м’язи та м’які тканини | Незначна або помірна кровотеча: 50-75 | 12 | Лікування слід продовжувати до моменту появи явних ознак клінічного покращення, таких як послаблення болю, зменшення набряку або мобілізація суглоба. Не слід перевищувати добову дозу 200Од./кг маси тіла. |
Значний крововилив у м’язи та м’які тканини (напр., ретроперитонеальний крововилив): 100 | 12 | Не слід перевищувати добову дозу 200 Од./кг маси тіла. | |
Кровотеча зі слизових оболонок | 50-100 | 6 | Необхідний ретельний нагляд за пацієнтом (видиме місце кровотечі, повторні вимірювання гематокриту). Якщо кровотеча не припиняється, дозу можна підвищити до 100 Од./кг маси тіла. Не слід перевищувати добову дозу 200 Од./кг маси тіла. |
Інші тяжкі крововиливи | 100 | 12 | Тяжкий крововилив, як-от кровотеча в ЦНС, піддається ефективному лікуванню дозою 100 Од./кг маси тіла з інтервалом 12 годин. В окремих випадках препарат ФЕЙБА можна вводити з інтервалом 6 годин до досягнення явного клінічного покращення. Не слід перевищувати добову дозу 200 Од./кг маси тіла. |
Оперативне втручання | 50-100 | 6 | Не слід перевищувати добову дозу 200 Од./кг маси тіла. |
Планова профілактика | 70-100 | Через день | Дозу коригують з урахуванням клінічної відповіді пацієнта. Не слід перевищувати добову дозу 200 Од./кг маси тіла. |
Швидкість введення
Не перевищувати швидкість ін’єкції/інфузії понад 2 одиниці препарату ФЕЙБА на кілограм маси тіла на хвилину.
Приготування відновленого розчину
Загальні вказівки: використовуйте асептичну техніку
Препарат ФЕЙБА слід відновлювати безпосередньо перед застосуванням. Після відновлення препарат слід використати не пізніше ніж через 3 години, оскільки він не містить протимікробних консервантів. Відновлений розчин не зберігати в холодильнику. Не використовуйте розчини, які є мутними або містять включення. Будь-який невикористаний розчин слід належним чином утилізувати.
Відновлення порошку для ін’єкцій
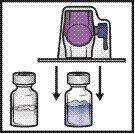
1. Нагрійте флакон з розчинником (вода для ін’єкцій) до кімнатної температури (15-25 °C), наприклад, на водяній бані протягом кількох хвилин (максимум 37°C).
2. Зніміть захисні ковпачки з флакона препарату ФЕЙБА та флакона з розчинником і дезінфікуйте гумові пробки на обох флаконах. Поставте флакони на плоску поверхню.
3. Відкрийте упаковку з пристосуванням для розведення БАКСДЖЕКТ ІІ Хай Флоу, знявши паперову кришку, не торкаючись пристосування всередині (рисунок А). Не виймайте пристосування з упаковки.
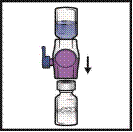
4. Переверніть упаковку та введіть прозоре пластикове вістря через пробку флакона з розчинником (рисунок Б). Візьміть упаковку за її край та вийміть з неї пристосування БАКСДЖЕКТ ІІ Хай Флоу (рисунок В). Не знімайте синій ковпачок з пристосування БАКСДЖЕКТ ІІ Хай Флоу.
5. Із пристосуванням БАКСДЖЕКТ ІІ Хай Флоу, під’єднаним до флакона з розчинником, переверніть систему догори дном так, щоб флакон із розчинником опинився зверху над пристосуванням. Введіть фіолетове пластикове вістря через пробку флакона із препаратом ФЕЙБА. Вакуум спричинить вливання розчинника у флакон із препаратом ФЕЙБА (рисунок Г).
6. Круговими рухами злегка збовтайте вміст до повного розчинення всіх речовин. Переконайтеся, що препарат ФЕЙБА повністю розчинився; в іншому випадку діюча речовина не пройде через фільтр пристосування.
Рисунок А | Рисунок Б | Рисунок В |
|
|
|
Болюсне введення/ інфузія
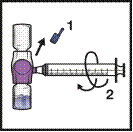
1. Зніміть синій ковпачок з пристосування БАКСДЖЕКТ ІІ Хай Флоу. Візьміть шприц і під’єднайте його до пристосування БАКСДЖЕКТ ІІ Хай Флоу (НЕ ЗАПОВНЮЙТЕ ШПРИЦ ПОВІТРЯМ) (рисунок Ґ).
2. Переверніть систему догори дном (так, щоб флакон із препаратом ФЕЙБА знаходився зверху). Наберіть розчин препарату ФЕЙБА в шприц, повільно відтягуючи назад плунжер шприца (рисунок Д).
3. Від’єднайте шприц.
4. Повільно введіть розчин внутрішньовенно за допомогою пристосування з голкою-метеликом (або за допомогою одноразової голки).
Рисунок Г
| Рисунок Ґ
| Рисунок Д
|
Діти.
Обмежений досвід застосування дітям віком до 6 років. Такий самий режим дозування, як у дорослих, повинен бути пристосований до клінічного стану дитини.
Передозування.
Деякі тромбоемболічні ускладнення, про які повідомлялося, виникали при застосуванні доз понад 200 Од./кг. В таких випадках слід негайно припинити застосування препарату та розпочати належне лікування.
Побічні реакції.
Побічні реакції, що спостерігалися в ході клінічних досліджень
Про побічні реакції, представлені в таблиці 4, було повідомлено в оригінальних дослідженнях препарату ФЕЙБА (Hilgartner 1983, 1990), що застосовувався з метою лікування епізодів кровотеч у пацієнтів із гемофілією А і В із інгібіторами до факторів згортання VIII або IX, та рандомізованому проспективному дослідженні з профілактики (090701), де порівнювали профілактичне застосування із лікуванням «на вимогу».
Таблиця 4
Побічні реакції, отримані в ході клінічних досліджень
Клас системи органів | Термін за Медичним словником термінів, що регламентують діяльність (версія 18.0) | Частота виникнення | Відносна частота (відсотки), n=36 |
З боку крові та лімфатичної системи | Підвищення титру інгібіторів (анамнестична відповідь)*,a | Невідомо | - |
З боку імунної системи | Гіперчутливістьв | Часто | 1/36 (2,8) |
З боку нервової системи | Сонливість* Запамороченняб Дизгевзія* Головний більв | Невідомо Часто Невідомо Часто | - 1/36 (2,8) - 1/36 (2,8) |
Судинні порушення | Гіпотензіяв | Часто | 1/36 (2,8) |
З боку респіраторної системи, органів грудної клітки та середостіння | Задишка* | Невідомо | - |
З боку шлунково-кишкового тракту | Нудота* | Невідомо | - |
З боку шкіри та підшкірної клітковини | Висипв | Часто | 1/36 (2,8) |
Загальні розлади та реакції у місці введення | Озноб* Гарячка* Біль у грудній клітці* Дискомфорт у грудях* | Невідомо Невідомо Невідомо Невідомо | - - - - |
Лабораторні показники | Позитивний результат на поверхневі антитіла до гепатиту Вв | Часто | 3/36 (8,3) |
Позначення. Частота побічних реакцій наведена згідно з такою шкалою: дуже часто (≥1/10); часто (≥1/100 - <1/10), нечасто (≥1/1000 - <1/100), рідко (≥1/10000 - <1/1000), дуже рідко (<1/10000)
* Точне визначення частоти цих побічних реакцій неможливе з огляду на наявні дані. Про побічні реакції повідомлялося тільки в оригінальних дослідженнях (Hilgartner 1983, 1990).
a Зростання титру інгібіторів (анамнестична відповідь) [не ПТ за Медичним словником термінів, що регламентують діяльність] - це зростання вже наявного титру інгібіторів, що виникає після застосування препарату ФЕЙБА (див. розділ «Особливості застосування»).
б Про побічні реакції повідомлялося в оригінальних дослідженнях (Hilgartner 1983, 1990) і дослідженнях з профілактики (090701). Наведена частота походить із дослідження з профілактики.
в Про побічні реакції повідомлялося в дослідженні з профілактики (090701). Наведена частота походить тільки із дослідження з профілактики.
Післяреєстраційні побічні реакції
Наступні побічні реакції були зареєстровані під час постмаркетингового досвіду, перераховані за термінологією MedDRA за класами систем органів, та переважним термінами у порядку тяжкості, де це можливо.
З боку крові та лімфатичної системи: дисеміноване внутрішньосудинне згортання.
З боку імунної системи: анафілактичні реакції.
З боку нервової системи: парестезії, тромботичні інсульти, емболічні інсульти.
З боку серцево-судинної системи: інфаркт міокарда, тахікардія.
Судинні порушення: тромбоз, венозний тромбоз, артеріальний тромбоз, гіпертензія, припливи.
З боку респіраторної системи, органів грудної клітки та середостіння: легенева емболія, бронхоспазм, свистяче дихання, кашель.
З боку шлунково-кишкового тракту: блювання, діарея, дискомфорт у животі.
З боку шкіри та підшкірної клітковини: ангіоневротичний набряк, кропив’янка, свербіж.
Загальні розлади та реакції у місці введення: слабкість, відчуття жару, біль у місці ін’єкції.
Реакції класу
Інші симптоми гіперчутливості до препаратів - похідних плазми включають летаргію і неспокій.
Інші побічні реакції
Інші побічні реакції, які спостерігалися в ході клінічних випробувань або в період після реєстрації, наведено нижче. У клінічних дослідженнях побічні реакції виникали з частотою до 4% при всіх інфузіях.
Тіло загалом: міалгія.
Травний тракт: підвищення печінкових ферментів.
Центральна нервова система:судоми, розлади мовлення, тривожність.
Серцево-судинна система:набряк легень.
Повідомлення про підозрювані побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення.
Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності.
Препарат - 2 роки.
Розчинник (вода для ін’єкцій (20 мл, 50 мл)) - 4 роки.
Розчинник (вода для ін’єкцій (10 мл)) - 5 років.
Умови зберігання.
Зберігати при температурі не вище 25 °С. Не заморожувати. Зберігати в оригінальній упаковці з метою захисту від світла.
Зберігати в недоступному для дітей місці.
Несумісність.
Препарат ФЕЙБА не слід змішувати з іншими медичними препаратами, окрім розчинника, зазначеного у розділі «Спосіб застосування та дози».
Як з усіма препаратами коагуляції крові, ефективність і переносимість цього препарату може знизитися при змішуванні з іншими медичними препаратами. Рекомендується промити пристрій загального венозного доступу відповідним розчином, наприклад ізотонічним сольовим розчином, до і після введення препарату ФЕЙБА.
Фактори коагуляції, отримані з плазми крові людини, можуть адсорбуватися на внутрішній поверхні деяких видів пристроїв для ін’єкції/інфузії. Це може призвести до невдалого лікування. Тому з препаратом ФЕЙБА можна використовувати лише затверджені пластикові пристрої для інфузії.
Упаковка.
По 1 флакону з порошком (по 500 Од. або 1000 Од., або 2500 Од.) у комплекті з 1 флаконом розчинника (вода для ін’єкцій по 10 мл або по 20 мл для дозування 500 Од., вода для ін’єкцій по 20 мл для дозування 1000 Од. або вода для ін’єкцій по 50 мл для дозування 2500 Од.) разом з пристосуванням для розведення БАКСДЖЕКТ II Хай Флоу та набором для введення (1 одноразовий шприц, 1 одноразова голка, 1 голка-метелик) у коробці.
Категорія відпуску.
За рецептом.
Виробник.
Такеда Мануфекчурінг Австрія АГ / Takeda Manufacturing Austria AG.
Місцезнаходження виробника та його адреса місця провадження діяльності.
Індустріштрассе 67, 1221 Відень, Австрія / Industriestrasse 67, 1221 Vienna, Austria.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО