АДВЕЙТ
 від 2 °С до 8 °С. Не заморожувати
від 2 °С до 8 °С. Не заморожувати 

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
АДВЕЙТ
(ADVATE)
Склад:
діюча речовина:coagulation factor VIIІ (octocog alfa);
1 флакон містить:
250 МО* фактора коагуляції крові людини VIII рекомбінантного (рДНК)**, октокогу альфа, що після розведення становить приблизно 50 МО/мл фактора коагуляції крові людини VIII рекомбінантного, октокогу альфа;
500 МО* фактора коагуляції крові людини VIII рекомбінантного (рДНК)**, октокогу альфа, що після розведення становить приблизно 100 МО/мл фактора коагуляції крові людини VIII рекомбінантного, октокогу альфа;
1000 МО* фактора коагуляції крові людини VIII рекомбінантного (рДНК)**, октокогу альфа, що після розведення становить приблизно 200 МО/мл фактора коагуляції крові людини VIII рекомбінантного, октокогу альфа;
1500 МО* фактора коагуляції крові людини VIII рекомбінантного (рДНК)**, октокогу альфа, що після розведення становить приблизно 300 МО/мл фактора коагуляції крові людини VIII рекомбінантного, октокогу альфа;
2000 МО* фактора коагуляції крові людини VIII рекомбінантного (рДНК)**, октокогу альфа, що після розведення становить приблизно 400 МО/мл фактора коагуляції крові людини VIII рекомбінантного, октокогу альфа;
3000 МО* фактора коагуляції крові людини VIII рекомбінантного (рДНК)**, октокогу альфа, що після розведення становить приблизно 600 МО/мл фактора коагуляції крові людини VIII рекомбінантного, октокогу альфа;
допоміжні речовини:трегалоза, гістидин, гідроксиметиламінометан, натрію хлорид, кальцію хлорид, глутатіон (відновлений), полісорбат 80, манітол.
* Активність (в міжнародних одиницях) визначається з використанням хромогенної кількісної проби порівняно з внутрішнім стандартним зразком, що відповідає стандарту ВООЗ. Питома активність становить приблизно 4000 - 10000 МО/мг білка.
** Фактор коагуляції крові людини VIII виробляється за технологією рекомбінантного ДНК з клітин яєчника китайського хом’яка. В процесі посіву клітинної культури, на етапі очищення і кінцевого приготування рецептури не додаються (екзогенні) білки людського чи тваринного походження.
Лікарська форма Порошок та розчинник для розчину для ін’єкцій.
Основні фізико-хімічні властивості:розсипчастий порошок білого або майже білого кольору; після відновлення ‒ прозорий, безбарвний розчин, вільний від сторонніх включень.
Фармакотерапевтична група
Кров і кровотворні органи. Антигеморагічні засоби. Вітамін К та інші гемостатичні засоби. Фактори згортання крові. Фактор коагуляції крові VIII.Код АТС В02В D02.
Фармакологічні властивості
Комплекс фактор VIII/фактор Віллебранда складається з двох молекул (фактора VIII і фактора Віллебранда) з різними фізіологічними функціями. АДВЕЙТ містить рекомбінантний фактор коагуляції людини VIII (октоког альфа), глікопротеїн, що біологічно еквівалентний глікопротеїну фактора VIII в людській плазмі.
Октоког альфа ‒ це глікопротеїн, що складається з 2332 амінокислот з приблизною молекулярною масою 280кДа. При інфузійному введенні хворому на гемофілію октоког альфа зв’язується з ендогенним фактором Віллебранда у системі кровообігу пацієнта. Активований фактор VIII діє як кофактор для активованого фактора IX, прискорюючи перетворення фактора X на активований фактор X. Активований фактор X перетворює протромбін у тромбін. Після цього тромбін перетворює фіброген на фібрин, і формується фібриновий згусток. Гемофілія А - це пов’язаний зі статтю спадковий розлад згортання крові через знижені рівні активності фактора VIII, що спричиняє профузні кровотечі у суглобах, м’язах або внутрішніх органах, які виникають спонтанно або в результаті випадкової або хірургічної травми. Рівні фактора VIII у плазмі підвищуються завдяки замісній терапії, що дає можливість тимчасової корекції недостатності фактора VIII та зменшення рівня кровоточивості й тенденції до виникнення кровотеч.
Були зібрані дані індукції імунної толерантності (ІІТ) у пацієнтів з інгібіторами до фактору VIII. У субдослідженні 060103 за участю дітей, які до включення в дослідження не отримували лікування, IIТ-процедури в 11 таких пацієнтів були задокументовані. Був зроблений ретроспективний аналіз 30 педіатричних пацієнтів на IIТ (в дослідженні 060703). У неінтервенційному проспективному реєстрі (PASS-INT-004) задокументовано ІІТ у 44 пацієнтів дитячого віку та дорослих, 36 з яких завершили терапію ІІТ. Дані показують, що імунна толерантність може бути досягнута.
У дослідженні 060201 у 53 пацієнтів, які попередньо отримували лікування, порівнювали дві довгострокові профілактичні схеми лікування: індивідуальний фармакокінетичний режим дозування (у межах від 20 до 80 МО фактора VIII на 1 кг маси тіла з інтервалами 72 ± 6 год, n = 23) та стандартний профілактичний режим дозування (від 20 до 40 МО/кг кожні 48 ± 6 год, n = 30). Режим фармакокінетичного дозування (за певною формулою) спрямований на підтримку мінімальних рівнів фактора VIII ≥1% протягом інтервалу між дозуваннями 72 години. Дані цього дослідження вказують на те, що обидва режими профілактичного дозування є порівнянними з точки зору зниження частоти кровотечі.
Європейське медичне агентство відмовилось від зобов’язання подати результати досліджень лікарського засобу АДВЕЙТ у всіх підгрупах педіатричних пацієнтів з гемофілією А (вроджений дефіцит фактора VIII): «Індукція імунної толерантності (ІІТ) у пацієнтів з гемофілією А (вроджений дефіцит фактора VIII), які виробляли інгібітори до фактора VIII» і «Лікування та профілактика кровотечі у пацієнтів з гемофілією А (вроджений дефіцит фактора VIII)» (див. розділ «Спосіб застосування та дози» щодо інформації про застосування пацієнтам дитячого віку).
Всі фармакокінетичні дослідження лікарського засобу АДВЕЙТ були проведені за участю попередньо лікованих пацієнтів з тяжкою та помірно тяжкою гемофілією А (початковий рівень фактора VIII ≤ 2 %). Аналіз зразків плазми був проведений в центральній лабораторії за допомогою однорівневого аналізу.
Загалом 195 пацієнтів з тяжкою гемофілією А (початковий рівень фактора VIII < 1 %) надали фармакокінетичні параметри, які були включені до набору фармакокінетичних аналізів за протоколом. Категорії цих аналізів для немовлят (віком від 1 місяця до < 2 років), дітей молодшого віку (віком від 2 до < 5 років), дітей старшого віку від 5 до < 12 років, підлітків (від 12 до < 18 років) і дорослих (віком від 18 років) використовували для узагальнення фармакокінетичних параметрів, де вік визначали як вік на момент ФК інфузії.
Таблиця 1
Зведенні дані фармакокінетичних параметрів лікарського засобу АДВЕЙТ у пацієнтів з тяжкою формою гемофілії А (початковий рівень фактора VIII < 1 %) | |||||
Параметр (середнє значення ± стандартне відхилення) | Немовлята (n = 5) | Діти молодшого віку (n = 30) | Діти старшого віку (n = 18) | Підлітки (n = 33) | Дорослі (n = 109) |
Всього AUC (МO * год /дл) | 1362,1 ± 311,8 | 1180,0 ± 432,7 | 1506,6 ± 530,0 | 1317,1 ± 438,6 | 1538,5 ± 519,1 |
Скориговане інкрементальне відновлення при Cmax (МО/дл в МО/кг)а | 2,2 ± 0,6 | 1,8 ± 0,4 | 2,0 ± 0,5 | 2,1 ± 0,6 | 2,2 ± 0,6 |
Період напіврозпаду (год) | 9,0 ± 1,5 | 9,6 ± 1,7 | 11,8 ± 3,8 | 12,1 ± 3,2 | 12,9 ± 4,3 |
Максимальна концентрація у плазмі після інфузії (МО/дл) | 110,5 ± 30,2 | 90,8 ± 19,1 | 100,5 ± 25,6 | 107,6 ± 27,6 | 111,3 ± 27,1 |
Період напіввиведення(год) | 11,0 ± 2,8 | 12,0 ± 2,7 | 15,1 ± 4,7 | 15,0 ± 5,0 | 16,2 ± 6,1 |
Об’єм розподілу у стабільному стані (дл/кг) | 0,4 ± 0,1 | 0,5 ± 0,1 | 0,5 ± 0,2 | 0,6 ± 0,2 | 0,5 ± 0,2 |
Кліренс (мл/кг * год) | 3,9 ± 0,9 | 4,8 ± 1,5 | 3,8 ± 1,5 | 4,1 ± 1,0 | 3,6 ± 1,2 |
а Обчислюється як Cmax - базовий рівень фактора VIII, розділений на дозу в МО/кг, де Cmax є максимальним післяінфузійним значенням фактора VIII.
Безпека і гемостатична ефективність лікарського засобу АДВЕЙТ в педіатричній популяції аналогічна цим показникам у дорослих пацієнтів. Скориговане відновлення і кінцевий період напіввиведення (t½) були приблизно на 20 % нижчими в молодших дітей (до 6 років), ніж у дорослих, що може бути обумовлено частково відомим збільшенням об’єму плазми на кілограм маси тіла в молодших пацієнтів.
Дотепер немає даних про фармакокінетику препарату АДВЕЙТ у пацієнтів, які раніше не отримували лікування.
Клінічні характеристики
Показання.
Лікування і профілактика кровотеч у пацієнтів з гемофілією А (вродженим дефіцитом фактора VIII). АДВЕЙТ призначають пацієнтам всіх вікових груп.
Протипоказання.
Гіперчутливість до активної речовини чи до будь-якої допоміжної речовини, зазначеної у розділі «Склад», або до білків мишей чи хом’яків.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження взаємодії для лікарського засобу АДВЕЙТ не проводили.
Особливості застосування.
Простежування
Для покращення простежування біологічних лікарських засобів слід реєструвати назву та номер серії введеного препарату.
Гіперчутливість
При застосуванні препарату АДВЕЙТ повідомлялося про реакції гіперчутливості, у тому числі анафілаксію. Препарат містить білки мишей і хом’яків у слідових кількостях. При появі симптомів підвищеної чутливості пацієнтам слід рекомендувати негайно припинити введення препарату і звернутися до лікаря. Пацієнтів необхідно проінформувати про ранні ознаки реакцій підвищеної чутливості, такі як кропив’янка, генералізована кропив’янка, стиснення у грудях, хрипи, гіпотонія та анафілаксія.
У випадку шоку потрібно розпочати загальні протишокові заходи.
Інгібітори
Утворення нейтралізуючих антитіл (інгібіторів) до фактора VIII є відомим ускладненням при лікуванні пацієнтів з гемофілією А. Цими інгібіторами зазвичай є імуноглобуліни IgG, спрямовані проти прокоагуляційної активності фактора VIII, які виражаються в одиницях Бетезда (БО) на 1 мл плазми з використанням модифікованого аналізу. Ризик утворення інгібіторів залежить від тяжкості захворювання, а також ступеня дії фактора VIII, і є максимальним протягом перших 20 днів лікування. У рідкісних випадках інгібітори можуть утворитись після перших 100 днів лікування.
Спостерігалися випадки рецидиву розвитку інгібіторів (з низьким титром) у період більше ніж 100 днів після переходу з одного препарату рекомбінантного фактора VIII на інший у пацієнтів, які раніше проходили лікування і у яких в анамнезі спостерігався розвиток інгібіторів. Тому потрібно вести ретельне спостереження за станом пацієнтів щодо розвитку інгібіторів після зміни лікарських засобів.
Клінічна значимість утворення інгібітора залежить від його титру. При цьому інгібітори з низьким титром, які існують тимчасово або залишаються незмінно низькими, становлять менший ризик недостатньої клінічної відповіді, ніж інгібітори високого титру.
Загалом усі пацієнти, які отримують лікування фактором коагуляції VIII, потребують ретельного спостереження щодо утворення інгібіторів шляхом клінічного нагляду і лабораторних тестів. Якщо очікувані рівні активності фактора VIII у плазмі не досягнуті або якщо кровотеча не контролюється за допомогою відповідної дози, слід провести тестування на наявність інгібітора фактора VIII. Для пацієнтів із високим рівнем інгібітора терапія фактором VIII може бути неефективною, тому слід розглянути інші варіанти лікування. Лікування таких пацієнтів мають проводити лікарі з досвідом лікування гемофілії та утворення інгібіторів фактора VIII.
Ускладнення, пов’язанні з катетеризацією
Якщо необхідний центральний венозний пристрій (СVAD), існує ризик виникнення CVAD-пов’язаного ускладнення, включаючи місцеві інфекції, бактеріємію і тромбоз в місці катетеризації.
Фактори, що пов’язані з допоміжними речовинами
Натрій
Цей лікарський засіб містить 10 мг натрію на флакон, що є еквівалентом 0,5 % рекомендованої ВООЗ максимальної добової дози 2 г натрію для дорослої людини.
Наполегливо рекомендується щоразу під час введення пацієнту препарату АДВЕЙТ реєструвати назву та номер серії лікарського засобу для встановлення зв’язку між станом пацієнта і серією лікарського засобу.
Діти
Застереження та заходи безпеки для дітей не відрізняються від таких для дорослих.
Застосування у період вагітності та годування груддю.
Дослідження впливу фактора VIII на репродуктивність тварин не проводили. Через низьку частоту захворювання жінок на гемофілію А відсутній досвід застосування фактора VIII під час вагітності і годування груддю. Тому фактор VIII слід застосовувати під час вагітності та годування груддю лише у разі чітких показань.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
АДВЕЙТ не має впливу на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Спосіб застосування та дози.
Лікування слід розпочинати під наглядом лікаря, який має досвід у лікуванні гемофілії; також повинні бути доступні засоби для реанімації на випадок виникнення анафілаксії.
Дозування
Дозування і тривалість замісної терапії залежать від рівня дефіциту фактора VIII, місця і масштабів кровотечі, а також від клінічного стану пацієнта.
Кількість одиниць фактора VIII виражають в міжнародних одиницях (МО), які пов’язані зі стандартом ВООЗ для препаратів фактора VIII. Активність фактора VIII у плазмі виражають або у відсотках (відносно нормальної плазми людини), або в МО (відносно міжнародного стандарту фактора VIII в плазмі крові).
1 міжнародна одиниця (МО) активності фактора VIII еквівалентна кількості фактора VIII в 1мл нормальної плазми людини.
Лікування «за необхідності»
Розрахунок необхідної дози фактора VIII здійснюється на основі емпірично виявленої залежності: 1 МО фактора VIII на кілограм маси тіла підвищує активність фактора VIIІ на 2 МО/дл плазми. Необхідна доза визначається за формулою:
Необхідна доза (МО) = маса тіла (кг)× бажане підвищення фактора VIII (%)× 0,5
У разі розвитку подальших епізодів кровотечі активність фактора VIII не повинна опускатися нижче певного рівня активності плазми (у % від нормального рівня або МО/дл) у відповідний період. Нижченаведену таблицю 2 можна використовувати як інструкцію з вибору дози при кровотечах і хірургічних утручаннях.
Таблиця 2
Інструкція з вибору дози при кровотечах і хірургічних утручаннях | ||
Ступінь кровотечі/ тип хірургічного втручання | Необхідний рівень фактора VIII (% або МО/дл) | Частота введення (годин)/ тривалість терапії (в днях) |
Кровотеча | ||
Ранній гемартроз, м’язова кровотеча або кровотеча в ротовій порожнині. | 20‒40 | Повторюйте ін’єкції кожні 12‒24 години (від 8 до 24 годин пацієнтам віком до 6 років) протягом щонайменше 1 дня, поки не припиниться кровотеча, на яку вказує біль, або досягнуто загоювання. |
Підвищений гемартроз, м’язова кровотеча або гематома. | 30‒60 | Повторюйте ін’єкції кожні 12‒24 години (від 8 до 24 годин пацієнтам віком до 6 років) протягом 3‒4 днів чи довше, поки не будуть усунені біль чи недієздатність. |
Загрозлива для життя кровотеча. | 60‒100 | Повторюйте ін’єкції кожні 8‒24 години (від 6 до 12 годин пацієнтам віком до 6 років), поки не буде усунена загроза для життя. |
Хірургічне втручання | ||
Незначне, в тому числі видалення зубів | 30‒60 | Кожні 24 години (від 12 до 24 годин пацієнтам віком до 6 років) протягом не менше 1 доби, поки не буде досягнуто загоювання. |
Значне | 80‒100 (перед операцією і після операції) | Повторюйте ін’єкції кожні 8‒24 години (від 6 до 24 годин пацієнтам віком до 6 років) до адекватного загоювання, далі продовжуйте лікування щонайменше протягом 7 днів для підтримки активності фактора VIII від 30 % до 60 % (МО/дл) |
Доза і частота введення повинні бути підібрані відповідно до клінічної ситуації в кожному конкретному випадку. При певних обставинах (наприклад, наявність інгібітора з низьким титром) може бути необхідною більша доза, ніж розраховано за формулою.
В ході лікування доцільно визначити рівні активності фактора VIII в плазмі крові та використовувати їхні значення при визначенні потрібної дози та частоти повторних ін’єкцій. У разі проведення великих хірургічних втручань точний контроль замісної терапії за допомогою кількісної проби активності фактора VIII в плазмі крові є необхідним. Різні пацієнти можуть мати різну відповідь на фактор VIII, досягаючи різних рівнів відновленняin vivoі демонструючи різну інтенсивність напіввиведення.
Профілактика
Для тривалої профілактики кровотеч у пацієнтів з тяжкою формою гемофілії А звичайні дози становлять 20‒40 МО фактора VIII на 1 кг маси тіла з інтервалом введення від 2 до 3 днів.
Спосіб застосування
АДВЕЙТ слід вводити внутрішньовенно. У разі введення препарату особою, яка не є медичним працівником, необхідна відповідна підготовка.
Швидкість введення слід визначати таким чином, щоб вона була комфортною для пацієнта і не перевищувала 10мл/хв.
Після відновлення розчин має бути прозорим, безбарвним, вільним від сторонніх домішок і мати рН від 6,7 до 7,3.
Інструкції з відновлення лікарського засобу перед введенням
АДВЕЙТ слід вводити внутрішньовенно після відновлення препарату.
Слід провести візуальну перевірку відновленого розчину на наявність сторонніх часток та/або зміну кольору.
Після відновлення розчин повинен бути прозорим, безбарвним і не містити сторонніх включень. Не використовуйте розчини, які є каламутними або містять включення.
- Для введення слід використовувати шприц з замком типу Люера.
- Використати протягом трьох годин після відновлення.
- Відновлений розчин не можна зберігати у холодильнику.
Будь-який невикористаний препарат або відходи потрібно утилізувати відповідно до місцевих вимог.
Відновлення за допомогою пристосування БАКСДЖЕКТ ІІ
- Для відновлення використовують тільки стерилізовану воду для ін’єкцій та пристосування для розведення, що входить до комплекту.
- Не використовувати, якщо пристосування БАКСДЖЕКТ ІІ, його система стерильного бар’єра або упаковка пошкоджені або мають ознаки псування.
- Потрібно дотримуватись правил асептики.
1. Якщо препарат зберігається в холодильнику, дістаньте обидва флакони ‒ з порошком АДВЕЙТ і з розчинником ‒ з холодильника і залиште їх нагрітися до кімнатної температури (близько 15‒25 °С).
2. Ретельно вимийте руки теплою водою з милом.
3. Зніміть кришечки з флаконів з порошком та розчинником.
4. Очистіть пробки за допомогою тампонів зі спиртом. Поставте флакони на пласку чисту поверхню.
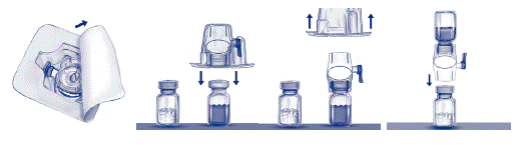
5. Відкрийте упаковку з пристосуванням БАКСДЖЕКТ ІІ, знявши паперову кришку, не торкаючись пристосування всередині (рис. а). Не виймайте пристосування з упаковки. Не використовуйте, якщо пристосування БАКСДЖЕКТ II, його стерильна бар’єрна система або упаковка пошкоджені або мають ознаки псування.
6. Переверніть упаковку і вставте прозорий пластиковий зубець у пробку флакона з розчинником. Візьміть упаковку за край і зніміть її з пристосування БАКСДЖЕКТ II (рис. б). Не видаляйте синій ковпачок з пристосування БАКСДЖЕКТ II.
7. Для розведення використовують тільки стерильну воду для ін’єкцій і пристосування для розведення, вкладені в упаковку. Переверніть систему з пристосування БАКСДЖЕКТ II, приєднаного до флакона з розчинником так, щоб флакон опинився над пристосуванням. Вставте білий пластиковий зубець у пробку флакона з препаратом АДВЕЙТ. Вакуум втягне розчинник у флакон з препаратом АДВЕЙТ (рис. в).
8. Обережно перемішайте до повного розчинення препарату. Впевніться, що АДВЕЙТ розчинився повністю, інакше не весь відновлений розчин пройде через фільтр пристосування. Препарат швидко розчиняється (звичайно менше ніж за 1 хвилину). Після відновлення розчин повинен бути чистий, прозорий і вільний від сторонніх домішок.
Рис. а Рис. б Рис. в
Введення
Дотримуйтесь правил асептики.
Лікарські засоби для парентерального застосування слід перевіряти на наявність сторонніх часток безпосередньо перед використанням, якщо це дозволяє розчин і флакон. Потрібно застосовувати тільки прозорий і безбарвний розчин.
1. Зніміть синій ковпачок з БАКСДЖЕКТ II.Не набирайте повітря у шприц. Приєднайте шприц до БАКСДЖЕКТ II.
2. Переверніть систему (флакон з відновленим розчином має бути зверху). Наберіть відновлений розчин у шприц, повільно потягнувши поршень.
3. Від’єднайте шприц.
4. Приєднайте голку-метелик до шприца. Введіть внутрішньовенно. Розчин cлід вводити повільно, зі швидкістю, що визначається рівнем комфорту пацієнта, не перевищуючи 10 мл за хвилину. Слід визначати частоту пульсу до та під час введення препарату АДВЕЙТ. При значному зростанні частоти пульсу знижують швидкість введення або тимчасово переривають ін’єкцію, що зазвичай є достатнім для швидкого зникнення симптомів (див. розділи «Особливості застосування» та «Побічні реакції»).
З мікробіологічної точки зору препарат слід ввести негайно після відновлення. Проте хімічна та фізична стабільність лікарського засобу після відкриття упаковки була продемонстрована протягом 3 годин при температурі 25 °C.
Впродовж терміну придатності препарат може зберігатися при кімнатній температурі (не вище 25 °С) протягом одного періоду, що не перевищує 6 місяців. Завершення терміну зберігання 6 місяців при кімнатній температурі повинно бути зазначено на упаковці лікарського засобу. Препарат не можна повертати на подальше зберігання у холодильник.
Діти
При лікуванні «за необхідності» дозування у пацієнтів дитячого віку (від 0 до 18 років) не відрізняється від дозування у дорослих пацієнтів. Пацієнтам віком до 6 років для профілактичної терапії застосовують 20‒50 МО фактора VIII на 1 кг маси тіла 3‒4 рази на тиждень.
Передозування.
Немає повідомлень про симптоми передозування препарату.
Побічні реакції.
Клінічні випробування лікарського засобу АДВЕЙТ включали 418 досліджень одноразового застосування лікарського засобу АДВЕЙТ із проявом 93 побічних реакцій. Часті небажані побічні реакції включали розвиток нейтралізуючих антитіл до фактора VIII (інгібіторів), головний біль і лихоманку.
Гіперчутливість або алергічні реакції (що можуть включати ангіоневротичний набряк, печіння і поколювання в місці інфузії, озноб, гіперемію, генералізовану кропив’янку, головний біль, кропив’янку, гіпотензію, летаргію, нудоту, неспокій, тахікардію, стиснення у грудях, пощипування, блювання, хрипи) спостерігалися рідко, та у деяких випадках вони прогресували до гострої анафілаксії (включаючи шок).
У разі появи антитіл до білка миші та/або хом’яка можуть спостерігатися супутні реакції гіперчутливості.
У пацієнтів з гемофілією А, які отримують фактор VIII, включаючи АДВЕЙТ, можуть утворюватися нейтралізуючі антитіла (інгібітори). Якщо виникають такі інгібітори, клінічна реакція не буде достатньою. У таких випадках рекомендується звернутися до спеціалізованого центру лікування гемофілії.
Перелік побічних реакцій у вигляді таблиці
У таблиці 3 нижче вказані побічні реакції на лікарський засіб, про які повідомляли у клінічних випробуваннях та у спонтанних повідомленнях, за частотою виникнення. Таблиця відповідає класифікації системи органів MedDRA (КСО та термінами переважного використання).
Категорії частоти визначені таким чином: дуже часто (≥1/10), часто (від ≥1/100 до <1/10), нечасто (від ≥1/1000 до <1/100), рідко (від ≥1/10000 до <1/1000), дуже рідко (<1/10000), невідомо (не можна оцінити за наявними даними). В межах кожної категорії частоти побічні реакції зазначено в порядку зменшення серйозності.
Таблиця 3
Частота розвитку побічних реакцій на лікарський засіб, про які повідомлялося у клінічних випробуваннях та у спонтанних повідомленнях
Стандартна система класів систем органів за MedDRA | Побічні реакції | Частотаa |
Інфекції та паразитарні інвазії | Грип | Нечасто |
Ларингіт | Нечасто | |
З боку крові та лімфатичної системи | Інгібування фактора VIII | Нечасто (ПОПЛ)d Дуже часто (ПБПЛ)d |
Лімфангіт | Нечасто | |
Розлади імунної системи | Анафілактична реакція | Невідомо |
Підвищена чутливістьс | Невідомо | |
Розлади нервової системи | Головний біль | Часто |
Запаморочення | Нечасто | |
Погіршення пам’яті | Нечасто | |
Непритомність | Нечасто | |
Тремор | Нечасто | |
Мігрень | Нечасто | |
Дисгевзія | Нечасто | |
Розлади з боку органів зору | Запалення очей | Нечасто |
Розлади з боку серця | Прискорене серцебиття | Нечасто |
Судинні розлади | Гематома | Нечасто |
Приплив крові до обличчя | Нечасто | |
Блідість | Нечасто | |
Респіраторні, торакальні і медіастинальні розлади | Задишка | Нечасто |
Шлунково-кишкові розлади | Діарея | Нечасто |
Болі у верхній частині живота | Нечасто | |
Нудота | Нечасто | |
Блювання | Нечасто | |
Ураження шкіри і підшкірної тканини | Свербіж | Нечасто |
Висип | Нечасто | |
Гіпергідроз | Нечасто | |
Кропив’янка | Нечасто | |
Загальні розлади та реакції у місці введення | Гіпертермія | Часто |
Периферійний набряк | Нечасто | |
Біль у грудях | Нечасто | |
Дискомфорт у грудях | Нечасто | |
Озноб | Нечасто | |
Погане самопочуття | Нечасто | |
Гематома у місці проколу судини | Нечасто | |
Втома | Невідомо | |
Реакція в місці ін’єкції | Невідомо | |
Нездужання | Невідомо | |
Лабораторні показники | Підвищений рівень моноцитів | Нечасто |
Знижений рівень фактора згортання крові VIIIb | Нечасто | |
Знижений рівень гематокриту | Нечасто | |
Відхилення від норми лабораторних показників | Нечасто | |
Травми, отруєння і процедурні ускладнення | Післяпроцедурні ускладнення | Нечасто |
Післяпроцедурна кровотеча | Нечасто | |
Реакція у місці проведення процедури | Нечасто |
a Розраховано на основі загальної кількості пацієнтів, які отримували АДВЕЙТ (418).
b У одного пацієнта під час неперервної інфузії препарату АДВЕЙТ після хірургічної операції (10‒14 днів після операції) виникло неочікуване зниження рівня фактора коагуляції VIII. Протягом цього періоду постійно підтримувався гемостаз, а рівні фактора VIII в плазмі крові та швидкість виведення повернулися до належних рівнів на 15-й день після операції. Кількісні аналізи на наявність інгібіторів до фактора VIII після завершення неперервної інфузії та після завершення дослідження дали негативний результат.
c Пояснення щодо цієї побічної реакції на препарат наведено у розділі нижче.
d Частота базується на даних досліджень з усіма препаратами фактора згортання крові VIII, які включали пацієнтів із тяжкою формою гемофілії А. ПОПЛ ‒ пацієнти, які попередньо отримували лікування, ПБПЛ ‒ пацієнти, які попередньо не отримували лікування.
Опис окремих побічних реакцій
Побічні реакції на залишки від виробничого процесу
У 229 пацієнтів, які отримували лікування, досліджували наявність антитіл до білкових клітин китайського хом’яка (СНО): 3 пацієнти показали статично значущу тенденцію в титрах, у 4 пацієнтів були стійкі піки або перехідний піковий потенціал і 1 пацієнт мав одночасно обидва показники, але жодних клінічних симптомів. З 229 пацієнтів, які були перевірені на антитіла до мишачих IgG, 10 показали статично значущу тенденцію до зростання, 2 продемонстрували стійкий пік або перехідний піковий потенціал і 1 пацієнт мав одночасно обидва показники. 4 пацієнти повідомили про окремі випадки кропив’янки, свербіж, висипи і дещо підвищену кількість еозинофілів при повторних застосуваннях лікарського засобу.
Гіперчутливість
Алергічний тип реакцій включає анафілаксію і проявляється запамороченням, парестезіями, висипом, почервонінням, набряком обличчя, кропив’янкою та свербежем.
Діти
Окрім утворення нейтралізуючих антитіл (інгібіторів) у дітей, що раніше не отримували лікування, та ускладнень, пов’язаних з катетеризацією, не виявлено відмінностей у побічних реакціях, які були відзначені в клінічних дослідженнях.
Повідомлення про підозрювані побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності.
2 роки.
Розчинник (вода для ін’єкцій) - 5 років.
Умови зберігання.
Зберігати при температурі від 2 до 8 °С. Не заморожувати! Зберігати в оригінальній упаковці з метою захисту від світла.
Зберігати у недоступному для дітей місці.
Несумісність
Оскільки дослідження сумісності не проводили, цей препарат не слід змішувати з іншими лікарськими засобами або розчинниками.
Упаковка.
По 1 флакону з порошком для розчину для ін’єкцій (по 250 МО, 500 МО, 1000 МО, 1500МО, 2000 МО або 3000 МО) у комплекті з 1 флаконом з розчинником (5 мл води для ін’єкцій) та по 1 пристосуванню для розчинення БАКСДЖЕКТ II у коробці.
Категорія відпуску.
За рецептом.
Виробник.
Баксалта Белджіум Мануфектурінг СА, Бельгія/ Baxalta Belgium Manufacturing SA, Belgium.
Місцезнаходження виробника та його адреса місця провадження діяльності.
Бульвар Рене Бранкуа 80, Лессін, 7860, Бельгія/ Boulevard Rene Branquart 80, Lessines, 7860, Belgium.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО



