МЮСТОФОРАН®
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.
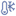 від 2 °С до 8 °С
від 2 °С до 8 °С
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
МЮСТОФОРАН®
(MUSTOPHORAN®)
Склад:
діюча речовина:fotemustine;
1флакон містить 208мг фотемустину;
об’єм готового розчину становить 4,16мл (200мг фотемустину в 4мл розчину);
1ампула розчинника містить спирт етиловий 96%, води для ін’єкцій q.s. до 4мл.
Лікарська форма Порошок та розчинник для розчину для інфузій.
Основнi фiзико-хiмiчнi властивості:порошок блідо-жовтого кольору.
Фармакотерапевтична група
Антинеопластичні засоби. Алкілуючі сполуки. Похідні нітрозосечовини. Код АTX L01A D05.Фармакологiчнi властивості.
Фотемустин - це цитостатичний антимітотичний засіб, похідне нітрозосечовини з алкілуючою та карбамілуючою дією.
Хімічна формула фотемустину містить біоізостер аланіну (аміно-1-етилфосфорна кислота), що сприяє проникненню субстанції у клітини та проходженню крізь гематоенцефалічний бар’єр.
Після внутрішньовенного введення кінетика виведення фотемустину з плазми крові має моно- або біекспоненціальний характер з коротким періодом напіврозпаду.
Фотемустин майже цілком метаболізується.
Зв’язування з білками плазми крові є низьким (25-30%).
Фотемустин проникає крізь гематоенцефалічний бар’єр.
Клінічні характеристики
Показання.
· Дисемінована злоякісна меланома, включаючи метастази у мозок.
· Первинні злоякісні пухлини головного мозку.
Протипоказання.
· Гіперчутливість до фотемустину, нітрозосечовини або до будь-якої допоміжної речовини.
· У комбінації з вакциною проти жовтої гарячки (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Слід уникати контакту препарату зі шкірою або слизовою оболонкою та абсорбції готового розчину. Під час приготування розчину рекомендується користуватися рукавичками та маскою. У разі потрапляння розчину на шкіру та слизові оболонки необхідно промити їх великою кількістю води.
З метою безпеки необхідно позбутися матеріалів, що контактували з препаратом, із дотриманням вимог щодо утилізації цитотоксичних препаратів.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Взаємодії, притаманні всім цитотоксичним засобам.
Через підвищений ризик виникнення тромбозу під час лікування неопластичних захворювань часто призначають антикоагулянтну терапію. Значні зміни властивостей згортання крові під час цих захворювань у поєднанні з ризиком взаємодії між пероральними антикоагулянтами та антинеопластичною хіміотерапією вимагають частішого контролю Міжнародного нормалізованого співвідношення (МНС) при одночасному застосуванні хіміотерапії та пероральних антикоагулянтів.
Протипоказані комбінації.
Вакцина проти жовтої гарячки. Існує ризик виникнення системного захворювання, спричиненого вакциною, що може бути летальним.
Нерекомендовані комбінації.
Фенітоїн(та фосфенітоїн шляхом екстраполяції). Через зниження гастроінтестинальної абсорбції фенітоїну цитостатиком існує ризик розвитку судом. Існує також ризик підвищення токсичності або зниження ефективності цитостатика внаслідок підвищення фенітоїном або фосфенітоїном його печінкового метаболізму.
Живі послаблені вакцини (за винятком вакцини проти жовтої гарячки). Існує ризик виникнення системного захворювання, спричиненого вакциною, що може бути летальним. Цей ризик підвищується у пацієнтів, які вже мають знижений імунітет внаслідок основного захворювання.
Слід застосовувати неактивну вакцину, якщо така існує (поліомієліт).
Комбінації, що потребують уваги.
Імуносупресанти. Виражена імуносупресія з ризиком виникнення проліферації лімфатичної тканини.
Взаємодії, специфічні для препарату Мюстофоран®.
Комбінації, що потребують застережень при застосуванні.
Дакарбазин. Великі дози дакарбазину: існує ризик легеневої токсичності (гострий респіраторний дистрес-синдром у дорослих). Не слід застосовувати ці препарати одночасно. Лікування дакарбазином можна розпочинати не раніше, ніж через 1 тиждень після останнього застосування фотемустину (див. розділ «Спосіб застосування та дози»).
Особливості застосування.
Особливі застереження.
Пацієнти літнього віку. Токсичність фотемустину досліджувалася у пацієнтів віком до 60років та старших. Тромбоцитопенія (ІІІ ступеня), лейкопенія (ІІІ ступеня) та гастроінтестинальна токсичність (ІІІ ступеня) спостерігалися значно частіше у пацієнтів віком від 60років.
Живі послаблені вакцини, фенітоїн або фосфенітоїн. Цей лікарський засіб не рекомендується застосовувати з живими послабленими вакцинами, фенітоїном або фосфенітоїном (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Запобіжні заходи.
Мюстофоран® не рекомендується призначати пацієнтам, які отримували хіміотерапію протягом попередніх 4 тижнів (або 6 тижнів у разі лікування препаратами нітрозосечовини).
Препарат можна призначати тільки при прийнятній кількості тромбоцитів та/або гранулоцитів, мінімально допустимі значення яких становлять 100000/мм3 та 2000/мм3 відповідно.
Перед кожним застосуванням Мюстофорану® слід проводити аналіз крові, дозування слід відкоригувати відповідно до гематологічного стану пацієнта (див. таблицю):
Тромбоцити (/мм3) | Гранулоцити (/мм3) | Відсоток дози, що призначається |
>100000 | >2000 | 100% |
100000 ³ N > 80000 | 2000 ³ N > 1500 | 75% |
1500 ³ N > 1000 | 50% | |
N £ 80000 | £ 1000 | Лікування відкладається |
Рекомендований інтервал між початком індукційної та підтримуючої терапії - 8тижнів. Інтервал між двома циклами підтримуючої терапії має бути не менше 3 тижнів.
Підтримуюче лікування можна проводити лише тоді, коли кількість тромбоцитів становить не менше 100000/мм3 та гранулоцитів - не менше 2000/мм3.
Під час та після підтримуючої терапії рекомендується проводити моніторинг функції печінки.
В обмеженій кількості пацієнтів з нирковою недостатністю фотемустин, який застосовувався в стандартних дозах, не продемонстрував впливу на показники креатиніну та сечовини. Однак, рекомендується ретельний моніторинг пацієнтів з нирковою недостатністю.
Мюстофоран® містить 80% (v/v) етанолу (алкоголь), тобто 1,3г алкоголю на 100мг фотемустину, що еквівалентно 32мл пива або 13,3мл вина. Ця кількість алкоголю може зашкодити пацієнтам, які страждають на алкоголізм. Це також слід брати до уваги пацієнтам, які належать до груп високого ризику, а саме - особам із захворюваннями печінки або з епілепсією.
Перед початком інфузії фотемустину слід переконатися, що систему для внутрішньовенного вливання встановлено правильно задля уникнення екстравазації. У разі виникнення останньої необхідно припинити інфузію, промити вену великою кількістю розчину глюкози 5% (4мл/хв), іммобілізувати кінцівку та остудити її за допомогою мішечка з льодом задля уникнення розповсюдження інфузійного розчину.
Застосування у період вагітності або годування груддю.
Мюстофоран® протипоказаний у період вагітності або годування груддю.
Жінкам репродуктивного віку Мюстофоран® слід застосовувати у поєднанні з ефективною контрацепцією. Пацієнтам чоловічої статі рекомендовано застосовувати відповідні заходи контрацепції.
Вагітність.
Дані щодо застосування препарату вагітним жінкам відсутні або обмежені. Кількість даних, отриманих у дослідженнях на тваринах, є недостатньою для висновку щодо репродуктивної токсичності. Мюстофоран® протипоказаний у період вагітності та жінкам репродуктивного віку, які не користуються контрацептивними засобами.
Годування груддю.
Дані щодо того, чи проникає фотемустин/метаболіти у грудне молоко, відсутні. Ризик для новонароджених/немовлят виключати не можна. Мюстофоран® протипоказаний у період годування груддю.
Фертильність.
Дослідження токсичності повторної дози фотемустину продемонстрували вплив на фертильність тварин чоловічої статі.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Досліджень щодо впливу на здатність керувати транспортними засобами чи працювати з іншими механізмами не проводили. Однак керувати автотранспортом одразу ж після застосування фотемустину не бажано (слід враховувати можливість розвитку розладів свідомості (див. розділ «Побічні реакції»)).
Спосіб застосування та дози.
Розчин готувати безпосередньо перед застосуванням.
Порошок фотемустину, що знаходиться у флаконі, слід розчинити у 4 мл розчинника, який додається, та збовтати протягом не менше 2 хвилин до повного розчинення. Об’єм готового розчину становить 4,16мл (200 мг фотемустину в 4 мл розчинника). Після розрахунку необхідної кількості готового розчину для введення його слід розвести у 5%‑ому ізотонічному розчині глюкози (не менше 250мл) для внутрішньовенних інфузій.
Готовий розчин має бути захищений від світла! Його необхідно одразу ж помістити у непрозорий чохол. Розчин вводити внутрішньовенно протягом 1 години.
Слід брати до уваги, що для хворих на цукровий діабет для інфузії використовується 0,9%-ий розчин натрію хлориду. Розчин необхідно готувати дуже швидко та негайно застосовувати (див. також розділ «Особливості застосування»).
Монохіміотерапія.
Індукційна терапія: 3 послідовні інфузії з інтервалом в 1 тиждень з наступним періодом терапевтичного спокою 4-5 тижнів;
Підтримуюча терапія:1 інфузія кожні 3 тижні.
Рекомендована доза становить 100мг/м2.
У складі комбінованої хіміотерапії.
Третя інфузія індукційного лікування відміняється. Дозування залишається на рівні 100мг/м2.
У комбінації з дакарбазином.
Повідомлялося про рідкісні випадки легеневої токсичності (гострий респіраторний дистрес-синдром у дорослих) при одночасному (у той же самий день) застосуванні фотемустину та великих доз дакарбазину. Слід уникати одночасного застосування цих двох препаратів (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Ці препарати можна призначати у комбінації з дотриманням наступних рекомендацій:
Індукційна терапія:
- фотемустин: 100 мг/м2/добу у 1-й та 8-й дні;
- дакарбазин: 250 мг/м2/добу у 15-й, 16-й, 17-й та 18-й дні;
- період терапевтичного спокою - 5 тижнів.
Підтримуюча терапія (кожні 3 тижні):
- фотемустин: 100 мг/м2/добу у 1-й день;
- дакарбазин: 250 мг/м2/добу у 2-й, 3-й, 4-й та 5-й дні.
Діти.
Застосовувати фотемустин для лікування дітей не рекомендовано, оскільки співвідношення «користь/ризик» не вивчалося для цієї групи пацієнтів.
Передозування.
При передозуванні необхідно посилити контроль гематологічних показників.
Специфічного антидоту не існує.
Побічні реакції.
Під час клінічних досліджень, при лікуванні фотемустином основні побічні реакції виникали з боку системи крові з можливим ураженням трьох ліній кров’яних клітин. Ці прояви токсичної дії були відстроченими та характеризувалися розвитком анемії (14%), а також тромбоцитопенії (40,3%) і лейкопенії (46,3%) з максимальним зменшенням кількості клітин крові через 4-5 та 5-6тижнів після початку терапії відповідно. Повідомлялося також про виникнення панцитопенії.
Можливе загострення гематологічної токсичності у разі попередньої хіміотерапії та/або застосуванні комбінації з іншими лікарськими засобами, що можуть спричинити гематопоетичну токсичність.
У пацієнтів літнього віку може спостерігатися підвищена гематологічна та гастроінтестинальна токсичність.
Під час лікування фотемустином повідомлялося про нижчезазначені побічні ефекти, що за частотою розподілені таким чином: дуже часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), рідко (≥1/10000, <1/1000), дуже рідко (<1/10000), частота невідома (не може бути визначена згідно з наявною інформацією).
З боку системи крові та лімфатичної системи.
Дуже часто: тромбоцитопенія, лейкопенія (ІІІ-ІV ступеня), анемія (ІІІ-ІV ступеня).
Неврологічні розлади.
Нечасто: транзиторні неврологічні розлади без наслідків (розлади свідомості, парестезія, агевзія).
З боку шлунково-кишкового тракту.
Дуже часто: нудота, блювання протягом 2-х годин після введення.
Часто: діарея, біль в абдомінальній ділянці
З боку сечовидільної системи.
Нечасто: тимчасове підвищення рівня сечовини.
З боку шкіри і підшкірної клітковини.
Нечасто: свербіж.
Загальні та місцеві розлади.
Часто: напад гарячки, подразнення вени у місці ін’єкції.
З боку гепатобіліарної системи.
Дуже часто: помірно виражене транзиторне та оборотне підвищення рівня трансаміназ, лужних фосфатів та білірубіну.
Частота невідома: гепатит.
З боку дихальної системи, органів грудної клітки та середостіння.
Повідомлялося про рідкісні випадки легеневої токсичності (гострий респіраторний дистрес-синдром у дорослих) при одночасному застосуванні фотемустину з дакарбазином (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Доброякісні неоплазми, злоякісні та невизначені новоутворення (включаючи кісти та поліпи).
Антинеопластичні та особливо алкілуючі засоби асоціювалися з потенціальним ризиком виникнення мієлодиспластичного синдрому та гострої мієлоїдної лейкемії. Повідомлялося про рідкісні випадки виникнення цих ускладнень при кумуляції високих доз фотемустину при його застосуванні у монотерапії або у комбінації з хіміо- або радіотерапією.
Термін придатності.2роки.
Умови зберігання.
Зберігати в холодильнику при температурі від 2 до 8○С. Зберігати в оригінальній упаковці для захисту від світла. Зберігати в недоступному для дітей місці.
Розведений розчин слід застосовувати негайно після приготування.
Упаковка.
По 1флакону, виготовленому з коричневого скла, ємністю 10мл, який містить 208мг порошка, та 1ампулі, виготовленій з прозорого скла, ємністю 5мл, яка містить 4мл розчинника, в коробці з картону пакувального.
Категорія відпуску.
За рецептом.
Виробник.
Виробництво і контроль якості флакону зі стерильним порошком, пакування та випуск серії лікарського засобу:
Сенексі-Лаборатуар Тіссен СА/Cenexi-Laboratoires Thissen SA.
Місцезнаходження виробника та його адреса місця провадження діяльності.
Рю де ля Папіре 2-4-6, Брен л’Алльо, Б-1420, Бельгія/Rue de la Papyrée 2-4-6, Braine-l’Alleud, B-1420, Belgium.
Виробник.
Виробництво, контроль якості та первинне пакування ампули з розчинником:
ЗАТ Фармацевтичний завод ЕГІС/EGIS Pharmaceuticals Plc.
Місцезнаходження виробника та його адреса місця провадження діяльності.
1165, м.Будапешт, вул. Бекеньфелді, 118-120, Угорщина/1165, Budapest, Bökényföldi ut. 118-120, Hungary.
Заявник.
ЛЄ ЛАБОРАТУАР СЕРВ’Є/Les Laboratoires Servier.
Місцезнаходження заявника.
50, рю Карно, 92284 Сюрен Седекс, Франція/50, rue Carnot, 92284 Suresnes Cedex, France.
Представник заявника в Україні.
Представництво «ЛЄ ЛАБОРАТУАР СЕРВ’Є».
Місцезнаходження представника заявника.
Вул.Бульварно-Кудрявська, 24,
м.Київ, 01054, Україна,
тел.: (044) 490 3441,
факс: (044) 490 3440.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО

