ПРІОРИКС™/PRIORIX™ КОМБІНОВАНА ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ КОРУ, ЕПІДЕМІЧНОГО ПАРОТИТУ ТА КРАСНУХИ
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.

Інструкція для медичного застосування
лікарського засобу
(медичного імунобіологічного препарату)
ПРІОРИКСTM/P RIORIX ™
Комбінована вакцина для профілактики кору, епідемічного паротиту та краснухи
СКЛАД.
Кожна доза розчиненої вакцини об’ємом 0,5мл містить:діючі речовини:
не менше 103.0ТЦД50 живого атенуйованого вірусу кору (штам Schwarz);
не менше 103.7ТЦД50 живого атенуйованого вірусу епідемічного паротиту (штамRIT4385);
не менше 103.0ТЦД50 живого атенуйованого вірусу краснухи (штам WistarRA27/3);
Допоміжні речовини: амінокислоти, лактоза безводна, манітол, сорбітол.
Розчинник – вода для ін’єкцій.
Неоміцину сульфат присутній у вигляді залишку від виробничого процесу.
ЛІКАРСЬКА ФОРМА.Ліофілізат для розчину для ін’єкцій.
ПРІОРИКСтм – жива комбінована вакцина для профілактики кору, епідемічного паротиту та краснухи, яка є ліофілізованим комбінованим препаратом атенуйованих штамів вірусів кору (Schwarz measles), епідемічного паротиту (RIT4385, який є похідним від штаму Jeryl Lynn) і краснухи (WistarRA27/3), одержаних шляхом розмноження в культурі клітин курячих ембріонів (віруси епідемічного паротиту і кору) або в диплоїдних клітинах людини MRC-5 (вірус краснухи).
ПРІОРИКСтм є ліофілізатом від білуватого до блідо-рожевого кольору. Стерильний розчинник - прозора та безбарвна рідина.
ПРІОРИКС™ відповідає вимогам Всесвітньої організації охорони здоров’я щодо виробництва біологічних речовин, вакцин для профілактики кору, епідемічного паротиту і краснухи, і комбінованих живих вакцин.
ФАРМАКОТЕРАПЕВТИЧНА ГРУПА.Комбінована вакцина для профілактикикору, епідемічного паротиту та краснухи, жива атенуйована.
КОД АТХ. J07BD52.
ІМУНОБІОЛОГІЧНІ ТА БІОЛОГІЧНІ ВЛАСТИВОСТІ.
При проведенні клінічних випробувань була показана висока імуногенність вакцини ПРІОРИКС™. Антитіла до вірусу кору були виявлені у 98% раніше серонегативних вакцинованих осіб, антитіла до вірусу епідемічного паротиту- у 96,1% і до вірусу краснухи - у 99,3 %.
У порівняльних дослідженнях антитіла до вірусів кору, епідемічного паротиту і краснухи були виявлені відповідно у 98,7%, 95,5 % і 99,5 % раніше серонегативних вакцинованих, які одержали вакцину ПРІОРИКС™, у порівнянні з 96,9 %, 96,9 % і 99,5 % у групі, яка одержала іншу наявну на ринку комбіновану вакцину для профілактики кору, епідемічного паротиту і краснухи.
Усі обстежені особи, за якими спостерігали протягом 12місяців після вакцинації, залишалися серопозитивними щодо антитіл до вірусів кору та краснухи, 88,4 % осіб - щодо антитіл до епідемічного паротиту. Цей відсоток знаходиться на одному рівні з тим, що спостерігається при застосуванні інших комбінованих вакцин для профілактики кору, епідемічного паротиту та краснухи (87 %).
Оцінка фармакокінетичних властивостей не є обов’язковим для вакцин.
КЛІНІЧНІ ХАРАКТЕРИСТИКИ.
Показання
Вакцина ПРІОРИКСтм показана для активної імунізації з метою профілактики кору, епідемічного паротиту та краснухи.
Протипоказання.
Вакцина ПРІОРИКСтмпротипоказана:
- особам, які мають підвищену системну чутливість до неоміцину або будь-якого іншого компоненту вакцини (за наявності алергії на яєчний білок див.розділ «Особливості застосування»). Однак перенесений контактний дерматит щодо неоміцину не є протипоказанням.
- особам з ознаками гіперчутливості після попереднього введення вакцини проти кору, епідемічного паротиту та / або краснухи.
- особам із тяжкою формою гуморального або клітинного імунодефіциту (первинного чи набутого), наприклад, важким комбінованим імунодефіцитом, агаммаглобулінемією і СНІД або симптоматичною ВІЛ-інфекцією або віковим відсотоком CD4 + T-лімфоцитів у дітей віком до 12 місяців: CD4 + <25%; у дітей віком від 12-35 місяців: CD4 + <20%; у дітей віком від 36-59 місяців: CD4 + <15% (див.також розділ «Особливості застосування»).
- вагітним жінкам. Слід уникати вагітності не менше ніж один місяць після вакцинації(див. розділ "Застосування в період вагітності та годування груддю").
- як і для інших вакцин, введення вакцини ПРІОРИКСтм слід відкласти для осіб з лихоманкою. Проте, присутність незначних інфекцій, таких як застуда, не повинно призводити до відкладення вакцинації.
ОСОБЛИВІ ЗАХОДИ БЕЗПЕКИ.Відновлена вакцина внаслідок незначних коливань рН може змінювати колір від чисто персикового до кольору рожевої фуксії, що не впливає на ефективність вакцини.
Перед введенням вакцини слід оглянути розчинник і розчинену вакцину на відсутність в них будь-яких твердих сторонніх включень та/або зміну фізичних властивостей. У випадку наявності сторонніх частинок або зміни фізичних властивостей потрібно утилізувати розчинник або розчинену вакцину.
ВЗАЄМОДІЯ З ІНШИМИ ЛІКАРСЬКИМИ ЗАСОБАМИ ТА ІНШІ ВИДИ ВЗАЄМОДІЙ. У випадку, якщо пацієнту потрібно зробити туберкулінову пробу, то її слід провести перед вакцинацією, оскільки є дані про те, що жива вакцина для профілактики кору (та, можливо, епідемічного паротиту) може спричинити тимчасове зниження чутливості шкіри до туберкуліну. Така анергія може продовжуватися від 4до6 тижнів і, щоб уникнути
хибних негативних результатів, протягом цього періоду після вакцинації туберкулінову пробу проводити не слід.
Клінічні дослідження показали, що вакцину ПРІОРИКСтм можна одночасно застосовувати з будь-якою моновалентною або комбінованою вакциною зазначеною нижче: гексавалентною вакциною для профілактики дифтерії, правця, кашлюку (ацелюлярний компонент), гепатиту В, поліомієліту та захворювань, збудником яких єHaemophilus influenzae типуb (DTPa-HBV-IPV/Hib),вакциною для профілактики дифтерії, правця та кашлюку (ацелюлярний компонент) (DTPa), вакциною для профілактики дифтерії, правця та кашлюку (ацелюлярний компонент) зі зменшеним вмістом антигенів (dTpa), вакциною для профілактики захворювань, викликанихHaemophilus influenzae типу b (Hib), інактивованою поліовірусною вакциною (IPV), вакциною для профілактики гепатиту А (HepA), вакциною для профілактики гепатиту В (HepВ), кон’югованою вакциною проти менінгококової інфекції серотипу В (MenB), кон’югованою вакциною проти менінгококової інфекції серотипу С (MenС), кон’югованою вакциною проти менінгококової інфекції серотипів A, C, W-135,Y (MenACWY), вакциною для профілактики вітряної віспи та кон’югованою вакциною проти пневмококової інфекції (PCV).
До того ж, загалом вважається те, що комбінована вакцина для профілактики кору, епідемічного паротиту і краснухи може бути введена одночасно з пероральною вакциною для профілактики поліомієліту, цільноклітинною вакциною для профілактики дифтерії, правця та кашлюку (DTPw).
При застосуванні вакцини ПРІОРИКСтм одночасно з іншими вакцинами, ін’єкції завжди необхідно робити у різні ділянки тіла.
Якщо вакцина ПРІОРИКСтм не може бути введена одночасно з іншими живими атенуйованими вакцинами, між вакцинаціями слід дотримуватися інтервалу, щонайменше, в один місяць.
У осіб, які одержали людські імуноглобуліни або переливання крові, вакцинація повинна бути відкладена щонайменше на три місяці через імовірність наявності пасивно набутих антитіл до вірусів кору, епідемічного паротиту та краснухи.
Вакцину ПРІОРИКСтм можна вводити як бустерну дозу особам, що раніше були вакциновані іншою комбінованою вакциною для профілактики кору, епідемічного паротиту і краснухи.
ОСОБЛИВОСТІ ЗАСТОСУВАННЯ.
Так само, як і у випадку імунізації іншими вакцинами, введення ПРІОРИКСтм потрібно відкласти у осіб, хворих на гострі, важкі захворювання з лихоманкою. Проте, наявність незначної інфекції не є протипоказанням для вакцинації.
Синкопе (непритомність) може виникнути під час або раніше будь-якої ін’єкційної вакцинації, як психогенна реакція на голку. Вакцинацію необхідно проводити тільки в положенні вакцинованого сидячи або лежачи, та залишаючи його в тому ж положенні (сидячи або лежачи) протягом 15 хвилин після вакцинації для попередження ризику його травматизації.
Пацієнтам з рідкісними спадковими проблемами такими, як непереносимість фруктози, необхідно проконсультуватися з лікарем, перш ніж бути щепленими вакциною ПРІОРИКСтм, так як вакцина містить сорбітол.
Перш ніж робити ін’єкцію, потрібно зачекати, доки з поверхні шкіри повністю випарується спирт або інші дезінфікуючі засоби, оскільки вони можуть призвести до інактивації ослаблених вірусів, які містяться у вакцині.
Обмеженого захисту від кору можна досягти за допомогою вакцинації, яка зроблена не пізніше, ніж через 72години після того, як людина контактувала з хворим на кір.
Діти віком до 12місяців можуть не реагувати відповідним чином на коровий компонент вакцини внаслідок можливої наявності материнських антитіл до кору. Це не повинно перешкоджати застосуванню вакцини для маленьких дітей (віком до 12місяців), оскільки вакцинація може бути показана в деяких ситуаціях, наприклад, у районах з високим ризиком захворювання. За подібних обставин слід передбачити повторну вакцинацію, коли дитині виповниться 12місяців або у старшому віці.
Як і для всіх ін’єкційних вакцин, відповідна допомога та медичний нагляд завжди повинні бути легко доступними у випадку виникнення рідкісних анафілактичних реакцій після введення вакцини. Тому пацієнти повинні бути під наглядом не менше 30 хвилин після вакцинації.
Коровий та паротитний компоненти вакцини отримують на клітинних культурах курячих ембріонів і тому можуть містити слідову кількість яєчного білка. Особи, які мають в анамнезі анафілактичну, анафілактоїдну або іншу реакцію негайного типу (наприклад, генералізована кропив’янка, набряк рота та глотки, утруднене дихання, гіпотензія або шок) після вживання яєць можуть мати підвищений ризик виникнення реакцій гіперчутливості негайного типу після вакцинації, хоча реакції такого типу виникають дуже рідко. Особам, у яких в минулому була анафілаксія після вживання яєць, вакцинацію слід проводити вкрай обережно, за наявності необхідних можливостей лікування анафілаксії, якщо така реакція виникне.
Вакцину ПРІОРИКСтм слід вводити з обережністю особам із наявністю в анамнезі або в сімейному анамнезі алергічних захворювань, або тим, у кого в анамнезі або в сімейному анамнезі спостерігалися судоми.
Не були документально зафіксовані випадки передачі вірусів кору та паротиту від вакцинованої особи до сприятливих осіб при контакті. Відомо про фарингеальні виділення вірусу краснухи в проміжку часу від 7 до 28-годнів після вакцинації, з максимальним виділенням приблизно на 11-йдень. Проте немає жодних доказів передачі цього вірусу, який виділяється, особам, що мали контакт з вакцинованим.
Обмежена кількість обстежених осіб одержувала ПРІОРИКСтм внутрішньом’язово. Була одержана адекватна імунна реакція для всіх трьох компонентів вакцини (див. розділ «Спосіб застосування та дози»).
ПРІОРИКС тм не можна вводити внутрішньосудинно.
Як і для інших вакцин, захисну імунну відповідь можна отримати не у всіхвакцинованих.
Повідомляли про випадки погіршення тромбоцитопенії та рецидиву тромбоцитопенії у осіб, які страждали на тромбоцитопенію, після застосування першої дози живої вакцини для профілактики кору, епідемічного паротиту та краснухи. В таких випадках слід уважно оцінити співвідношення ризику та користі від вакцинації за допомогою вакцини ПРІОРИКСтм. Ці пацієнти повинні бути вакциновані з обережністю і з використанням підшкірного введення.
Існують обмежені дані про використання вакцини ПРІОРИКСтм у осіб із ослабленим імунітетом, тому можливість проведення вакцинації слід розглядати з обережністю і тільки тоді, коли, на думку лікаря, користь від щеплення переважає можливі ризики (наприклад, пацієнти з безсимптомним перебігом ВІЛ-інфекції, дефіцитом субкласу IgG, вродженою нейтропенією, з хронічним гранулематозом та дефіцитом комплементу).
Особи з ослабленим імунітетом, що не мають протипоказань до цієї вакцинації (див. «Протипоказання»), можуть не отримати належної імунної відповіді, як і імунокомпетентні особи, тому у деяких із цих осіб можуть розвинутися кір, епідемічний паротит та краснуха, незважаючи на проведення відповідної вакцинації. Особи з ослабленим імунітетом повинні проходити ретельне обстеження на наявність ознак кору, епідемічного паротиту та краснухи.
Застосування у період вагітності або годування груддю.
Вагітних жінок не можна вакцинувати із застосуванням вакцини ПРІОРИКСтм.
Проте не було виявлено випадків завдання шкоди плодові при введенні вакцини вагітним жінкам для профілактики кору, епідемічного паротиту чи краснухи.
Навіть якщо теоретичний ризик не може бути виключений, жодного випадку синдрому вродженої краснухи не було зареєстровано при спостереженні за понад 3500 сприйнятливими жінками, які, не знаючи про вагітність, були вакциновані на ранніх термінах вагітності вакцинами, що містили компонент для профілактики краснухи. Тому, ненавмисна вакцинація вагітних жінок, які не знали про свою вагітність, вакцинами для профілактики кору, епідемічного паротиту та краснухи, не повинна бути причиною для переривання вагітності.
Слід уникати вагітності не менше ніж один місяць після вакцинації. Жінкам, які планують завагітніти, рекомендовано відкласти вагітність.
Даних щодо введення вакцини жінкам, які годують дітей груддю, немає. Таких осіб можна вакцинувати в тому випадку, якщо користь від вакцинації перевищує ризик.
Здатність впливати на швидкість реакції при керуванн і автотранспортом або іншими механізмами
ПРІОРИКСтм не має або має незначний вплив на здатність керувати транспортними засобами і машинами.
СПОСІБ ЗАСТОСУВАННЯ ТА ДОЗИ.Рекомендується одноразова доза розчиненої вакцини (0,5мл) для імунізації дітей віком старше 12місяців.
При проведенні імунізації на території України щодо схем імунізації, протипоказань та взаємодії з іншими медичними препаратами слід керуватися діючими нормативними документами МОЗ України.
Вакцину потрібно вводити згідно з рекомендованим графіком у відповідності з офіційними рекомендаціями. ПРІОРИКСтм призначений для підшкірної ін’єкції, хоча можна також вводити внутрішньом’язово в ділянку дельтоподібного м’яза або передню частину стегна (див. розділ «Особливості застосування»).
Вакцину необхідно вводити підшкірно пацієнтам з розладами кровотечі (наприклад, тромбоцитопенією або порушеннями згортання крові).
Інструкція до застосування/приготування вакцини
Інструкції щодо відновлення вакцини за допомогою розчинника у попередньо наповненому шприці для однократного введення
ПРІОРИКСä слід розчинити шляхом додавання всього вмісту розчинника в попередньо наповненому шприці до флакону, в якому міститься ліофілізат.
Щоб прикріпити голку до шприца, слід дивитись на малюнок нижче. Однак шприц, що надається з вакциною ПРІОРИКСä, може дещо відрізнятись від шприца, вказаного на малюнку
Захисний ковпачок |

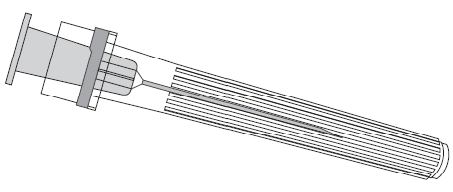 Голка
Голка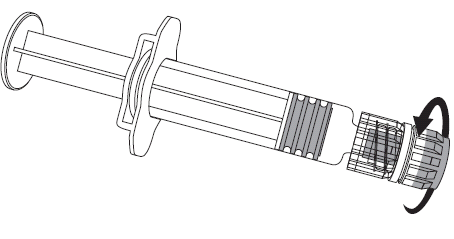 Шприц
Шприц
Поршень шприца |
Циліндр шприца |
Кришечка шприца |
1. Утримуючициліндр шприца однією рукою (уникати тримання за поршень шприца) потрібно викрутити кришечку шприца, повертаючи її проти годинникової стрілки.
2. Щоб прикріпити голку до шприца, потрібно її приєднати, повертаючи за годинниковою стрілкою, доки не з’явиться відчуття, що він закритий (дивися малюнок).
3. Зняти захисний ковпачок з голки, який іноді може зніматися із зусиллям.
Доза для однократного введення:
Ввести весь вміст флакону, використовуючи нову голку для введення.
Інструкції щодо відновлення вакцини за допомогою розчинника, представлених в ампулах
ПРІОРИКСтм необхідно розчинити шляхом додавання всього вмісту ампули розчинника, що додається, у флакон, в якому міститься ліофілізат. Після додавання розчинника суміш слід струшувати, поки ліофілізат не розчиниться повністю в розчиннику. Вакцину слід відразу ввести після відновлення.
Для багатократного введення (2 дози):
При використанні флакону для багатократного дозування, кожну дозу 0,5 мл слід набирати за допомогою нового шприца та нової стерильної голки; слід бути обережним, щоб уникнути забруднення вмісту, препарат повинен вилучатись з флакона при строгому дотриманні правил асептики.
Після відновлення вакцину слід відразу застосувати.
Будь-який невикористаний препарат або відходи мають бути знищені у відповідності до місцевих вимог.
Якщо відновлена вакцина не була використана негайно, її потрібно зберігати в холодильнику при температурі від 2 до 8 °C і використати впродовж:
· 8 годин після відновлення для однодозової упаковки;
· 6 годин після відновлення для багатодозової (2 дози) упаковки.
Діти.Немає даних щодо безпеки та ефективності ПРІОРИКСтм у дітей молодше 9 місяців. (Додатководив. розділ «О собливості застосування »).
ПЕРЕДОЗУВАННЯ:за даними постмаркетингового нагляду було 2 повідомлення про випадки передозування (у дозах, що у 2 рази перевищували рекомендовані). Побічних реакцій, пов’язаних з цим передозуванням, не спостерігалося.
ПОБІЧНІ РЕАКЦІЇ.При проведенні контрольованих клінічних випробувань вакцини активно контролювали ознаки та симптоми побічних реакцій протягом 42 днів після вакцинації. Вакцинованих осіб просили також сповістити про будь-які клінічні випадки в період дослідження. Профіль безпеки, наведений нижче, базується на спостереженні за приблизно 12000 вакцинованих осіб, які приймали участь у клінічних дослідженнях.
Найбільш частими побічними реакціями після введення ПРІОРИКСтм були почервоніння в місці ін'єкції, температура ³ 38°C (ректальна) або ³37,5°C (підпахвинна /оральна).
Клінічні події, про які було повідомлено, класифікуються за частотою наступним чином:
Дуже часто: ³1/10
Часто: ³1/100 та <1/10
Нечасто: ³1/1000 та <1/100
Рідко: ³1/10000 та <1/1000
Дуже рідко: <1/10000
Клас системи органів | Частота | Побічні явища |
Інфекції та інвазії | Нечасто | середній отит |
Часто | інфекції верхніх дихальних шляхів | |
Порушення з боку кровоносної та лімфатичної систем | Нечасто | лімфаденопатія |
Порушення з боку імунної системи | Рідко | алергічні реакції |
Порушення з боку обміну речовин та системи травлення | Нечасто | анорексія |
Психічні розлади | Нечасто | підвищена збудливість, безпричинний плач, безсоння |
Порушення з боку нервової системи | Рідко | фебрильні судоми |
Порушення з боку органа зору | Нечасто | кон’юнктивіт |
Респіраторні, торакальні та медіастинальні порушення | Нечасто | бронхіт, кашель |
Порушення з боку шлунково-кишкового тракту | Нечасто | збільшення привушних слинних залоз, діарея, блювання |
Порушення з боку шкіри та підшкірної клітковини | Часто | висипи |
Загальні розлади та реакції в місці ін’єкції | Дуже часто | почервоніння в місці ін’єкції, температура ³ 38°C (ректальна) або ³37,5°C (підпахвинна /оральна) |
Часто | біль та набряк у місці ін’єкції, температура > 39,5°C (ректальна) або > 39°C (підпахвинна/оральна) |
Загалом, категорії частоти виникнення побічних реакцій були подібними після імунізації першою та другою дозою вакцини, за винятком болю в місці введення, що виникав часто після застосування першої дози вакцини та дуже часто – після другої дози.
Дані постмаркетингового нагляду
Під час постмаркетингового спостереження додатково повідомлялося про такі клінічні події, що за часом пов’язувалися з вакцинацією ПРІОРИКСтм. В зв'язку з тим, що про ці побічні реакції повідомлялося спонтанно, неможливо достовірно оцінити їх частоти.
Клас системи органів | Побічні явища |
Інфекції та інвазії | менінгіт, короподібний синдром, паротитоподібний синдром (включаючи орхіт, епідеміт і паротит) |
Порушення з боку кровоносної та лімфатичної систем | тромбоцитопенія, тромбоцитопенічна пурпура |
Порушення з боку імунної системи | анафілактичні реакції |
Порушення з боку нервової системи | енцефаліт*, церебаліт, церебалітоподібні симптоми (включаючи транзиторні порушення ходи та транзиторну атаксію), синдром Гієна-Барре, поперечний мієліт, периферичний неврит |
Судинні розлади | васкуліт (включаючи пурпуру Геноха–Шенлейна і синдром Кавасакі) |
Порушення з боку шкіри та підшкірної клітковини | поліморфна еритема |
Порушення з боку скелетно-м’язової та сполучної тканини | артралгія, артрит |
*Про енцефаліт повідомлялося з частотою менше 1 випадку на 10 млн доз. Ризик захворювання енцефалітом викликаним застосуванням вакцини набагато нижчий ніж ризик захворювання енцефалітом викликаним природним (диким) вірусом, (кір: 1 на 1000 до 2000 випадків; свинка: 2-4 в 1000 випадках; краснухи: приблизно 1 з 6000 випадків).
При проведенні порівняльних досліджень із застосуванням інших комбінованих вакцин для профілактики кору, епідемічного паротиту і краснухи випадки болю, почервоніння та
набряку в місці ін’єкції після введення ПРІОРИКСтм спостерігали рідше, в той час, як частота інших несприятливих реакцій була такою ж.
Випадкове внутрішньо судинне введення може призвести до важкої реакції або навіть шоку. Застосування негайних заходів залежить від тяжкості реакції (дивись розділ «Особливості застосування»).
Звітування про побічні реакції. Звітування про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дозволяє здійснювати безперервний моніторинг співвідношення між користю та ризикм пов’язаним із застосуванням лікарського засобу. Медичним працівникам необхідно повідомляти про будь-які побічні реакції.
ТЕРМІН ПРИДАТНОСТІ.2 роки.
Відновлену вакцину слід використати негайно. Якщо відновлена вакцина не була використана негайно, її потрібно зберігати в холодильнику при температурі від 2 до 8 °C і використати впродовж:
· 8 годин після відновлення для однодозової упаковки;
· 6 годин після відновлення для багатодозової (2 дози) упаковки.
УМОВИ ЗБЕРІГАННЯ. Зберігати при температурі від 2 до 8 °C. Захищати від світла. Не заморожувати. Зберігати у недоступному для дітей місці. Розчинник можна зберігати в холодильнику або при кімнатній температурі. Для отримання інформації про термін придатності вакцини після відновлення, будь ласка, зверніться до розділу «Термін придатності».
НЕСУМІСНІСТЬ.ПРІОРИКСтм не слід змішувати з іншими лікарськими засобами та вакцинами в одному шприці.
УПАКОВКА.
Ліофілізат для розчину для ін’єкцій у монодозових (1 доза) флаконах у комплекті з розчинником у попередньо наповненому шприці №1 у комплекті з двома голками; монодозових (1 доза) флаконах №100 у комплекті з розчинником у ампулах № 100 в окремій упаковці; мультидозових (2 дози) флаконах №100 у комплекті з розчинником у ампулах № 100 в окремій упаковці.
Для 1 дози: один шприц з розчинником (0,5 мл), дві голки та флакон з ліофілізатом у вакуумній стерильній упаковці вкладають у картонну коробку разом з інструкцією для медичного застосування. Або 100 флаконів у окремій коробці разом з інструкцією для медичного застосування та 100 скляних ампул з розчинником (0,5 мл) в окремій коробці.
Для 2 доз: мультидозові флакони вкладають у окрему коробку по 100 штук разом з інструкцією для медичного застосування. Розчинник (1 мл) у скляних ампулах по 100 штук в окремій коробці.
Монодозові та мультидозові флакони, попередньо наповнені шприци і ампули виготовлені з нейтрального скла типу 1, що відповідає вимогам Європейської Фармакопеї.
КАТЕГОРІЯ ВІДПУСКУ. За рецептом.
ВИРОБНИК.
ГлаксоСмітКляйн Біолоджікалз С.А., Бельгія/GlaxoSmithKline Biologicals S.A., Belgium.
МІСЦЕЗНАХОДЖЕННЯ ВИРОБНИКА ТА ЙОГО АДРЕСА МІСЦЯ ПРОВАДЖЕННЯ ДІЯЛЬНОСТІ.
Рю де л’Інстітю, 89 1330 м. Ріксенсарт, Бельгія/Rue de l'Institut, 89 1330 Rixensart, Belgium.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО



