ХІБЕРИКС™/HIBERIX™ ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ ЗАХВОРЮВАНЬ, ЗБУДНИКОМ ЯКИХ Є HAEMOPHILUS INFLUENZAE ТИПУ B
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.

Інструкція
для застосування
медичного імунобіологічного препарату
ХІБЕРИКСтм/
H IBERIX тм
Вакцина для профілактики захворювань, збудником яких
є Haemophilus influenzaeтипуb
ЗАГАЛЬНА ХАРАКТЕРИСТИКА:
міжнародна непатентована назва: Haemophilus influenzae B vaccine combinations with toxoids
основні властивості лікарської форми: ХІБЕРИКСтм являє собою білий брикет чи порошок, який знаходиться в скляному флаконі, укупореному гумовою пробкою. Після відновлення розчинником при випуску: прозорий та безбарвний розчин; протягом терміну придатності: безбарвний розчин від прозорого до опалесцюючого (не більше за еталон VI).
Розчинник - прозора та безбарвна рідина.
ХІБЕРИКСтм відповідає вимогам Всесвітньої організації охорони здоров’я до виготовлення біологічних речовин та кон’югованих Hib-вакцин (Hib - скорочено за першими литерами та типом збудника:Haemophilus influenzaeтипу b)
ЯКІСНИЙ ТА КІЛЬКІСНИЙ СКЛАД: після розчинення, 1 доза (0,5 мл) вакцини містить:діючі речовини:не менше 10 мкг очищеного капсулярного полісахариду Haemophilus influenzaeтипу b, ковалентно зв’язаного з ~25 мкг правцевого анатоксину.
Допоміжні речовини: лактоза.
Розчинник: стерильний фізіологічний розчин.
ФОРМА ВИПУСКУ.Ліофілізат та розчинник для розчину для ін’єкцій.
КОД АТС.J07AG01.
ІМУНОЛОГІЧНІ ТА БІОЛОГІЧНІ ОСОБЛИВОСТІ.
Первинна вакцинація
У таблиці 1 представлені результати імуногеності з 4 клінічних випробувань, в яких діти в Сполучених Штатах Америки, Європі, Південній Америці та Південно-Східній Азії отримали по 3 дози курсу первинної вакцинації вакциною ХІБЕРИКС™ в перші 6 місяців життя, починаючи з 6-тижневого віку. Різні схеми вакцинації були оцінені, і ХІБЕРИКС™ вводили одночасно з іншими зазвичай рекомендованими вакцинами.
ХІБЕРИКС™ продемонстрував імуногенність у всіх дослідженнях з 3-дозовим графіком вакцинації. Концентрація антитіл до полірибосилрибітолу фосфату (PRP) ≥ 0,15 мкг/мл (рівень показовий для короткострокової захисту) була отримана у 96,6-99,4% немовлят через один місяць після завершення курсу вакцинації.
Таблиця 1. Відсоток пацієнтів з концентрацією антитіл ≥ 0,15 мкг/мл через один місяць після первинної вакцинації вакциною ХІБЕРИКС™.
Дослідження | Вік первин ної вакцинації | N | Одночасно вводились вакцини | % вакцинованих з концентрацією антитіл до PRP ≥ 0 , 15 мкг/мл (95 % ДІ) |
Hib-097 | 2-4-6 місяців | 1590 | DTPa-HBV-IPV PCV13 HRV | 96,6 (95,6; 97,4) |
DTPw-HBV-Hib-008 PRI | 2-4-6 місяців | 171 | DTPw-HBV | 99,4 (96,8;100) |
DTPa-HBV-IPV-005 | 3-4-5 місяців | 410 | DTPa-HBV-IPV або DTPa-HBV-IPV + OPV (при третій дозі) | 99,0 (97,5; 99,7) |
DTPw-HBV = Hib Kft-001 | 6-10-14 тижнів | 175 | DTPw-HBV | 99,4 (96,9; 100) |
ДІ: довірчий інтервал;
DTPw-HBV: комбінована вакцина проти дифтерії, правця, кашлюку (цільноклітинна) і гепатиту B;
DTPa-HBV-IPV: комбінована вакцина проти дифтерії, правця, кашлюку (ацелюлярна), гепатиту B та поліомієліту;
HRV: вакцина проти ротавірусної інфекції;
N: кількість вакцинованих пацієнтів з ATP групи (ATP - відповідно до протоколу) (за винятком дослідження DTPw-HBV-Hib-008, де вказана кількість для загальної групи вакцинованих);
ОPV: оральна вакцина проти поліомієліту;
PCV13: 13-валентна кон’югована пневмококова вакцина;
PRP: полірибосилрибітолу фосфат.
Крім того, у малюків віком 22-26 місяців, які не отримали первинний комплекс вакцинації але отримали одну дозу препарату ХІБЕРИКС™, одночасно введену з DTPa (вакцина проти дифтерії, правця та кашлюка (ацелюлярна)), 100% вакцинованих [N = 54, 95% ДІ (93,4; 100)] досягли концентрації антитіл до PRP ≥ 1,0 мкг/мл через один місяць після вакцинації (дослідження Hib-036). Ці дані підтверджують ефективність однієї дози препарату ХІБЕРИКС™ у дітей віком від 1 року.
Бустерна вакцинація
Імунна відповідь на бустерну імунізацію вакциною ХІБЕРИКС™ після 3-дозової первинної вакцинації представлена в таблиці 2. Через один місяць після введення бустерної дози всі діти мали концентрації антитіл до PRP ≥ 0,15 мкг/мл і щонайменше 99,1% мали концентрацію антитіл до PRP ≥ 1,0 мкг/мл, що корелює з довгостроковим імунітетом до Hib (таблиця 2).
Таблиця 2. Відсоток пацієнтів з концентрацією антитіл ≥ 1,0 мкг/мл через один місяць після бустерної вакцинації препаратом ХІБЕРИКС™.
Дослідження | N | Вік первин ної вакцинації | Вік бустерної вакцинації | Одночасно вводились вакцини | % вакцинованих з концентрацією а нти тіл до PRP ≥ 1 , 0 мкг/мл (95% ДІ) |
Hib-097 | 336 | 2-4-6 місяців | 15-18 місяців | DTPa | 99,1 (97,4; 99,8) |
DTPw-HBV-Hib-008 BST | 161 | 2-4-6 місяців | 18 місяць | DTPw-HBV | 99,4 (96,6; 100) |
DTPw-HBV=Hib Kft-003 | 74 | 6-10-14 тижнів | 15-18 місяців | DTPw-HBV | 100% (95,1;100) |
ДІ: довірчий інтервал;
N: кількість вакцинованих пацієнтів з АТР групи;
DTPa: комбінована вакцина проти дифтерії, правця, кашлюку (ацелюлярна);
DTPw-HBV: комбінована вакцина проти дифтерії, правця, кашлюку (цільноклітинна) і гепатиту B;
PRP: полірибосилрибітолу фосфат.
Оцінка фармакокінетичних властивостей не є обов’язковою для вакцин.
КЛІНІЧНІ ХАРАКТЕРИСТИКИ.
ПОКАЗАННЯ ДО ЗАСТОСУВАННЯ.
Активна імунізація проти захворювань, що викликаютьсяHaemophilus influenzaeтипуb.
ПРОТИПОКАЗАННЯ.
ВакцинуХІБЕРИКСтм не слід вводити особам з підвищеною чутливістю до будь-якої речовини, що входить до складу вакцини, а також особам, у яких після попереднього введення Hib вакцин з'явились ознаки гіперчутливості.
Взаємодія з іншими медичними препаратами та інші види взаємодії. Вакцину ХІБЕРИКСтм можна вводити до, після або одночасно з іншими інактивованими або живими вакцинами (окрім БЦЖ).ХІБЕРИКС™можна змішувати в одному й тому ж шприці з окремими вакцинами виробництва ГлаксоСмітКляйн - ІНФАНРИКС™ (комбінована вакцина для профілактики дифтерії, правця, кашлюку ацелюлярна очищена інактивована рідка) або ТРИТАНРИКС™ Геп В (комбінована вакцина для профілактики дифтерії, правця, кашлюку та гепатиту В).
Ін’єкції різними вакцинами слід робити у різні ділянки тіла.
Вакцину ХІБЕРИКСТМ не можна змішувати з іншими вакцинами в одному й тому ж шприці (за винятком схвалених комбінацій).
Як і для інших вакцин, можна очікувати, що у пацієнтів, які отримують імуносупресивну терапію або у пацієнтів з імунодефіцитом може не досягатися адекватна імунна відповідь.
ОСОБЛИВОСТІ ЗАСТОСУВАННЯ.
Як і при застосуванні інших вакцин, у разі гострого захворювання, що супроводжується лихоманкою, вакцинацію вакциною ХІБЕРИКСтм слід відкласти.
Однак, наявність інфекційного захворювання легкого ступеню не є протипоказанням для введення ХІБЕРИКСтм.
Як і при використанні інших вакцин, що вводяться ін'єкційно, у разі виникнення рідкісних анафілактичних реакцій після їх введення необхідно забезпечити нагляд за пацієнтом, якому проведено вакцинацію та умови щодо надання невідкладної медичної допомоги. У зв'язку з цим вакцинована особа повинна знаходитись під медичним наглядом протягом 30 хвилин після вакцинації.
Наявність ВІЛ-інфекції не вважається протипоказанням для введення ХІБЕРИКСтм.
Зважаючи на обмежену імунну відповідь на правцевий анатоксин, який є компонентом вакцини, вакцинація однією тільки вакциною ХІБЕРИКСтм не може замінити стандартну протиправцеву вакцинацію.
Описана екскреція капсулярного полісахаридного антигену із сечею після отримання Hib-вакцин, і, отже, виявлення антигену не може мати діагностичного значення при підозрі на захворювання, викликане Hib, протягом 1-2 тижнів після вакцинації.
Ні за яких обставин вакцину ХІБЕРИКСтм не можна вводити внутрішньо венно
При призначенні первинної імунізації дуже передчасно народженим немовлятам (≤ 28 тижнів гестації) слід мати на увазі потенційний ризик розвитку у них апное та необхідність контролю за дихальною функцією протягом 48-72 годин після вакцинації, особливо у випадку, якщо новонароджений має в анамнезі недорозвинення дихальної системи. Оскільки користь вакцинації у цієї групи немовлят є високою, від вакцинації не слід відмовлятись або її затримувати.
Синкопе (непритомність) може виникнути під час або раніше будь-якої ін’єкційної вакцинації, як психогенна реакція на ін’єкцію голкою. Вакцинацію необхідно проводити тільки в положенні вакцинованого сидячи або лежачи, та залишаючи його в тому ж положенні (сидячи або лежачи) протягом 15 хвилин після вакцинації для попередження ризику його травматизації.
Застосування у період вагітності або годування груддю.
Оскільки ХІБЕРИКС™ не призначений для дорослих, дані щодо застосування вакцини жінкам в період вагітності або годування груддю та адекватні репродуктивні дослідження на тваринах відсутні.
Вплив на здатність керува ння автомобілем та роботу з механізмами
Не стосується даної групи.
СПОСІБ ЗАСТОСУВАННЯ І ДОЗИ.
Первинна вакцинація.
Дітям віком до 13 місяців: по три дози по 0,5 мл кожна з інтервалом між дозами не менше 4 тижнів, першу дозу слід призначити дітям віком від 2 місяців життя.
Дітям віком від 13 місяців: одна доза по 0,5 мл.
Вторинна вакцинація.
Після первинної вакцинації, протягом якої введено одну або три дози вакцини ХІБЕРИКС™ разом з вакциною Інфанрикс, слід призначити додаткову (четверту) дозу вакцини з Hib-кон’югатом.
Дітям, яким було введено протягом первинної вакцинації вакцину ХІБЕРИКС™, можно призначити вторинну вакцинацію препаратом ХІБЕРИКС™ або іншими вакцинами з Hib-кон’югатом. Відповідно, вакцину ХІБЕРИКС™ можна призначити для вторинної вакцинації дітей, у яких первинну вакцинацію проводили іншими вакцинами з Hib-кон’югатом.
Вакцина ХІБЕРИКС™ призначена для внутрішньом’язового введення. Проте, відповідно до належної клінічної практики, хворим з тромбоцитопенією чи кровотечами вакцину слід вводити підшкірно.
При проведенні імунізації на території України щодо схем імунізації, протипоказань та взаємодії з іншими медичними імунобіологічними препаратами слід керуватися діючими наказами МОЗ України.
Інструкція стосовно використання вакцини:
Розчинник та відновлену вакцину слід перевірити візуально на наявність будь-яких сторонніх часток та/або зміну зовнішнього вигляду перед введенням. Якщо помічено будь-яке відхилення, не використовуйте вакцину.
Інструкції з відновлення вакцини розчинником, що поставляється у флаконах або ампулах:
ХІБЕРИКСтм повинна бути відновлена шляхом перенесення усього вмісту флакону або ампули з розчинником, що постачається в упаковці, до флакона, який містить ліофілізат. Після перенесення розчинника до флакону з ліофілізатом суміш слід добре струсити, поки ліофілізат повністю не розчиниться в розчиннику. Відновлена вакцина представляє собою безбарвний розчин від прозорого до опалесцюючого.
При застосуванні флакону для багатократного дозування, кожну дозу слід набирати за допомогою стерильної голки та шприца. Як і для інших вакцин, доза має бути вилучена в строго асептичних умовах, і мають бути застосовані запобіжні заходи для уникнення забруднення вмісту флакону.
Вакцину слід використати одразу ж після відновлення.
Для введення вакцини слід використовувати нову голку.
Набирають весь вміст флакону у шприц.
Інструкції з відновлення вакцини розчинником, що поставляється у попередньо наповненому шприці:
Вакцину ХІБЕРИКСтм відновлюють шляхом додання всього вмісту попередньо заповненого шприца з розчинником до флакону, що містить порошок.
Для того, щоб надіти голку на шприц, дивися зображення нижче. Зверніть увагу, що шприц, який поставляється з вакциною ХІБЕРИКСтм, може дещо відрізнятися від шприца, зображеного на малюнку.
|
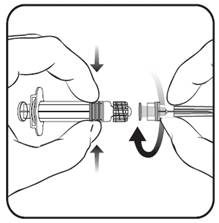

![]() Голка
Голка
 Шприц
Шприц
|
|
|
1.Тримайте циліндр шприца однією рукою (не тримайте шприц за поршень), відкрутіть кришечку шприца, повернувши її проти годинникової стрілки.
2. Щоб приєднати голку до шприца, вкрутіть голку за годинниковою стрілкою в шприц до тих пір, поки не відчуєте, що голка зафіксована (див. зображення)
3. Зніміть ковпачок з голки, що іноді може потребувати деяких зусиль.
Додайте розчинник до ліофілізату. Після додання розчинника до ліофілізату суміш треба добре змішати до тих пір, поки порошок повністю не розчиниться у розчиннику.
Відновлена вакцина представляє собою безбарвний розчин від прозорого до опалесцюючого.
Вакцину слід використати одразу ж після відновлення.
Для введення вакцини використовують нову голку.
Наберіть в шприц весь вміст флакону
При сумісному використанні вакцини ХІБЕРИКСтм з вакцинами ІНФАНРИКС™ або ТРИТАНРИКС™ Геп В в одному шприці: ТРИТАНРИКС™ Геп В або ІНФАНРИКС™ представлені у вигляді суспензій. При зберіганні цих вакцин може спостерігатися розділення на білий осад і прозору надосадову рідину. Вакцину слід добре струсити для того, щоб одержати гомогенну мутну білу суспензію, і перед використанням візуально перевірити на наявність будь-яких сторонніх частинок та/або відхилення фізичних характеристик. У випадку, якщо будь-що з перерахованого спостерігається, вакцину не використовувати. Знищити стерильний розчинник, що постачається разом з вакциною ХІБЕРИКСтм.
Суспензію ІНФАНРИКС™ або ТРИТАНРИКС™ Геп В використайте як розчинник для ліофілізованої вакцини ХІБЕРИКС™ взамін розчинника, який постачається разом із вакциною ХІБЕРИКС™. Для цього одну з вказаних вакцин переносять до флакону, який містить білий ліофілізат вакцини ХІБЕРИКС™. Після перенесення вакцин ІНФАНРИКС™ або ТРИТАНРИКС™ Геп В до флакону з вакциною ХІБЕРИКС™ одержану суміш необхідно добре струсити, поки ліофілізат повністю не розчиниться в суспензії ІНФАНРИКС™ або ТРИТАНРИКС™ Геп В. Приготовлену таким чином комбіновану вакцину перед введенням слід візуально перевірити на наявність будь-яких сторонніх часток і/або відхилення фізичних характеристик. У випадку, якщо будь-що з перерахованого спостерігається, приготовлену вакцину не використовувати. Для введення вакцини слід використовувати нову голку. Комбінована вакцина повинна бути введена відразу ж після приготування.
Будь-який невикористаний препарат або відходи мають бути знищені у відповідності до місцевих вимог.
ПОБІЧНІ РЕАКЦІЇ.
Дані клінічних досліджень.
Дані щодо частоти побічних реакцій базуються на результатах обстеження приблизно 3000 дітей, що були включені в дослідження Hib-097, і приблизно 1200 дітей, що були включені в дослідження DTPa-HBV-IPV-011.
Побічні ефекти, наведені нижче, класифіковані за частотою таким чином:
Дуже часто: ³ 1/10
Часто: ³ 1/100 до < 1/10
Нечасто: ³ 1/1000 до < 1/100
Рідко: ³ 1/10000 до < 1/1000
Дуже рідко: < 1/10000
Порушення метаболізму та аліментарні розлади
Дуже часто: втрата апетиту.
Порушення психіки
Дуже часто: плач, дратівливість, неспокій.
Порушення функції нервової системи
Дуже часто: сонливість.
Рідко: судоми (у тому числі з гарячкою).
Порушення шлунково-кишкового тракту
Дуже часто: діарея.
Часто: блювання.
Загальні розлади та реакції у місці введення:
Дуже часто: підвищення температури, набряк, біль і почервоніння в місці ін’єкції.
Постмаркетингові дані.
Побічні ефекти, наведені нижче, класифіковані за наступною частотою: дуже рідкі <1/10000.
Порушення з боку імунної системи
Дуже рідкі:алергічні реакції (включаючи анафілактичні та анафілактоїдні реакції), ангіоневротичний набряк.
Порушення з боку нервової системи
Дуже рідкі:гіпотонічно-гіпореспонсивний епізод, судоми (з або без лихоманки), синкопе або судинні реакції на ін’єкцію вакцини.
Порушення з боку дихальної системи, органів грудної порожнини
Дуже рідкі:апное (див. розділ„Особливості застосування” для апное в передчасно народжених немовлят (≤ 28 тижнів гестації)).
Порушення з боку шкіри та підшкірних тканин
Дуже рідкі:кропивниця,висип.
Загальні розлади та порушення в місці введення
Дуже рідкі:розповсюджена припухлість кінцівки, в яку введена вакцина, індурація в місці введення.
Передозування.
Загалом, профіль небажаних явищ, про які повідомлялось після передозування, був схожий на такий, що спостерігається після введення рекомендованих доз препарату ХІБЕРИКС™.
ТЕРМІН ПРИДАТНОСТІ.
3 роки для вакцини, 5 років для розчинника.
Дата закінчення терміну зберігання вакцини зазначена на етикетці та упаковці.
УМОВИ ЗБЕРІГАННЯ.
Ліофілізат необхідно зберігати при температурі від 2 до 8 оС у захищеному від світла місці та недоступному для дітей місці. На ліофілізовану вакцину не впливає заморожування.
Розчинник можна зберігати у холодильнику (при температурі від 2 до 8 °С) або при температурі навколишнього середовища (до 25 °С) і не можна заморожувати.
УПАКОВКА.
Ліофілізат для розчину для ін’єкцій по 1 дозі у флаконі №1 в комплекті з розчинником у попередньо наповненому шприці №1 та двома голками; по 1 дозі у флаконах №100 у комплекті з розчинником у ампулах №100 в окремих коробках.
Флакони, попередньо наповнені шприци та ампули виготовлені з нейтрального скла типу І, що відповідає вимогам Європейської Фармакопеї.
КАТЕГОРІЯ ВІДПУСКУ.За рецептом.
ВИРОБНИК.
ГлаксоСмітКляйн Біолоджікалз С.А., Бельгія / GlaxoSmithKline Biologicals S.A., Belgium.
Місцезнаходження виробника та його адреса місця провадження його діяльності.
Рю де л’Інстітю, 89 1330 м. Ріксенсарт, Бельгія /Rue de l’Institut, 89 1330 Rixensart, Belgium.
Представник заявника.
ТОВ «ГлаксоСмітКляйн Фармасьютікалс Україна».
Місцезнаходження представника заявника та його адреса місця провадження діяльності.
02152, м. Київ, проспект Павла Тичини, буд. 1-В, тел. (044) 585-51-85, факс (044) 585-51-92.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО

