ФЛЮАРИКС™ ІНАКТИВОВАНА СПЛІТ-ВАКЦИНА ДЛЯ ПРОФІЛАКТИКИ ГРИПУ
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.

Інактивована спліт-вакцина для профілактики грипу
ЗАГАЛЬНА ХАРАКТЕРИСТИКА:
міжнародна непатентована назва:Influenza vaccine, inactivated.
основні властивості лікарської форми:Флюарикстм - це інактивована спліт-вакцина для профілактики грипу, що містить антигени вірусів грипу (культивованих на курячих ембріонах), еквівалентні до нижче наведених типів та підтипів
ЯКІСНИЙ ТА КІЛЬКІСНИЙ СКЛАД: Склад антигенів і штами для періоду захворюваності на грип, що наближається (2014-2015), визначені у відповідності до рекомендацій Всесвітньої Організації Охорони Здоров'я (ВООЗ) для Північної півкулі і відповідають таким типам та підтипам:
A/California/7/2009 (H1N1) pdm09 - подібний штам [варіант A/Christchurch/16/2010 (NIB-74xp)];
A/Texas/50/2012 (H3N2) - подібний штам [варіант A/Texas/50/2012 (NYMC X-223A)]; B/Massachusetts/02/2012 - подібний штам [варіант B/Massachusetts/02/2012 (NYMC BX-51B)].
Доза вакцини 0,5 мл містить по 15 мкг гемаглютинінів кожного рекомендованого штаму вірусу грипу.
Допоміжні речовини:натрію хлорид, динатрію фосфату додекагідрат, калію дигідрофосфат, калію хлорид, магнію хлориду гексагідрат, α-токоферолу гідросукцинат, полісорбат 80, октоксинол 10 та вода для ін'єкцій.
Флюарикстм відповідає вимогам ВООЗ щодо біологічних речовин та вакцин для профілактики грипу і вимогам щодо вакцин для профілактики грипу Європейської Фармакопеї.
ФОРМА ВИПУСКУ: суспензія для ін′єкцій.
КОД АТС: J07B B02.
ІМУНОЛОГІЧНІ і БІОЛОГІЧНІ ВЛАСТИВОСТІ:Флюарикстм індукує гуморальні антитіла проти гемаглютинінів. Ці антитіла нейтралізують віруси грипу. Титр гальмування гемаглютинації в сироватці крові, що дорівнює або більше 1:40, розглядається як захисний. Серопротекція розвивається протягом 2 - 3 тижнів. Тривалість післявакцинального імунітету до гомологічних або близькоспорідненних вакцинних штамів відрізняється, але зазвичай триває 6 - 12 місяців.
Флюарикстм забезпечує захист протягом найближчого періоду підвищеної захворюваності на грип.
Показники сероконверсії були оцінені для вакцини проти грипу сезону 2013-2014 рр., що містила A/California/7/2009 (H1N1) pdm09-подібний штам [варіант A/Christchurch/16/2010 (NIB-74xp)];
A/Victoria/361/2011 (H3N2)-подібний штам [варіант A/Texas/50/2012 (NYMC X-223A)]; B/Massachusetts/02/2012-подібний штам [варіант B/Massachusetts/02/2012 (NYMC BX-51B)].
Серологічні показники захисту після проведення вакцинації перевищували показники, встановлені Європейським Комітетом з лікарських препаратів для медичного застосування стосовно вакцин для профілактики грипу (> 70 % для дорослих віком 18-60 років та > 60 % для дорослих віком старше 60 років).
У клінічному дослідженні, проведеному за участю понад 7600 пацієнтів у Чехії та Фінляндії, оцінювали ефективність Флюарикстм щодо попередження лабораторно підтверджених випадків грипу А та/або В, викликаних вірусами, що за антигенним складом відповідають вакцинним штамам.
За вакцинованими особами спостерігали щодо появи симптомів грипоподібного заховорювання, після чого діагноз мав бути підтверджений лабораторно (див. таблицю 1). Діагноз грипоподібного захворювання визначали при наявності хоча б одного загального симптому (лихоманка ≥ 37,8°C та/або міалгія) та хоча б одного респіраторного симптому (кашель та/або фарингіт).
Таблиця 1.
Кількість випадків грипоподібного захворювання та ефективність вакцини проти лабораторно підтверджених випадків грипу A чи B у дорослих
віком від 18 до 64 років (загальна вакцинована група)
Кількість випадків (n/N)1 | Ефективність вакцини (95% CI2) | |||||
N | n | % | % | LL3 | UL | |
Лабораторно підтверджений грип, збудник якого відповідає антигеному складу вакцинних штамів4 | ||||||
Флюарикстм | 5103 | 49 | 1,0 | 66,9 | 51,9 | 77,4 |
Плацебо | 2549 | 74 | 2,9 | - | - | - |
Усі лабораторно підтверджені випадкі грипу (відповідний антигеному складу штамів, невідповідний та нетипований)5 | ||||||
Флюарикстм | 5103 | 63 | 1,2 | 61,6 | 46,0 | 72,8 |
Плацебо | 2549 | 82 | 3,2 | - | - | - |
1. n/N: число випадків/загальна кількість осіб
2. CI: довірчий інтервал
3. LL: нижня межа; UL - верхня межа
4. У групах, що отримали вакцину Флюарикстм чи плацебо, не було жодних лабораторно підтверджених випадків, викликаних вірусами грипу, подібними до штамів A/New Caledonia/20/1999 (H1N1) чи B/Malaysia/2506/2004.
5. Серед 22 додаткових випадків, 18 випадків не відповідали антигеному складу вакцинних штамів, та в 4 випадках були нетипованими; у 15 з 22 випадків були A (H3N2) (11 випадків у групі, яка отримала Флюарикс™, та 4 випадки у групі плацебо).
ПОКАЗАННЯ ДЛЯ ЗАСТОСУВАННЯ:вакцина Флюарикстм призначена для профілактики грипу у дорослих та дітей віком старше 6 місяців.
Щеплення осіб на території України здійснюється згідно з вимогами діючих наказів МОЗ України.
СПОСІБ ЗАСТОСУВАННЯ І ДОЗИ: дорослим та дітям віком старше за 3 роки: одна доза 0,5 мл.
Дітям від 6 до 36 місяців: одна доза по 0,25 мл або 0,5 мл*.
Дітям віком молодше 9 років, які раніше не були вакциновані, другу дозу вакцини необхідно вводити з інтервалом не менше 4 тижнів (тобто 0,25 мл або 0,5 мл*)
Флюарикстм слід призначати у передепідемічний період грипу або в залежності від епідемічної ситуації. Вакцинацію слід повторювати щороку дозою вакцини, що відповідає віку, із коригованим складом антигенів.
Флюарикстм можна вводити внутрішньом'язово (у ділянку дельтоподібного м'яза) або підшкірно. Хворим з тромбоцитопенією або кровотечами вакцину слід вводити підшкірно.
Флюарикстм ні за яких обставин не можна вводити внутрішньовенно.
*ФлюариксТМ слід застосовувати у відповідності до наявних офіційних рекомендацій.
Побічна діЯ:Під час проведення контрольованих клінічних досліджень Флюарикстмпризначався понад 22 000 пацієнтам віком від 18 до 60 років та понад 2000 пацієнтам віком від 6 місяців до < 18 років. Протягом 7 діб після застосування вакцини всіх пацієнтів опитували щодо симптомів та ознак після вакцинації, згідно з переліком побічних реакцій. Пацієнти, що отримали ін’єкцію вакцини, також повинні були повідомляти дослідникам про будь-які клінічні прояви протягом 30 діб після вакцинації.
Побічні реакції, про які повідомляли, перераховані з наступною частотою:
Дуже часто: ≥1/10
Часті: ≥1/100 до <1/10
Нечасті: ≥1/1000 до <1/100
Поодинокі: ≥1/10000 до <1/1000
Рідкісніі: <1/10000
Дуже часто: біль в місці ін’єкції, втрата апетиту1, дратівливість1, сонливість1, головний біль, втома, міалгія.
Часто: почервоніння2, припухлість2 та затвердіння в місці ін’єкції, підвищене потовиділення, тремтіння, артралгія.
Нечасто: запаморочення, лихоманка.3
1спостерігалися у пацієнтів віком від 6 місяців до 5 років.
2дуже часто у пацієнтів віком від 6 місяців до 18 років.
3часто у пацієнтів віком від 6 місяців до 18 років.
Постмаркетингове спостереження
Рідко: транзиторна лімфаденопатія, алергічні реакції (включаючи анафілактичні реакції), неврит, гострий розсіяний енцефаломієліт, синдром Гійєна-Барре*, блювання, кропив’янка, свербіж, еритема, висип, ангіоневротичний набряк, грипоподібні стани, загальне нездужання.
* Були отримані спонтанні повідомлення про синдром Гійєна-Барре після вакцинації Флюарикс™ однак не був установлений причинно-наслідковий зв'язок між вакцинацією та синдромом Гійєна-Барре.
Передозування
Не спостерігалось.
ПРОТИПОКАЗАННЯ: Флюарикстм не слід призначати пацієнтам з підвищеною чутливістю до активних речовин, до будь-яких допоміжних речовин, що входять до складу вакцини, до яєць, курячого білку, формальдегіду, гентаміцину сульфату та натрію дезоксихолату.
ОСОБЛИВОСТІ ЗАСТОСУВАННЯ: як і при застосуванні інших вакцин, у випадках вираженого фебрильного стану та гострого інфекційного захворювання вакцинацію слід відкласти. Наявність захворювання легкого ступеня з підвищенням або без підвищення температури не повинно бути протипоказанням для введення Флюарикстм.
Флюарикстм призначений лише для профілактики захворювання, причиною якого є віруси грипу. Ця вакцина не є профілактичним засобом від інфекційних захворювань, причиною яких є інші збудники, що викликають симптоми, подібні до симптомів грипу. Як і при використанні інших вакцин, що вводяться ін'єкційно, у разі виникнення поодиноких анафілактичних реакцій після введення вакцини необхідно забезпечити умови щодо негайного проведення відповідного лікування та спостереження.
Синкопе (непритомність) може виникнути під час або раніше будь-якої ін’єкційної вакцинації як психогенна реакція на ін’єкцію голкою. Вакцинацію необхідно проводити тільки в положенні вакцинованого сидячи або лежачи, та залишаючи його в тому ж положенні (сидячи або лежачи) протягом 15 хвилин після вакцинації для попередження ризику його травматизації.
Взаємодія з іншими лікарськими засобами та інші види взаємодій: на імунізацію може вплинути одночасне проведення імуносупресивної терапії або наявність у пацієнта імунодефіциту. Флюарикстм можна одночасно вводити разом з іншими вакцинами. Однак ін'єкції слід робити в різні місця.
Після вакцинації для профілактики грипу спостерігали псевдопозитивні результати серологічних тестів при використанні методу ELISA для визначення антитіл проти HIV1, гепатиту С та особливо HTLV1. Ці результати, спростовуються за допомогою Western Blot-методики. Псевдопозитивні транзиторні реакції можуть бути обумовлені IgМ-відповіддю на вакцину.
Несумісність
Флюарикстм не можна змішувати в одному шприці з іншими вакцинами.
Вагітність та лактація: безпека Флюарикстм при введенні вагітним жінкам не оцінювалася. Дослідження на тваринах не вказують на прямі чи непрямі несприятливі наслідки щодо репродуктивної функції та розвитку токсичності. Вакцину Флюарикстм під час вагітності слід використовувати лише за чіткими показаннями, та коли можлива користь для матері переважає потенційний ризик для плоду.
Безпека ФлюариксТМ при введенні жінкам, що годують груддю, не оцінювалась.
Вплив на керування автомобілем та роботу з механізмами: вплив вакцини на здатність керувати автомобілем та працювати з іншими механізмами є малоймовірним.
Інструкція стосовно використання вакцини:
Вакцину Флюарикстм перед використанням слід візуально перевірити на наявність чужорідних включень та/або зміни фізичних властивостей. Шприц з вакциною перед використанням необхідно ретельно струсити для отримання безбарвної, злегка опалесцюючої рідини. Якщо вміст не відповідає зазначеним характеристикам, вакцину слід знищити.
Будь-який невикористаний продукт або відходні матеріали мають бути знищені згідно з місцевими вимогами.
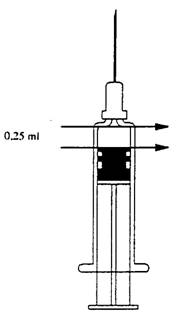
Введення дози 0,25 мл ФлюариксТМ
При призначенні вакцини в дозі 0,25 мл попередньо наповнений шприц необхідно розмістити у вертикальному положенні та видалити половину об’єму. Другу половину об’єму, що залишився (0,25 мл), необхідно ввести пацієнту.
Для шприців із позначкою "0,25 мл"
Перевести попередньо наповнений шприц у вертикальне положення та натиснути на поршень до досягнення ним позначки "0,25 мл". Після цього дозу вакцини, що залишилася у шприці (0,25 мл), необхідно ввести пацієнту.
Для шприців без позначки "0,25 мл"
Для шприців, що не мають позначки "0,25 мл", з метою визначення необхідної дози вакцини (0,25 мл) можна використати наведений в кінці інструкції малюнок. Співставити шприц з малюнком таким чином, щоб верхня грань шприця відповідала верхній стрілці. Натиснути на поршень до досягнення поршнем шприця нижньої стрілки. Після цього дозу вакцини, що залишилася у шприці (0,25 мл), необхідно ввести пацієнту.
УМОВИ ЗБЕРІГАННЯ:вакцину Флюарикстм слід зберігати при температурі від 2 до 8 оС (у холодильнику). Не заморожувати. Зберігати в оригінальній упаковці для захисту від світла. Зберігати в місцях, недоступних для дітей.
ТЕРМІН ПРИДАТНОСТІ:12 місяців. Дата закінчення терміну придатності вакцини зазначена на етикетці та на упаковці.
ПАКУВАННЯ: суспензія для ін’єкцій по 0,5 мл у попередньо наповненому шприці з фіксованою голкою №1, №10. Шприци виготовлені з нейтрального скла типу І, що відповідає вимогам Європейської Фармакопеї.
ВИРОБНИК:
ГлаксоСмітКляйн Біолоджикалс, підрозділ СмітКляйн Бічем Фарма ГмбХ і Ко.КГ, Ціркусштрассе 40, D-01069, Дрезден, Німеччина.
Glaxo SmithKline Biologicals NL der SmithKline Beecham Pharma GmbH & Co.KG, Zirkusstraße 40, 01069, Dresden, Germany.
Представництво в Україні:
ТОВ «ГлаксоСмітКляйн Фармасьютікалс Україна», 02152, м.Київ, пр. Павла Тичини, буд. 1-в,
тел. (044) 585-51-85, факс (044) 585-51-86.
У випадку підозри на побічну дію (ускладнення) після застосування МІБП необхідно направити термінове повідомлення до Управління лікарських засобів та медичної продукції МОЗ України (01021, м. Київ, вул. Грушевського, 7, тел. (044)2 00 - 07 -9 3 ); Д ержавного підприємства „Державний експертний центр Міністерства охорони здоров’я України” (03151, м. Київ, вул. Ушинського, 40, тел. (044)393-75-86 ) та до представництва компанії в Україні.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО

