АНТИТРОМБІН ІІІ БАКСТЕР
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.
 від 2 °С до 8 °С. Не заморожувати
від 2 °С до 8 °С. Не заморожувати 

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
АНТИТРОМБІН ІІІ БАКСТЕР
( ANTITHROMBIN III BAXTER)
Склад:
діюча речовина:антитромбін III;
1 флакон з порошком містить Антитромбіну III 500 МО або 1000 МО;
допоміжні речовини: глюкоза безводна, натрію хлорид, натрію цитрат, трометамін;
флакон з розчинником містить стерильну воду для ін’єкцій.
1 мл відновленого розчину для інфузій містить 50 МО/мл Антитромбіну ІІІ.
Лікарська форма Ліофілізат для розчину для інфузій.
Основні фізико-хімічні властивості: cипка тверда речовина або порошок від світло-жовтого до світло-зеленого кольору; пошкоджені кінцеві контейнери або ті, що містять сторонні включення, видаляють.
Фармакотерапевтична група
Антитромбічні засоби. Група гепарину. Антитромбін III.Код АТС B01AB02.
Фармакологічні властивості
Антитромбін належить до надсімейства серпінів (інгібітор серинових протеаз), являється глікопротеїном, що складається з 432 амінокислот, з молекулярною масою 58 кД. Це один з найважливіших природних інгібіторів згортання крові. Факторами, що найбільш сильно пригнічуються, є тромбін і фактор Xa, а також фактори активації контактного шляху (внутрішньої системи) згортання крові та комплекс «фактор VIIa/тканинний фактор». Активність антитромбіну значно посилюється гепарином, і дія антикоагулянту гепарину залежить від присутності антитромбіну.
Антитромбін містить два функціонально важливих центра. Перший містить реактивний центр та забезпечує розщеплення таких протеїназ, як тромбін, що є передумовою для формування стійкого комплексу «протеїназа–інгібітор протеїназ». Другий являє собою центр зв'язування з глікозаміногліканом і відповідає за взаємодію з гепарином та іншими речовинами, що мають відношення до прискорення інгібування тромбіну. Комплекси «інгібітор–ферменти коагуляції» видаляються ретикуло-ендотеліальною системою.
Активність антитромбіну у дорослих становить 80–120 %, у новонароджених його рівень становить приблизно 40–60 %.
Фармакокінетичні дослідження антитромбіну показали, що середній біологічний період напіввиведення становить близько 3 днів. Період напіввиведення може зменшуватися приблизно до 1,5 дня при одночасному введені гепарину. Період напіввиведення може зменшуватися до декількох годин в умовах надмірного виснаження.
Клінічні характеристики
Показання.
Застосування Антитромбіну III Бакстер показано пацієнтам, що мають вроджену чи набуту недостатність антитромбіну, з активністю антитромбіну в плазмі крові нижче 70 % від нормального рівня для профілактики та лікування тромботичних і тромбоемболічних порушень. Інфузії антитромбіну можуть бути особливо корисними у таких клінічних ситуаціях:
– хірургічні процедури або вагітність та пологи у пацієнтів з вродженим дефіцитом антитромбіну;
– неадекватна реакція або відсутність реакції на застосування гепарину;
–наявність або ризик виникнення тромбозу у хворих з нефротичним синдромом або із запальними захворюваннями кишечника;
– хірургічне втручання або кровотечі у хворих з тяжкою печінковою недостатністю, особливо якщо пацієнти отримують лікування концентратами факторів згортання крові.
Протипоказання.
Підвищена чутливість до будь-якого з компонентів препарату.
Гепариніндукована тромбоцитопенія в анамнезі.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Гепарин: проведення замісної терапії антитромбіном під час застосування гепарину в терапевтичних дозах збільшує ризик розвитку кровотеч. Ефект антитромбіну значно посилюється введенням гепарину. Період напіввиведення антитромбіну може значно знизитися у разі супутнього лікування гепарином через прискорений метаболізм антитромбіну. Таким чином, одночасне застосування гепарину і антитромбіну пацієнтам з підвищеним ризиком розвитку кровотечі необхідно контролювати клінічно і біологічно.
Особливості застосування.
Дефіцит антитромбіну може бути вродженим або може бути набутим в результаті різних клінічних розладів. Набутий дефіцит антитромбіну може спостерігатися або через підвищене виснаження чи втрату білка, або через дефектний синтез антитромбіну.
При внутрішньовенному застосуванні будь-якого білкового препарату, можливий розвиток реакцій гіперчутливості. Слід ретельно контролювати та уважно спостерігати за пацієнтами щодо розвитку будь-яких симптомів протягом інфузії. Необхідно проінформувати пацієнтів про ранні ознаки реакцій гіперчутливості, включаючи уртикарний висип, генералізовану кропив’янку, стиснення у грудній клітці, свистяче дихання, артеріальну гіпотензію, анафілаксію. Якщо ці симптоми з’являються після застосування препарату, пацієнти повинні зв’язатися зі своїм лікарем.
У разі розвитку шоку необхідно провести стандартне медичне лікування.
Стандартні заходи щодо запобігання розвитку інфекцій в результаті застосування лікарських препаратів, отриманих з людської крові або плазми крові, включають в себе відбір донорів, скринінгове дослідження окремих випадків донорства і пулів плазми крові на виявлення специфічних маркерів інфекції, а також включення ефективних виробничих етапів для інактивації/видалення вірусів. Незважаючи на це, у разі застосування лікарських засобів, виготовлених з людської крові або плазми крові, можливість передачі інфекційних агентів повністю виключати не можна. Це також стосується невідомих або нових вірусів та інших збудників.
Стандартні запобіжні заходи, вважаються ефективними як щодо оболонкових вірусів, таких як ВІЛ, ВГБ і ВГС (вірус імунодефіциту людини, вірус гепатиту Б, вірус гепатиту С відповідно), так і необолонкового ВГА (вірус гепатиту А). Вказані заходи, можуть мати обмежений вплив відносно необолонкових вірусів, таких як парвовірус В19. Інфекція, викликана парвовірусом В19, може бути серйозною для вагітних жінок (внутрішньоутробна інфекція) та для осіб з імунодефіцитом або зі збільшеним еритропоезом (наприклад, гемолітична анемія).
Питання про відповідну вакцинацію (проти гепатиту A та Б) слід розглянути щодо пацієнтів, які регулярно/неодноразово отримують лікування препаратами антитромбіну, що походять з плазми крові людини.
Настійно рекомендується кожного разу при введенні пацієнту Антитромбіну III Бакстер записувати дані пацієнта та номер серії препарату з метою підтримання взаємозв’язку між пацієнтом і серією препарату.
Клінічні та біологічні спостереження, які необхідно проводити, у разі застосування антитромбіну разом з гепарином:
- з метою коригування дози гепарину та уникнення надмірної гіпокоагуляції контроль за ступенем пригнічення згортання крові (активований частковий тромбопластиновий час (АЧТЧ) і у відповідних випадках активність анти-FXa) слід проводити регулярно, з короткими проміжками часу, зокрема в перші хвилини/години після початку застосування антитромбіну;
- щоденні вимірювання рівнів антитромбіну, щоб відкоригувати індивідуальну дозу, оскільки існує ризик зменшення рівнів антитромбіну у разі тривалого застосування нефракціонованого гепарину.
Цей лікарський засіб містить близько 3,77 мг натрію в 1 мл. Це слід враховувати пацієнтам, які дотримуються дієти з контрольованим вмістом натрію.
Застосування у період вагітності або годування груддю.
Досвід з безпеки застосування препаратів людського антитромбіну під час вагітності у людей обмежений. Безпека застосування Антитромбіну III Бакстер вагітним або жінкам, які годують груддю, не встановлена під час проведення контрольованих клінічних досліджень. Застосування антитромбіну, як повідомлялося, не було пов’язано з ембріофетальною токсичністю.
Вагітним або жінкам, які годують груддю, з наявним дефіцитом антитромбіну, препарат Антитромбін III Бакстер слід призначати тільки чітко за показаннями, беручи до уваги, що під час вагітності збільшується ризик розвитку тромбоемболічних ускладнень.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Вплив на здатність керувати транспортними засобами або працювати з механізмами не спостерігався.
Спосіб застосування та дози.
Лікування слід починати під керівництвом лікаря, який має досвід в лікуванні пацієнтів з дефіцитом антитромбіну.
Дозування
При вродженому дефіциті дози препарату слід підбирати індивідуально для кожного пацієнта з урахуванням сімейного анамнезу щодо розвитку тромбоемболічних ускладнень, фактичних клінічних факторів ризику і результатів лабораторних досліджень.
Доза і тривалість замісної терапії при набутому дефіциті залежить від рівня антитромбіну в плазмі крові, наявності ознак підвищеного метаболізму, основного захворювання та ступеня тяжкості клінічного стану. Доза і частота застосування завжди повинні ґрунтуватися на клінічній ефективності та лабораторній оцінці в кожному конкретному випадку.
Кількість одиниць застосовуваного антитромбіну виражається в міжнародних одиницях (МО), які зіставляються з поточним стандартом ВООЗ для антитромбіну. Активність антитромбіну в плазмі крові виражається або у відсотках (відносно нормальної плазми крові людини) або в міжнародних одиницях (відносно Міжнародного стандарту антитромбіну плазми крові).
Одна міжнародна одиниця (МО) активності антитромбіну еквівалентна кількості антитромбіну в 1 мл нормальної плазми крові людини. Розрахунок необхідної дози антитромбіну базується на емпіричних даних, а саме: 1 міжнародна одиниця (МО) антитромбіну на 1 кг маси тіла підвищує активність антитромбіну в плазмі крові приблизно на 2 %.
Початкова доза препарату визначається за допомогою такої формули:
Необхідна кількість одиниць = маса тіла (кг) × (цільовий рівень – фактична активність антитромбіну [%]) × 0,5
Первинна цільова активність антитромбіну залежить від клінічної ситуації. У разі встановлення показання для заміщення антитромбіну, слід застосовувати достатню дозу препарату для досягнення цільової активності антитромбіну та забезпечення ефективного рівня. Дозу препарату слід визначати і контролювати на основі лабораторних вимірювань активності антитромбіну, які потрібно робити принаймні два рази на добу, поки стан пацієнта не стабілізується, а після цього – один раз на добу, переважно безпосередньо перед наступною інфузією. При корекції дози препарату слід враховувати ознаки збільшення метаболізму антитромбіну відповідно до даних лабораторного контролю та клінічного перебігу. Активність антитромбіну повинна підтримуватися на рівні вище 80 % від нормального впродовж усього лікування окрім випадків, коли клінічні особливості можуть вказувати на інший ефективний рівень.
Звичайна початкова доза при вродженому дефіциті становить 30–50 МО/кг.
Після цього дозу препарату і частоту застосування, а також тривалість лікування слід скоригувати відповідно до біологічних даних та клінічної ситуації.
Педіатрична популяція
Даних щодо застосування Антитромбіну III Бакстердітям віком до 6 років недостатньо.
Метод введення
Препарат розчиняють відповідно до зазначеної нижче схеми. Препарат слід вводити внутрішньовенно. Максимальна швидкість введення становить 5 мл/хв.
Антитромбін III Бакстермає бути відновлений безпосередньо перед застосуванням.
Слід використовувати тільки надану інфузійну систему. Правил асептики слід дотримуватися протягом усього процесу відновлення. Відновлений розчин слід використати негайно (оскільки препарат не містить консервантів).
Перед застосуванням відновлений препарат необхідно перевірити візуально на наявність твердих частинок і знебарвлення. Розчин повинен бути прозорим або злегка опалесцентним. Не використовуйте мутні розчини або розчини, що містять осад.
Невикористаний препарат та відходи слід утилізувати відповідно до чинних вимог.
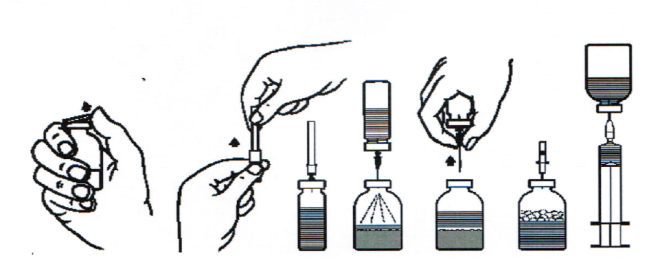
Відновлення сухої речовини:
1. Прогрійте закритий флакон, що містить розчинник (стерильну воду для ін'єкцій) до кімнатної температури (максимально до температури 37 оC).
2. Зніміть захисні ковпачки з флаконів з концентратом і розчинником (рис. A) та продезінфікуйте гумові пробки обох флаконів.
3. Зніміть захисний ковпачок з одного кінця голки-перехідника, що додається, прокрутивши і потягнувши ковпачок на себе (рис. Б). Вставте оголений кінець голки через гумову пробку на флаконі з розчинником (рис. В).
4. Зніміть захисний ковпачок з іншого кінця голки-перехідника, намагаючись не торкатися оголеного кінця голки.
5. Переверніть флакон з розчинником над флаконом з концентратом і вставте вільний кінець голки-перехідника через гумову пробку флакона з концентратом (рис. Г). Розчинник потрапить всередину флакона з концентратом за допомогою вакууму.
6. Роз’єднайте обидва флакона, витягнувши голку з флакона з концентратом (рис. Ґ). Для прискорення розчинення обережно збовтайте або перемішайте за допомогою обертальних рухів вміст флакона з концентратом.
7. Після повного розчинення концентрату вставте голку з повітропроводом, що додається, (рис.Д) і дочекайтеся зникнення піни. Видаліть голку з повітропроводом.
Застосування:
8. Зніміть захисний ковпачок з голки з фільтром, що додається, прокрутивши і потягнувши ковпачок на себе, і насадіть голку на стерильний одноразовий шприц. Втягніть розчин у шприц (рис. Е).
9. Від’єднайте голку з фільтром від шприца і повільно введіть розчин внутрішньовенно (максимальна швидкість інфузії: 5 мл/хв), використовуючи одноразову голку, що додається (або інфузійну систему, що додається).
Якщо розчин не фільтрується в процесі розчинення, то у такому разі використовується одноразова інфузійна система з адекватним фільтром (максимальна швидкість інфузії:
5 мл/хв).
|
Рис. A | Рис. Б | Рис. В | Рис. Г | Рис. Ґ | Рис. Д | Рис. Е |
Діти.
Даних щодо безпеки та ефективності застосування Антитромбіну III Бакстердітям віком до 6 років недостатньо, тому препарат не рекомендований для застосування в цій групі пацієнтів.
Дані клінічних випробувань і систематичних оглядів, що стосуються застосування Антитромбіну III для лікування недоношених дітей у випадках недоведеного показання респіраторного дистрес-синдрому новонароджених (РДСН) вказують на підвищений ризик внутрішньочерепної кровотечі і смертельних випадків при відсутності корисного ефекту.
Передозування.
Жодних симптомів передозування у разі застосування антитромбіну зареєстровано не було.
Побічні реакції.
У період постмаркетингового застосування препарату Антитромбін III Бакстербули зареєстровані такі побічні реакції, перераховані за класами системи органів (КСО) згідно Медичного словника нормативно-правової діяльності (MedDRA) із застосуванням термінів переважного використання у порядку тяжкості там, де це можливо.
Частоти були оцінені відповідно до наступного правила: дуже часті (> 1/10); часті (від > 1/100 до < 1/10); нечасті (від > 1/1000 до < 1/100); рідкі (від > 1/10000 до < 1/1000); дуже рідкі
(< 1/10000); частота невідома (неможливо визначити на основі наявних даних).
З боку нервової системи :частота невідома – тремор.
З боку серцево-судинної системи : частота невідома – гарячі припливи.
З боку імунної системи: частота невідома – гіперчутливість, анафілактичні реакції.
Опис деяких побічних реакцій.
Гіперчутливість або алергічні реакції (які можуть включати ангіоневротичний набряк, свербіж і печіння в місці інфузії, озноб, припливи, генералізовану кропив’янку, головний біль, уртикарний висип, артеріальну гіпотензію, сонливість, нудоту, неспокій, тахікардію, стиснення в грудній клітці, поколювання, блювання, свистяче дихання) спостерігаються нечасто, та в деяких випадках можуть переходити до тяжкої анафілаксії (включаючи шок).
У рідкісних випадках спостерігалася лихоманка.
В рідкісних випадках можливий розвиток тромбоцитопенії, опосередкованої появою гепарин-індукованих антитіл (тип ІІ). Може спостерігатися кількість тромбоцитів на рівні менше 100000/мкл або зменшення кількості тромбоцитів на 50 %.
Термін придатності
3 роки.
Відновлений розчин зберігати при кімнатній температурі не більше 6 годин.
Умови зберігання
Зберігати в оригінальній упаковці в недоступному для дітей місці при температурі від 2 до 8ºС. Не заморожувати.
Несумісність.
Антитромбін III Бакстер не слід змішувати з іншими лікарськими засобами.
Упаковка.
По 1 флакону з порошком (по 500 МО або по 1000 МО) у комплекті з 1 флаконом розчинника (вода для ін’єкцій по 10 мл або 20 мл) в картонній коробці. Упаковка також містить голку-перехідник, голку з фільтром, голку з повітропроводом, одноразову голку, інфузійну систему.
Категорія відпуску.За рецептом.
Виробник.
Бакстер АГ
Місцезнаходження виробника та його адреса місця провадження діяльності.
Ланге Аллее 24, А-1221 Відень, Австрія.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО