КОПАКСОН 40
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.


ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
Копаксон 40
( Copaxone® 40)
Склад:
діюча речовина:глатирамеру ацетат;
1 мл розчину для ін'єкцій містить глатирамеру ацетату 40 мг;
допоміжні речовини:маніт (Е 421), вода для ін'єкцій.
*Глатирамеру ацетат - це оцтовокисла сіль синтетичних поліпептидів, яка містить чотири амінокислоти природного походження: L-глутамінову кислоту, L-аланін, L-тирозин та
L-лізин, молярна частка яких складає 0,129-0,153, 0,392-0,462, 0,086-0,100 та 0,300-0,374 відповідно. Середня молекулярна маса глатирамеру ацетату становить 5000-9000 Да.
40 мг глатирамеру ацетату еквівалентно 36 мг основи глатирамеру.
Лікарська формаРозчин для ін'єкцій.
Основні фізико-хімічні властивості: розчин практично не містить видимих частинок.
Фармакотерапевтична група
Антинеопластичні та імуномодулюючі засоби, інші імуностимулятори. Код АТС L03A X13.Фармакологічні властивості
Механізми, за якими глатирамеру ацетат здійснює свій вплив на пацієнтів з розсіяним склерозом (РС), не з'ясовані повністю. Однак вважається, що це відбувається шляхом модифікування імунного процесу, який, як гадають сьогодні, є відповідальним за патогенез РС. Така гіпотеза підтримується даними досліджень, проведених з метою вивчення патогенезу експериментального алергічного енцефаломієліту (ЕАЕ) - стану, який був викликаний у кількох видів тварин шляхом імунізації на тлі одержаного матеріалу з центральної нервової системи, що містить мієлін, і який часто застосовується як експериментальна тваринна модель РС. Дослідження на тваринах і за участю пацієнтів з РС свідчать про те, що при застосуванні глатирамеру ацетату на периферії індукуються та стають активними глатирамеру ацетат-специфічні супресорні Т-клітини.
Ремітуючо-рецидивуючий РС
Дані про ефективність Копаксону 40, що вводився у вигляді підшкірних ін'єкцій в дозі 40 мг/мл 3 рази на тиждень з метою зниження частоти рецидивів, отримані в ході 12-місячного плацебо-контрольованого дослідження. Загальну кількість підтверджених рецидивів було обрано як первинний критерій ефективності. Вторинні показники МРТ, які вимірювалися на 6-му та 12-му місяці, включали сукупну кількість вогнищ та накопичення контрасту на Т2-зважених зображеннях і сукупну кількість вогнищ та накопичення контрасту на Т1-зважених зображеннях.
1404 пацієнтів рандомізували у співвідношенні 2:1 для прийому Копаксону 40 (40 мг/мл) (n=943) та плацебо (n=461). Обидві групи лікування порівнювалися за станом хворих на початку дослідження, клінічною картиною захворювання та показниками МРТ. Пацієнти мали в середньому 2,0 рецидиви за 2 роки до періоду відбору.
При застосуванні Копаксону 40 (40 мг/мл) спостерігалось зменшення загальної кількості рецидивів на 34,4% (p<0,0001) з відносним ризиком 0,656 та 95% довірчим інтервалом (ДІ) [0,539‑0,799].
При застосуванні Копаксону 40 (40 мг/мл) спостерігалися значні та статистично значимі зміни у первинних та вторинних показниках ефективності, що були зіставні з ефективністю лікування препаратом Копаксон®-Тева (20 мг/мл) 1 раз на добу.
В таблиці нижче наведено значення первинних та вторинних показників ефективності в групі пацієнтів, які пройшли рандомізацію.
Показники результатів | Скориговані середні значення | Показник P | |
Копаксон 40 (40 мг/мл) (N=943) | Плацебо (N=461) | ||
Кількість підтверджених рецидивів протягом 12-місячної плацебо-контрольованої фази дослідження | 0,331 | 0,505 | <0,0001 |
Абсолютне зниження ризику* | -0,174 [від -0,2841 до -0,0639] | ||
Сукупна кількість нових вогнищ та накопичення контрасту на Т2-зважених зображеннях на 6-му та 12-му місяці дослідження | 3,650 | 5,592 | <0,0001 |
Відносний ризик** (95% довірчий інтервал) | 0,653 [від 0,546 до 0,780] | ||
Сукупна кількість вогнищ та накопичення контрасту на Т1-зважених зображеннях на 6-му та 12-му місяці дослідження | 0,905 | 1,639 | <0,0001 |
Відносний ризик** (95% довірчий інтервал) | 0,552 [від 0,436 до 0,699] | ||
* Абсолютне зниження ризику визначалося як різниця між скоригованою кількістю підтверджених рецидивів протягом 12 місяців при застосуванні глатирамеру ацетату в дозі40 мг 3 рази на тиждень та скоригованою кількістю підтверджених рецидивів протягом 12 місяців при застосуванні плацебо.
** Відносний ризик визначався як співвідношення між скоригованим середнім ризиком при застосуванні глатирамеру ацетату в дозі 40 мг 3 рази на тиждень та скоригованим середнім ризиком при застосуванні плацебо.
Пряме порівняння безпеки при застосуванні Копаксону®-Тева (20 мг/мл) 1 раз на добу та Копаксону 40 (40 мг/мл) 3 рази на тиждень в одному дослідженні не проводилось.
У даному 12-місячному дослідженні не отримано свідчень, що терапія Копаксоном 40 впливає на прогресування інвалідизуючих змін або на тривалість рецидиву.
Наразі немає даних щодо застосування Копаксону 40 пацієнтам з первинним або вторинним прогресуванням захворювання.
Фармакокінетичні дослідження за участю пацієнтів не здійснювалися. Даніin vitro та обмежені дані досліджень, проведених за участю здорових добровольців, вказують на те, що при підшкірному застосуванні глатирамеру ацетату активна речовина легко абсорбується, а велика частина дози швидко розпадається на менші фрагменти вже у підшкірній тканині.
Клінічні характеристики
Показання.
Копаксон 40 показаний для лікування рецидивуючих форм розсіяного склерозу.
Копаксон 40 не призначають при первинно- або вторинно-прогресуючому розсіяному склерозі.
Протипоказання.
Гіперчутливість до активної речовини (глатирамеру ацетату) або до будь-якої допоміжної речовини.
Особливі заходи безпеки.
Препарат в попередньо наповненому шприці призначений лише для одноразового застосування. Невикористаний лікарський засіб або його залишки необхідно знищити.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Взаємодія між Копаксоном 40 та іншими лікарськими засобами вивчена недостатньо.
Відсутні дані щодо взаємодії з бета-інтерфероном.
Спостерігалось збільшення частоти реакцій у місці ін'єкції у пацієнтів, які отримують Копаксон40 і супутню терапію кортикостероїдами.
Дослідженняin vitro свідчать про те, що глатирамеру ацетат у крові міцно зв'язується з білками плазми крові, але не заміщується і не заміщує фенітоїн або карбамазепін. Однак, оскільки теоретично Копаксон 40 має здатність впливати на розподіл речовин, які зв'язуються з білками, необхідно ретельно спостерігати за супутнім застосуванням таких лікарських засобів.
Особливості застосування.
Копаксон 40 можна застосовувати тільки у вигляді підшкірних ін'єкцій. Препарат не можна застосовувати внутрішньовенно або внутрішньом'язово.
Лікар, який здійснює лікування, повинен роз'яснити пацієнту, що реакція, яка асоціюється хоча б з одним із таких симптомів, як вазодилатація (приплив крові), біль у грудях, диспное, пальпітація або тахікардія, може з'явитися через кілька хвилин після ін'єкції Копаксону 40 (див. розділ «Побічні реакції»). Більшість із цих симптомів триває протягом короткого проміжку часу і зникає спонтанно без будь-яких наслідків. У разі появи серйозної побічної реакції пацієнт повинен негайно припинити застосування Копаксону 40 і звернутися до лікаря. У разі необхідності лікар може призначити симптоматичне лікування.
Немає жодних доказів підвищеного ризику виникнення цих побічних реакцій для будь-якої групи пацієнтів. Незважаючи на це, потрібно з обережністю застосовувати Копаксон 40 пацієнтам із серцевими розладами в анамнезі. Слід регулярно перевіряти стан таких пацієнтів упродовж лікування.
У рідкісних випадках повідомлялось про судоми і/або анафілактоїдні або алергічні реакції. Рідко можуть виникати серйозні реакції гіперчутливості (наприклад бронхоспазм, анафілаксія або кропив'янка). Якщо ці реакції є тяжкими, необхідно розпочати відповідне лікування та припинити застосування препарату.
Глатирамеру ацетат-реактивні антитіла були виявлені у сироватці крові пацієнтів протягом щоденної постійної терапії препаратом Копаксон. Максимальні рівні досягалися у середньому через 3-4 місяці лікування, після чого вони знижувалися та стабілізувалися на рівні, що незначно вищий від початкового рівня.
Не існує жодних даних, які б свідчили про те, що ці глатирамеру ацетат-реактивні антитіла є нейтралізуючими або що їх утворення впливає на клінічну ефективність препарату Копаксон40.
У пацієнтів із нирковою недостатністю необхідно перевіряти функцію нирок протягом лікування препаратом Копаксон 40. Хоча не існує жодних свідчень гломерулярного депонування імунних комплексів, таку можливість не можна виключати.
В період постреєстраційного застосування Копаксону повідомляли про рідкісні випадки тяжкого ураження печінки (зокрема про гепатит із жовтяницею, печінковою недостатністю та в окремих випадках трансплантацією печінки) (див. розділ «Побічні реакції»). Ураження печінки відбувалось в період від кількох днів до кількох років після початку застосування Копаксону. Супутні стани, про які повідомляли у цих випадках, включали надмірне вживання алкоголю, наявне або в анамнезі ураження печінки та застосування інших потенційно гепатотоксичних лікарських засобів. У разі клінічно значущого ураження печінки слід розглянути питання про припинення застосування Копаксону.
Застосування у період вагітності або годування груддю.
Вагітність.Дослідження на тваринах не продемонстрували репродуктивної токсичності. Сучасні дані щодо застосування Копаксону®-Тева (20 мг/мл) вагітним жінкам вказують на відсутність фето/неонатальної токсичності чи порушень розвитку плода. Дані щодо застосування Копаксону40(40 мг/мл) вагітним жінкам зіставні з такими для Копаксону®‑Тева (20мг/мл). Доступних епідеміологічних даних з цього питання дотепер немає. Як запобіжний захід бажано уникати використання препарату в період вагітності, за винятком випадків, коли користь від застосування для вагітної переважає ризик можливого впливу на плід.
Годування груддю.Немає даних щодо проникнення глатирамеру ацетату або його метаболітів у грудне молоко. При введенні препарату щурам не спостерігалось суттєвого впливу на потомство, за винятком незначного зниження темпу збільшення маси тіла у тварин, народжених самицями, яким лікарський засіб вводили в період вагітності та лактації. Ризик для новонароджених/немовлят не можна виключити. Необхідно прийняти рішення щодо припинення годування груддю або відміни/тимчасового припинення терапії із застосуванням Копаксону40 зурахуванням користі годування груддю для дитини та користі терапії для жінки.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами не досліджувалась.
Спосіб застосування та дози.
Початок терапії препаратом Копаксон 40 повинен відбуватися під наглядом невролога або лікаря, який має досвід лікування розсіяного склерозу.
Для дорослих рекомендована доза становить 40 мг глатирамеру ацетату (один попередньо наповнений шприц), що вводиться у вигляді підшкірної ін'єкції 3 рази на тиждень. Перерва між ін'єкціями повинна становити мінімум 48 годин. Рекомендується застосовувати препарат у одні й ті ж самі дні кожного тижня.
Наразі тривалість лікування Копаксоном 40 не встановлена.
Рішення щодо тривалості лікування приймає лікар індивідуально для кожного випадку.
Пацієнти літнього віку. Застосування Копаксону 40 пацієнтам літнього віку спеціально не досліджувалося.
Пацієнти з порушенням функції нирок. Спеціальних досліджень щодо застосування Копаксону40 пацієнтам з порушенням функції нирок не проводилося (див. розділ «Особливості застосування»).
Пацієнтам слід надати інструкції стосовно техніки самостійного введення препарату та забезпечити нагляд лікаря під час першого самостійного введення та впродовж 30 хвилин поспіль.
З метою зменшення вірогідності виникнення подразнення або болю в місці ін'єкції кожне наступне введення препарату слід здійснювати в інше місце. Препарат можна вводити в живіт, руки, стегна та сідниці.
Загальні рекомендації щодо застосування
При здійсненні ін'єкції препарату Копаксон 40 важливо дотримуватись нижчевказаних правил:
· вводити препарат тільки підшкірно;
· застосовувати у дозі, яку призначив лікар;
· використовувати шприц для здійснення ін'єкції тільки один раз, невикористаний препарат або залишки − знищити;
· не змішувати та не вводити Копаксон 40 одночасно з іншими препаратами;
· при наявності у розчині зважених частинок не використовувати цей попередньо наповнений шприц, слід взяти іншу упаковку.
Інструкції щодо застосування
1. Перед введенням препарату слід переконатися у наявності всього необхідного для ін'єкції:
- один блістер препарату Копаксон 40, який містить попередньо наповнений шприц;
- утилізаційний контейнер для використаних шприців і голок.
2. Взяти один блістер із попередньо наповненим шприцом із загальної упаковки. Всі невикористані шприци необхідно зберігати в оригінальній упаковці.
3. Якщо препарат зберігався у холодильнику, потрібно витримати блістер із попередньо наповненим шприцом при кімнатній температурі протягом не менше 20 хвилин та переконатися, що він нагрівся до кімнатної температури.
4. Перед введенням препарату необхідно ретельно вимити руки водою з милом.
5. Вибрати ділянку для ін'єкції. На рис. 1 вказано сім можливих точок на тілі для ін'єкцій: руки, стегна, сідниці, живіт (припупкова ділянка). Усередині кожної ін'єкційної ділянки є багато точок для уколу. Слід щоразу використовувати іншу точку для уколу для зменшення вірогідності виникнення подразнення або болю в місці ін'єкції.
Необхідно постійно змінювати точки ін'єкцій усередині конкретної ділянки.
Не слід здійснювати ін'єкцію в одне і те саме місце.
Не слід використовувати для ін'єкції болючі точки, знебарвлені ділянки шкіри або ділянки з ущільненнями і вузликами.
Рекомендовано розписати порядок зміни місць для здійснення ін'єкцій та вносити відповідні помітки у щоденник ін'єкцій. Деякі ділянки тіла є незручними для здійснення ін'єкції самостійно (наприклад руки). В таких випадках може бути потрібна стороння допомога.
Ділянка 1 Припупкова ділянка Робити ін'єкції, відступивши не менше ніж 5 см від пупка |
Ділянка 4 Ліва рука М'язова частина верхньої задньої ділянки |
Ділянка 5 Права рука М'язова частина верхньої задньої ділянки |
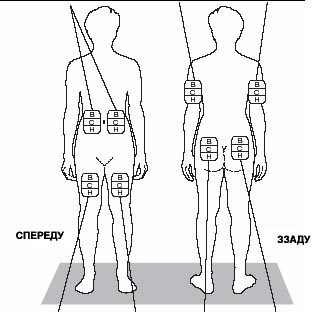
Ділянка 7 Права сідниця М'язова частина над стегном, завжди нижче талії |
Ділянка 3 Ліве стегно Приблизно 5 см вище коліна та 5 см нижче паху |
Ділянка 2 Праве стегно Приблизно 5 см вище коліна та 5 см нижче паху |
Ділянка 6 Ліва сідниця М'язова частина над стегном, завжди нижче талії |
В - верх; С - середина; Н - низ.
Рис. 1
6. Дістати шприц із захисної блістерної упаковки, видаливши паперове маркування.
7. Шприц взяти у руку, якою пишуть, та тримати так, як олівець. Зняти захисний ковпачок з голки.
8. Злегка зібрати шкіру у складку великим і вказівним пальцями (рис. 2).
9. Ввести голку у шкіру (рис. 3). Препарат вводять, рівномірно натискаючи на поршень шприца вниз до його повного спорожнення.
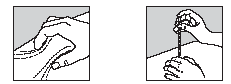
Рис. 2 Рис. 3
10. Видалити шприц з голкою рухом вертикально вгору.
11. Використаний шприц покласти в утилізаційний контейнер.
Діти.
Безпеку та ефективність застосування глатирамеру ацетату дітям і підліткам не встановлено. Відсутня достатня інформація щодо застосування Копаксону 40 дітям (віком до 18 років) для того, щоб надати будь-які рекомендації щодо його застосування. Тому не слід застосовувати Копаксон 40 цій віковій категорії.
Передозування.
Повідомлялося про кілька випадків передозування Копаксоном (при застосуванні до 300 мг глатирамеру ацетату). Ці випадки не супроводжувалися виникненням інших реакцій, ніж ті, що наведені у розділі «Побічні реакції».
У разі передозування необхідно спостерігати за станом пацієнта та призначити відповідну симптоматичну та підтримуючу терапію.
Побічні реакції.
Більша частина даних про безпеку застосування глатирамеру ацетату заснована на досвіді підшкірного введення препарату Копаксон®-Тева (20 мг/мл) 1 раз на добу. Нижче наведено дані щодо безпеки глатирамеру ацетату, отримані в результаті 4-х плацебо-контрольованих досліджень застосування Копаксону®-Тева (20 мг/мл) 1 раз на добу та 1-го плацебо-контрольованого дослідження застосування Копаксону 40 (40 мг/мл) 3 рази на тиждень.
Пряме порівняння безпеки при застосуванні Копаксону®-Тева (20 мг/мл) 1 раз на добу та Копаксону 40 (40 мг/мл) 3 рази на тиждень в одному дослідженні не проводилось.
Копаксон®-Тева(20 мг/мл) 1 раз на добу
В усіх клінічних дослідженнях при застосуванні Копаксону®-Тева (20 мг/мл) найчастішими побічними реакціями були реакції у місці ін'єкції, що спостерігались у більшості пацієнтів, які застосовували препарат. В контрольованих дослідженнях частка пацієнтів, у яких спостерігались ці реакції хоча б раз, була більшою після лікування препаратом Копаксон®-Тева (20 мг/мл) (70%), ніж після ін'єкцій плацебо (37%). Реакції в місці ін'єкції, що найчастіше спостерігались при застосуванні препарату Копаксон®-Тева (20 мг/мл) порівняно з плацебо, включали еритему, біль, новоутворення, свербіж, набряк, запалення та гіперчутливість.
Реакція, пов'язана щонайменше з одним із таких симптомів, як вазодилатація (приплив крові), біль у грудях, диспное, пальпітація або тахікардія, описана як негайна реакція після ін'єкції. Ця реакція може виникати протягом кількох хвилин після ін'єкції Копаксону. Щонайменше один з симптомів негайної реакції після ін'єкції (окремі симптоми негайної реакції після ін'єкції із зазначенням частоти вказані нижче) спостерігався у 31% пацієнтів, які застосовували препарат Копаксон®-Тева (20 мг/мл), порівняно з 13% пацієнтів, які отримували плацебо.
Всі побічні реакції, що частіше спостерігалися у пацієнтів, які застосовували препарат Копаксон®-Тева (20 мг/мл), порівняно з пацієнтами, які отримували плацебо, наведені нижче.
Ці дані отримані в 4-х базових, подвійно сліпих, плацебо-контрольованих клінічних дослідженнях за участю загалом 512 пацієнтів, які застосовували препарат Копаксон®-Тева (20мг/добу), та 509 пацієнтів, які застосовували плацебо протягом 36 місяців. У три дослідження ремітуючо-рецидивуючого РС загалом було включено 269 пацієнтів, які застосовували препарат Копаксон®-Тева (20 мг/добу), та 271 пацієнт групи застосування плацебо протягом 35 місяців. У четвертому клінічному дослідженні брали участь пацієнти з першим клінічним епізодом, які були визначені як група високого ризику щодо розвитку клінічно підтвердженого РС. У цьому дослідженні 243 пацієнти застосовували препарат Копаксон®-Тева (20 мг/добу) та 238 пацієнтів застосовували плацебо протягом 36 місяців.
Побічні реакції, перелічені нижче, класифіковано за класами систем органів та частотою: дуже часто (≥1/10), часто (≥1/100 - <1/10), нечасто (≥1/1000 - <1/100).
Інфекції та інвазії
Дуже часто: інфекції, грип.
Часто: бронхіт, гастроентерит, простий герпес, середній отит, риніт, зубний абсцес, вагінальний кандидоз*.
Нечасто: абсцес, целюліт, фурункул, оперізувальний герпес, пієлонефрит.
Доброякісні, злоякісні та неуточнені новоутворення (в тому числі кісти й поліпи)
Часто: доброякісні пухлини шкіри, новоутворення.
Нечасто: рак шкіри.
З боку системи крові та лімфатичної системи
Часто: лімфаденопатія*.
Нечасто: лейкоцитоз, лейкопенія, збільшення селезінки, тромбоцитопенія, аномальна морфологія лімфоцитів.
З боку імунної системи
Часто: гіперчутливість.
З боку ендокринної системи
Нечасто: зоб, гіпертиреоз.
З боку метаболізму та харчування
Часто: анорексія, збільшення маси тіла*.
Нечасто: непереносимість алкоголю, подагра, гіперліпідемія, підвищення рівня натрію в крові, зниження феритину плазми крові.
З боку психіки
Дуже часто: тривога*, депресія.
Часто: нервозність.
Нечасто: аномальні сновидіння, сплутаність свідомості, ейфорія, галюцинації, ворожість, манія, розлад особистості, спроба самогубства.
З боку нервової системи
Дуже часто: головний біль.
Часто: дисгевзія, гіпертонус, мігрень, порушення мовлення, синкопе, тремор*.
Нечасто: зап'ястний тунельний синдром, когнітивний розлад, судоми, дисграфія, дислексія, дистонія, моторна дисфункція, міоклонус, неврит, нейром'язова блокада, ністагм, параліч, параліч перонеального нерва, ступор, дефект поля зору.
З боку органів зору
Часто: двоїння в очах, розлади з боку органів зору*.
Нечасто: катаракта, ураження рогівки, сухість очей, очний крововилив, опущення верхньої повіки, мідріаз, атрофія зорового нерва.
З боку органів слуху та рівноваги
Часто: розлади з боку органів слуху.
З боку серцево-судинної системи
Дуже часто: вазодилатація*.
Часто: пальпітація*, тахікардія*.
Нечасто: екстрасистолія, синусова брадикардія, пароксизмальна тахікардія, варикозне розширення вен.
З боку дихальної системи, органів грудної клітки та середостіння
Дуже часто: задишка*.
Часто: кашель, сезонний риніт.
Нечасто: апное, носова кровотеча, гіпервентиляція, ларингоспазм, захворювання легенів, відчуття задухи.
З боку шлунково-кишкового тракту
Дуже часто: нудота*.
Часто: аноректальні розлади, запор, зубний карієс, диспепсія, дисфагія, нетримання калу, блювання*.
Нечасто: коліт, кишковий поліп, ентероколіт, відрижка, виразка стравоходу, періодонтит, ректальна кровотеча, збільшення слинних залоз.
З боку гепатобіліарної системи
Часто: порушення функціональних печінкових проб.
Нечасто: холелітіаз, збільшення печінки, ураження печінки, токсичний гепатит.
З боку шкіри та підшкірної клітковини
Дуже часто: висипання*.
Часто: екхімози, гіпергідроз, свербіж, розлади з боку шкіри*, кропив'янка.
Нечасто: ангіоневротичний набряк, контактний дерматит, вузликова еритема, шкірні вузлики.
З боку кістково-м’язової системи та сполучної тканини
Дуже часто: артралгія, біль у спині*.
Часто: біль у ділянці шиї.
Нечасто: артрит, бурсит, біль у боці, м'язова атрофія, остеоартрит.
З боку нирок та сечовидільної системи
Часто: імперативний потяг до сечовипускання, полакіурія, затримка сечі.
Нечасто: гематурія, нефролітіаз, розлади сечового тракту, порушення показників загального аналізу сечі.
Вагітність, післяпологовий період і перинатальний стан
Нечасто: аборт.
З боку репродуктивної системи та молочних залоз
Нечасто: нагрубання молочних залоз, еректильна дисфункція, опущення тазових органів, пріапізм, розлади з боку простати, аномальний мазок із шийки матки, тестикулярні розлади, вагінальна кровотеча, вульвовагінальні розлади.
Загальні розлади і реакції у місці введення
Дуже часто: астенія, біль у грудях*, реакції у місці ін'єкції*^, біль*.
Часто: озноб*, набряк обличчя*, атрофія у місці ін'єкції◊, місцева реакція*, периферичний набряк, набряк, гіпертермія.
Нечасто: кіста, похмільний синдром, гіпотермія, негайна реакція після ін'єкції, запалення, некроз у місці ін'єкції, розлади з боку слизової оболонки.
Травми, отруєння та ускладнення
Нечасто: поствакцинальний синдром.
*Кількість випадків була більше ніж 2% (>2/100) у групі застосування Копаксону 40 порівняно з групою плацебо. Побічні реакції без символу * означають різницю у менше ніж 2% або еквівалентну 2%.
^Термін «реакції у місці ін'єкції» (різні типи) охоплює всі побічні реакції, що виникають у місці ін'єкції, за винятком атрофії у місці ін'єкції та некрозу у місці ін'єкції, що вказані окремо.
◊Включає терміни, що стосуються локалізованої ліпоатрофії у місці ін'єкції.
У 4-му дослідженні, зазначеному вище, після плацебо-контрольованого періоду проводилась відкрита фаза лікування. Змін відомого профілю безпеки Копаксону®-Тева (20 мг/мл) під час подальшого відкритого 5-річного дослідження не спостерігалось.
Копаксон 40(40 мг/мл), що вводиться 3 рази на тиждень
Безпеку застосування препарату Копаксон 40 (40 мг/мл) оцінювали в ході подвійно сліпого плацебо-контрольованого дослідження за участю хворих з ремітуючо-рецидивуючим розсіяним склерозом. Протягом дослідження 943 пацієнти отримували Копаксон 40 (40 мг/мл) три рази на тиждень, а 461 пацієнт отримував плацебо протягом 12 місяців.
Загалом у пацієнтів, які отримували лікування Копаксоном 40 (40 мг/мл) (3 рази на тиждень), спостерігались такі ж побічні реакції і з аналогічною частотою, що й при застосуванні препарату Копаксон®‑Тева (20 мг/мл) (щоденно).
Зокрема, побічні реакції у місці ін'єкції та негайні реакції після ін'єкції у пацієнтів, що застосовували Копаксон 40 (40 мг/мл) (3 рази на тиждень), виникали з меншою частотою, ніж у пацієнтів, які отримували лікування препаратом Копаксон®-Тева (20 мг/мл) (щоденно) (35,5% проти 70% для реакцій у місці ін'єкції та 7,8% проти 31% для негайних реакцій після ін'єкції відповідно).
Реакції у місці ін'єкції спостерігались у 36% пацієнтів, які отримували лікування препаратом Копаксон 40 (40 мг/мл), порівняно з 5% пацієнтів, які приймали плацебо. Негайна реакція після ін'єкції спостерігалась у 8% хворих, які отримували лікування препаратом Копаксон40 (40мг/мл), порівняно із 2% хворих, які застосовували плацебо.
Зафіксовано кілька специфічних побічних реакцій:
· Анафілактична реакція у пацієнтів з РС, які отримували лікування препаратом Копаксон®‑Тева (20 мг/мл), спостерігалась у рідкісних випадках (>1/10000, <1/1000) в ході неконтрольованих клінічних досліджень та постреєстраційного застосування. Про випадки анафілактичної реакції повідомлялось у 0,3% пацієнтів, які застосовували Копаксон40 (40мг/мл) (нечасто: ≥1/1000 - <1/100).
· Відсутні повідомлення про некроз у місці ін'єкції.
· Еритема шкіри та біль у кінцівках, які не відзначались при застосуванні препарату Копаксон®-Тева (20 мг/мл), спостерігались у 2,1% пацієнтів, які приймали Копаксон40 (40мг/мл) (часто: ≥1/100 - <1/10).
· Медикаментозне ураження печінки та токсичний гепатит спостерігались при застосуванні Копаксону40 (40 мг/мл), кожна з побічних реакцій у одного пацієнта (0,1%) (нечасто: ≥1/1000- <1/100).
В неконтрольованих клінічних дослідженнях і протягом постреєстраційного застосування також повідомляли про реакції гіперчутливості (зокрема про рідкісні випадки анафілактоїдних реакцій (≥1/10000 - <1/1000)) та підвищення рівня печінкових ферментів без клінічно значущих наслідків у пацієнтів з РС, які отримували лікування із застосуванням Копаксону.
В період постреєстраційного застосування Копаксону повідомляли про рідкісні випадки тяжкого ураження печінки (зокрема про гепатит із жовтяницею, печінковою недостатністю та в окремих випадках трансплантацією печінки). У більшості випадків тяжке ураження печінки зникало з припиненням лікування. Небажані явища з боку печінки траплялись в період від кількох днів до кількох років після початку застосування Копаксону. У разі клінічно значущого ураження печінки слід розглянути питання про припинення застосування Копаксону.
Термін придатності.2 роки.
Умови зберігання.
Зберігати в оригінальній упаковці для захисту від світла при температурі 2-8 °С (в холодильнику). Не заморожувати. Зберігати у недоступному для дітей місці.
Якщо немає можливості зберігати попередньо наповнені шприци у холодильнику, то їх можна зберігати при температурі 15-25 °C не довше 1 місяця.
Якщо по закінченні цього одномісячного періоду попередньо наповнені шприци з розчином Копаксон 40 не були використані і знаходяться в оригінальній упаковці, то їх необхідно зберігати в холодильнику при температурі 2-8 °C.
Несумісність.
Препарат не слід змішувати з іншими лікарськими препаратами, оскільки дослідження на сумісність не проводилися.
Упаковка.По 1 мл розчину в попередньо наповненому шприці; по 1 шприцу в блістері (з маркуванням або без маркування); по 12 шприців в картонній коробці.
Категорія відпуску.За рецептом.
Виробники.
Тева Фармацевтікал Індастріз Лтд.
Нортон Хелскеа Лімітед Т/А АЙВЕКС Фармасьютикалз ЮК.
Місцезнаходження виробників та адреси місця провадження їх діяльності.
вул. Елі Хурвіц 18, Інд. зона, Кфар-Саба, Ізраїль.
Астон Лейн Норс, Вайтхауз Вейл Індастріел Естейт, Ранкорн, WA7 3FA, Велика Британія.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО

