ЕПІРУБІЦИН МЕДАК
Зверніть увагу, якщо препарат було зареєстровано і виготовлено до дати закінчення реєстрації, він може продаватись.
дозволено до застосування в Україні, можуть застосовуватися в Україні до закінчення їх
терміну придатності, визначеного виробником та зазначеного на упаковці»
ст. 9 Закону України «Про лікарські засоби»
При зміні препарату обов’язково проконсультуйтесь з лікарем.
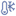 від 2 °С до 8 °С
від 2 °С до 8 °С
ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ЕПІРУБІЦИН МЕДАК
(EPIRUBICIN MEDAC)
Склад:
діюча речовина:епірубіцину гідрохлорид;
1 мл розчину для ін’єкцій містить 2 мг епірубіцину гідрохлориду;
допоміжні речовини:натрію хлорид, кислота хлористоводнева концентрована, вода для ін’єкцій.
Лікарська формаРозчин для ін’єкцій.
Основні фізико-хімічні властивості:прозорий розчин червоного кольору, вільний від видимих механічних включень.
Фармакотерапевтична група.
Антинеопластичні засоби. Код АТС L01D B03.
Фармакологічні властивості
Механізм дії.Епірубіцин являє собою антибіотик групи антрациклінів з цитотоксичною активністю. Механізм дії епірубіцину пов’язаний з його здатністю зв’язуватися з ДНК. Дослідження культури клітин показали швидке проникнення у клітину, локалізацію в ядрі, інгібування синтезу нуклеїнової кислоти і мітозу. Доведено, що епірубіцин є активним щодо широкого спектра експериментальних пухлин, включаючи лейкемію L1210 і P388, саркоми SA 80 (тверді та асцитні форми), меланому B16, рак молочної залози, рак легенів Льюїса і рак ободової кишки 38. Також продемонстрована активність епірубіцину проти пухлин людини, пересаджених безтимусним голим мишам (меланома, рак молочної залози, легенів, передміхурової залози та яєчників).
Адсорбція.У фармакокінетичних дослідженнях за участю пацієнтів із карциномоюin situсечового міхура зазвичай виявляють низькі рівні епірубіцину у плазмі крові після внутрішньоміхурової інстиляції (<10 нг/мл). Таким чином, не можна припустити існування значної системної резорбції. У пацієнтів із пошкодженнями слизової оболонки сечового міхура (наприклад у випадку пухлини, циститу, операції) можна очікувати вищушвидкість резорбції.
Розподіл.У пацієнтів з нормальною функцією печінки і нирок рівні у плазмі крові після внутрішньовенної ін’єкції 60−150 мг/м2 лікарського засобу демонстрували модель трьохекспоненціального зменшення з дуже швидкою першою фазою, повільною кінцевою фазою та середнім періодом напіввиведення приблизно 40 годин. Вказані дози знаходяться в межах фармакокінетичної лінійності як з точки зору значень кліренсу у плазмі крові, так і метаболічного шляху.
Біотрансформація.Основні ідентифіковані метаболіти – епірубіцинол (13‑ОН епірубіцин), а також глюкуроніди епірубіцину та епірубіцинолу.
4`‑O‑глюкуронідація відрізняє епірубіцин від доксорубіцину і може пояснювати швидшу елімінацію епірубіцину та його зменшену токсичність. Рівні основного метаболіту у плазмі крові, похідне 13‑ОН (епірубіцинол), відповідно нижчі і фактично паралельні рівням незміненої активної субстанції.
Виведення.Епірубіцин виводиться в основному печінкою; високі показники кліренсу у плазмі крові (0,9 л/хв) вказують, що така повільна елімінація відбувається завдяки великому розподілу в тканинах. Виведення із сечею через 48 годин становить приблизно 9−10 % введеної дози.
Екскреція через жовчні шляхи є головним шляхом елімінації, приблизно 40 % введеної дози виявляється у жовчі через 72 години. Активна субстанція не проникає крізь гематоенцефалічний бар’єр.
Лінійність/нелінійність.В інтервалі між 60 і 120 мг/м2 розташований великий діапазон фармакокінетичної лінійності, доза 150 мг/м2 розташована на межі лінійності дози.
Клінічні характеристики
Показання.
Епірубіцин застосовують для лікування ряду неопластичних станів, у тому числі:
- раку молочної залози;
- раку яєчників;
- раку шлунка;
- раку легенів;
- злоякісних лімфом;
- саркоми м’яких тканин;
- раку печінки;
- раку підшлункової залози;
- раку прямої кишки;
- раку шийно‑лицьової ділянки;
- лейкемії.
Показано, що епірубіцин при внутрішньоміхуровому введенні ефективний для лікування:
- папілярного перехідно‑клітинного раку сечового міхура;
- карциномиin situ сечового міхура;
- внутрішньоміхурової профілактики рецидивів поверхневої карциноми сечового міхура після трансуретральної резекції.
Протипоказання.
- Підвищена чутливість до епірубіцину або до будь‑якої допоміжної речовини препарату, до інших антрациклінів та антраценедіонів;
- період годування груддю.
Внутрішньовенне введення епірубіцину протипоказане при таких захворюваннях:
- персистуюча мієлосупресія внаслідок попередньої хіміо‑ або променевої терапії;
- активна депресія функції кісткового мозку внаслідок раніше проведених курсів лікування із застосуванням інших протипухлинних засобів або радіотерапії;
- тяжкі порушення функції печінки;
- кардіологічні захворювання, у тому числі в анамнезі (зокрема міокардіальна недостатність IV ступеня, гострий інфаркт міокарда або інфаркт міокарда в анамнезі, що спричинив міокардіальну недостатність III або IV ступеня, гострі запальні захворювання серця, аритмії зі серйозними гемодинамічними порушеннями);
- кардіоміопатія;
- нестабільна стенокардія;
- отримання раніше максимальної кумулятивної дози інших антрациклінів (наприклад, доксорубіцину або даунорубіцину);
- гострі системні (генералізовані) інфекції.
- тяжке запалення слизових оболонок ротової порожнини та/або шлунково-кишкового тракту.
Протипоказання для внутрішньоміхурового застосування:
- інфекції сечовивідних шляхів;
- інвазивні пухлини, що проникають у стінку сечового міхура;
- проблеми катетеризації (уретральна непрохідність, спричинена значним внутрішньоміхуровим новоутворенням);
- запалення сечового міхура;
- гематурія.
Внутрішньовенне введення
Епірубіцин Медак рекомендовано вводити, використовуючи крапельницю з безперервним потоком фізіологічного розчину. Для мінімізації ризику тромбозу або перивенної екстравазації інфузія має тривати від 3 до 20 хвилин, залежно від дози та об’єму інфузійного розчину. Пряма з натиском ін’єкція не рекомендована через ризик екстравазації, яка може виникнути навіть при адекватному кровонаповненні при аспірації голкою.
Внутрішньоміхурове введення
Розчин епірубіцину слід вводити за допомогою катетера, розчин повинен залишатися у сечовому міхурі протягом 1 години. Під час процедури пацієнтові необхідно періодично повертатися на бік, щоб слизова оболонка сечового міхура мала найбільший контакт із розчином. Для того, щоб уникнути розведення розчину сечею, пацієнт має утримуватися від вживання будь-якої рідини протягом 12 годин перед інстиляцією. Після завершення процедури хворому слід випорожнити сечовий міхур.
Спеціальні запобіжні заходи при обігу і знищенні.Епірубіцину гідрохлорид можна додатково розбавляти 5 % розчином глюкози або 0,9 % розчином натрію хлориду і вводити внутрішньовенно інфузійно.
Розчин для ін’єкцій не містить консервантів; невикористану порцію розчину з флакона необхідно негайно знищити відповідно до внутрішніх вимог установи.
Поради щодо безпечного обігу і знищення антинеопластичних засобів
1. Якщо необхідно приготувати розчин для інфузій, то його повинен готувати кваліфікований персонал в асептичних умовах.
2. Приготування розчину для інфузій слід здійснювати у спеціально призначеному асептичному приміщенні.
3. Слід вдягти відповідні захисні рукавички, захисні окуляри, халат і маску.
4. Необхідно бути обережними, щоб уникнути випадкового контакту лікарського засобу з очима. У разі контакту з очима промити очі великою кількістю води та/або 0,9 % розчину натрію хлориду, принаймні протягом 15 хвилин. Потім слід звернутися до лікаря.
5. У разі контакту зі шкірою ретельно промити уражену ділянку водою з милом або розчином натрію бікарбонату. Не терти шкіру щіткою. Після зняття рукавичок завжди слід мити руки.
6. При розбризкуванні або розливанні розчину епірубіцину, забруднене місце необхідно обробити розведеним розчином натрію гіпохлориту (містить 1 % хлору), бажано через відмочування даним розчином, а потім водою. Увесь використаний матеріал потрібно знищити, як описано нижче.
7. Вагітні жінки не повинні працювати з цитотоксичними лікарськими засобами.
8. Слід вживати відповідні запобіжні заходи при знищенні матеріалів (шприци, голки), які застосовували для розчинення та/або розбавлення цитотоксичних лікарських засобів. Будь-який невикористаний продукт або використаний матеріал повинен бути знищений відповідно до місцевих вимог щодо знищення цитотоксичних препаратів.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Епірубіцин застосовують в основному у комбінації з іншими цитотоксичними лікарськими засобами. Надзвичайно важливо ніколи не змішувати епірубіцин з цими препаратами в одному шприці.
Може розвинутися адитивна токсичність, особливо пов’язана з дією на кістковий мозок, травний тракт, також можливі гематологічні побічні ефекти.
Може збільшуватися потенційний ризик кардіотоксичності у пацієнтів, які одночасно одержують кардіотоксичні засоби (наприклад, 5‑фторурацил, циклофосфамід, цисплатин, таксани) або супутню (або попередню) променеву терапію медіастинальної ділянки перикарда. При застосуванні епірубіцину у комбінованій хіміотерапії з іншими потенційно кардіотоксичними лікарськими засобами, а також при одночасному застосуванні інших лікарських засобів, які можуть спричиняти серцеву недостатність (наприклад, блокатори кальцієвих каналів), необхідно контролювати функцію серця впродовж усього періоду лікування.
Епірубіцин в основному метаболізується печінкою. Будь‑який лікарський засіб, що впливає на функцію печінки, при одночасному застосуванні з епірубіцином може також впливати на метаболізм епірубіцину, його фармакокінетику, терапевтичну ефективність та/або токсичність.
Не слід застосовувати похідні антрацикліну, включаючи епірубіцин, у комбінації з іншими кардіотоксичними лікарськими засобами, якщо не проведено ретельний контроль функції серця пацієнта. Пацієнти, які одержують похідні антрацикліну після припинення лікування іншими кардіотоксичними лікарськими засобами, особливо такими, що мають тривалий період напіввиведення, наприклад трастузумабом, також знаходяться у зоні підвищеного ризику розвитку кардіотоксичності.
Повідомлялося, що період напіввиведення трастузумабу є змінним. Речовина може знаходитися у кровообігу до 7 місяців. Тому лікарям слід уникати терапії на основі антрациклінів протягом 7 місяців після припинення прийому трастузумабу, якщо це можливо. Якщо до цього часу використовуються антрацикліни, рекомендується ретельний моніторинг серцевої функції.
Потрібно уникати вакцинації живими вакцинами пацієнтів, які одержують епірубіцин. Це також стосується 6 місяців після припинення хіміотерапії. Можна вводити убиті або інактивовані вакцини, однак такі вакцини можуть бути менш ефективними. Під час лікування епірубіцином пацієнти також повинні уникати контактів з особами, які нещодавно вакцинувалися проти поліомієліту.
Введення дози циметидину призводило до 50% збільшення площі під кривою (АUС) епірубіцину, тому слід припинити прийом циметидину під час лікування епірубіцином. При введенні епірубіцину в дозі 100 мг/м2 кожні 3 тижні після терапії циметидином у дозі 400мг 2 рази на добу було відзначено збільшення на 50% AUC епірубіцину і збільшення на 41% AUC епірубіцинолу (показник р останнього ˂0,05). Оскільки не було виявлено змін AUC 7-дезоксидоксорубіцинолу аглікону і зниження печінкового кровотоку, зазначене явище не пояснюється зниженням активності ферментів системи цитохрому P450. Під час лікування епірубіцином слід припинити застосування циметидину.
При застосуванні паклітакселу до введення епірубіцину паклітаксел може спричиняти підвищення концентрації у плазмі крові незміненого епірубіцину і його метаболітів, останні є нетоксичними і неактивними.
Супутнє введення паклітакселу або доцетакселу не впливало на фармакокінетику епірубіцину при введенні епірубіцину перед застосуванням таксолу.
Дану комбінацію можна застосовувати при ступінчастому введенні двох лікарських засобів. Слід проводити інфузію епірубіцину і паклітакселу як мінімум з інтервалом у 24 години між застосуванням даних лікарських засобів.
У процесі одного з досліджень виявили, що доцетаксел може збільшувати концентрацію метаболітів епірубіцину в плазмі крові при його застосуванні відразу після введення епірубіцину. Верапаміл (рацемат) може змінювати фармакокінетику епірубіцину. Дексверапаміл (R - енантіомер) може посилити пригнічувальну дію на кістковий мозок. Хінін може прискорювати початковий розподіл епірубіцину з крові у тканини і може впливати на розподіл епірубіцину в еритроцитах.
Супутнє введення ά2b‑інтерферону може спричиняти скорочення термінального елімінаційного періоду напіввиведення і зменшення загального кліренсу епірубіцину.
Слід враховувати можливість вираженого порушення гемопоезу при (попередньому) лікуванні препаратами, що впливають на кістковий мозок (цитостатичні засоби, сульфонаміди, хлорамфенікол, дифенілгідантоїн, похідні амідопірину, антиретровірусні засоби).
Посилення мієлосупресії може статися у пацієнтів, які проходили комбіновану терапію антрацикліном і дексразоксаном.
Лікарські засоби, які уповільнюють виведення сечової кислоти (наприклад, сульфаніламіди, деякі діуретики), можуть призвести до посилення гіперурикемії при одночасному застосуванні епірубіцину. Епірубіцин зв’язується з гепарином; може виникнути осад і втрата ефективності обох засобів.
Особливості застосування.
Загальні відомості. Епірубіцин слід вводити тільки під наглядом компетентного лікаря, який має досвід застосування хіміотерапевтичних засобів. Необхідна наявність діагностичного устаткування та створення умов для лікування можливих ускладнень внаслідок мієлосупресії, особливо при високодозовій терапії епірубіцином.
Пацієнти повинні повністю вилікуватися від гострої токсичності (наприклад, стоматиту, мукозиту, нейтропенії, тромбоцитопенії та генералізованих інфекційних захворювань), що виникла у результаті попереднього лікування цитотоксичними засобами, до початку лікування епірубіцином. Лікування високими дозами епірубіцину (наприклад, >90 мг/м2 кожні 3‑4 тижні) спричиняє загалом такі ж побічні ефекти, які спостерігалися при введенні стандартних доз (<90 мг/м2 кожні 3‑4 тижні), може збільшитися ступінь тяжкості нейтропенії і стоматиту/мукозиту. Лікування високими дозами епірубіцину вимагає особливої уважності через можливі клінічні ускладнення, пов’язані з вираженою мієлосупресією.
Функція серця.Кардіотоксичність являє собою ризик, пов’язаний із лікуванням похідними антрацикліну, який може виявляти як ранні (тобто гострі), так і пізні (тобто сповільнені) порушення.
Ранні (гострі) порушення.Ранні прояви кардіотоксичності епірубіцину полягають в основному у розвитку синусової тахікардії та/або у змінах кривої електрокардіограми (ЕКГ), наприклад неспецифічні зміни S‑T сегмента T‑хвилі. Також зареєстровані повідомлення про випадки тахікардії, включаючи передчасне скорочення шлуночка, шлуночкову тахікардію і брадикардію, а також передсердно‑шлуночкову і міжшлуночкову блокаду. Дані ефекти зазвичай не є передумовою для подальшого розвитку уповільненої кардіотоксичності, вони рідко є клінічно значущими і зазвичай короткочасні та оборотні, їх не слід розглядати як показання для припинення лікування епірубіцином.
Пізні (уповільнені) порушення.Уповільнена кардіотоксичність зазвичай розвивається на завершальному етапі курсу лікування епірубіцином або через 2‑3 місяці після завершення терапії, також зареєстровані повідомлення про її пізніші прояви (через кілька місяців або років після завершення лікування). Уповільнена кардіоміопатія проявляється зменшенням фракції викиду лівого шлуночка (LVEF) та/або ознаками і симптомами застійної серцевої недостатності (ЗСН), наприклад задишка, набряк легенів, ортостатичний набряк, кардіомегалія і гепатомегалія, олігоурія, асцит, плевральний випіт і ритм галопу. ЗСН із загрозою для життя є найтяжчою формою кардіоміопатії, спричиненою похідними антрацикліну, і являє собою токсичність лікарського засобу, що обмежує кумулятивну дозу. Серцева недостатність, яка не піддається специфічному медикаментозному лікуванню, може розвиватися через декілька тижнів після припинення терапії епірубіцином.
Ризик розвитку ЗСН швидко збільшується зі збільшенням загальних кумулятивних доз епірубіцину, які перевищують 900 мг/м2; перевищувати подібну кумулятивну дозу слід з особливою обережністю.
Моніторинг функції серця. Перед початком і після закінчення кожного курсу терапії рекомендується проводити ЕКГ-дослідження. Такі зміни ЕКГ, як сплощення або інверсія зубця Т, депресія сегмента S-T або аритмії (зазвичай транзиторні та оборотні), не є підставою для припинення терапії препаратом.
Слід оцінювати функцію серця пацієнтів до початку лікування епірубіцином і ретельно її контролювати у процесі терапії з метою мінімізації ризику виникнення тяжкої серцевої недостатності.
Ризик тяжкої серцевої недостатності можна зменшити за допомогою регулярного моніторингу фракції викиду лівого шлуночка (LVEF) у процесі проведення курсу лікування зі швидким припиненням введення епірубіцину при перших ознаках порушення функції. Належним способом повторної оцінки функції серця є оцінка LVEF за допомогою багатоступінчатої радіоізотопної коронарографії (MUGA) або ехокардіографії (ЕхоКГ). Рекомендується базова оцінка функції серця за допомогою електрокардіографії і сканування MUGA або ЕхоКГ, особливо для пацієнтів із факторами ризику, що збільшують ймовірність кардіотоксичності. Слід проводити повторне визначення LVEF за допомогою MUGA або ЕхоКГ, особливо при застосуванні більш високих кумулятивних доз антрацикліну. Техніка, яку використовують для оцінки при подальшому спостереженні, повинна бути відповідною.
Кардіотоксичність у поєднанні з трастузумабом. Серцева недостатність (NYHA, клас II‑IV) спостерігається у пацієнтів, які застосовують як монотерапію трастузумаб або комбіновану терапію з антрациклінами, такими як епірубіцин. Вона може варіювати від помірної до тяжкої і може призвести до летального наслідку (ризик особливо підвищений у пацієнтів літнього віку).
Трастузумаб і антрацикліни, наприклад епірубіцин, не слід застосовувати у комбінації, якщо не проводиться ретельний контроль функції серця пацієнта під час добре контрольованих клінічних випробувань. Пацієнти, які раніше одержували антрацикліни, також знаходяться у зоні підвищеного ризику розвитку кардіотоксичності при застосуванні трастузумабу, хоча ризик менший, ніж при одночасному застосуванні трастузумабу й антрациклінів.
Повідомлялося, що період напіввиведення трастузумабу є змінним. Речовина може знаходитися у кровообігу до 7 місяців. Тому слід по можливості уникати терапії на основі антрациклінів протягом 7 місяців після припинення прийому трастузумабу. Якщо до цього часу використовуються антрацикліни, рекомендується ретельний моніторинг серцевої функції. У разі появи симптомів серцевої недостатності при застосуванні трастузумабу після лікування епірубіцином необхідно застосовувати стандартні препарати.
Враховуючи можливий ризик розвитку кардіоміопатії, при перевищенні кумулятивної дози епірубіцину 900 мг/м2 слід бути особливо обережним.
Кардіоміопатія, спричинена похідними антрацикліну, супроводжується постійним зменшенням напруженням інтервалу Q–R–S, пролонгацією понад нормальні межі систолічного інтервалу (фаза перед вигнанням PEP) і зменшенням фракції викиду (період вигнання з лівого шлуночка LVET). Зміни на ЕКГ можуть вказувати на кардіоміопатію, спричинену похідними антрацикліну, але ЕКГ не є чутливим або специфічним методом для виявлення кардіотоксичності, пов’язаної із застосуванням похідних антрацикліну.
Фактори ризику кардіотоксичності можуть спостерігатися у пацієнтів з активним або прихованим серцево‑судинним захворюванням, у пацієнтів, які одержували одночасно з епірубіцином променеву терапію або попередню променеву терапію ділянки середостіння/ділянки перикарда, у пацієнтів, які раніше одержували лікування іншими похідними антрацикліну або антрацендіону, а також при одночасному застосуванні інших лікарських засобів, здатних пригнічувати скорочувальну здатність серця, або кардіотоксичних лікарських засобів, наприклад трастузумабу (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
У підвищеній зоні ризику знаходяться пацієнти літнього віку.
У пацієнтів, які одержують високі кумулятивні дози препарату, а також у пацієнтів, які входять до групи факторів ризику, слід проводити особливо ретельний моніторинг функції серця. Однак кардіотоксичність, пов’язана з епірубіцином, може розвиватися і при нижчих кумулятивних дозах, незалежно від того, наявні чи відсутні фактори ризику.
Імовірно, токсичність епірубіцину та інших похідних антрацикліну або антрацендіону є адитивною.
Гематологічна токсичність.Як і інші цитотоксичні засоби, епірубіцин може спричиняти мієлосупресію. Гематологічний профіль слід оцінювати до початку лікування і в процесі кожного циклу лікування епірубіцином, включаючи диференціальний підрахунок лейкоцитів. Дозозалежна оборотна лейкопенія та/або гранулоцитопенія (нейтропенія) є переважним проявом гематологічної токсичності епірубіцину і являє собою найпоширеніший вид гострої токсичності даного лікарського засобу, що обмежує дозу. Зазвичай лейкопенія і нейтропенія виявляються у більш тяжкій формі при застосуванні високих доз, досягаючи у більшості випадків найнижчого рівня між 10‑м і 14‑м днями після введення даного лікарського засобу; вони зазвичай носять тимчасовий характер, причому рівень формених елементів крові у більшості випадків повертається до норми на 21‑й день. Також може спостерігатися тромбоцитопенія та анемія. Клінічні наслідки тяжкої мієлосупресії включають гарячку, інфекцію, сепсис/септицемію, септичний шок, крововилив, гіпоксію тканин або летальний наслідок.
Вторинний лейкоз.Вторинний лейкоз, із передлейкемічною фазою або без неї, зареєстрований у пацієнтів, які одержували похідні антрацикліну, включаючи епірубіцин. Вторинний лейкоз спостерігається частіше, якщо подібні лікарські засоби застосовувати у комбінації з антинеопластичними засобами, що руйнують ДНК, у комбінації з променевою терапією, якщо проводилося інтенсивне попереднє лікування пацієнтів цитотоксичними лікарськими засобами, або при підвищених дозах похідних антрацикліну.
Подібним видам лейкозу може передувати латентний період тривалістю від 1 до 3 років.
Реакції з боку шлунково‑кишкового тракту.Епірубіцин являє собою блювальний (еметогенний) засіб. Зазвичай після введення даного лікарського засобу розвивається мукозит/стоматит, у тяжкій формі він може прогресувати протягом кількох днів і призводити до утворення виразок на слизовій оболонці. Протягом 3‑го тижня лікування у більшості пацієнтів даний побічний ефект зникає.
Функція печінки.Гепатобіліарна система є основним шляхом виведення епірубіцину з організму. До початку терапії епірубіцином і в процесі лікування слід оцінювати загальні рівні білірубіну й оксалоацетаттрансамінази у сироватці крові. У пацієнтів з підвищеним рівнем білірубіну або оксалоацетаттрансамінази зі збільшенням загальної токсичності може спостерігатися зменшення кліренсу епірубіцину. Для таких пацієнтів рекомендується зменшення дози. Пацієнтам із порушеннями функції печінки не слід приймати епірубіцин.
Функція нирок.Слід регулярно перевіряти рівень креатиніну сироватки крові до початку і під час лікування. Для пацієнтів з підвищеним рівнем креатиніну сироватки крові (>5 мг/дл) необхідна корекція дози.
Реакції у місці введення.Флебосклероз може виникнути у результаті ін’єкції у судини невеликого розміру або повторних ін’єкцій в одну і ту ж вену. Дотримання рекомендованих методик введення сприяє мінімізації ризику розвитку флебіту/тромбофлебіту у місці ін’єкції.
Екстравазація.Екстравазація епірубіцину з вени у процесі ін’єкції може спричиняти місцеві больові відчуття, тяжкі пошкодження (утворення пухирів, виражений целюліт) і некроз тканини. При появі ознак або симптомів екстравазації під час внутрішньовенного введення епірубіцину слід негайно припинити інфузію даного лікарського засобу. Побічний ефект екстравазації можна попередити або зменшити за допомогою негайного застосування спеціальної терапії, наприклад дексразоксаном (див. відповідні інструкції до застосування). Біль пацієнта можна полегшити шляхом охолодження місця ін’єкції, підтримуючи охолоджений стан, застосовуючи гіалуронову кислоту і використовуючи місцево аплікацію диметилсульфоксиду. За станом пацієнта слід вести особливо ретельне спостереження і в подальшому, оскільки некроз тканин може розвиватися через кілька тижнів. Якщо відбувається екстравазація, необхідно проконсультуватися з пластичним хірургом щодо можливої резекції ураженої ділянки.
Інше.Як і у разі застосування інших цитотоксичних засобів, при застосуванні епірубіцину зареєстровані окремі випадки розвитку тромбофлебіту і тромбоемболії, включаючи легеневу емболію (у деяких випадках – летальну).
Епірубіцин може забарвлювати сечу в червоний колір протягом 1−2 днів після введення.
Синдром лізису пухлини.Епірубіцин може спричиняти гіперурикемію у результаті обширного катаболізму пуринів, що супроводжується швидким лізисом неопластичних клітин під впливом даного лікарського засобу (синдром лізису пухлини). Отже, у процесі лікування слід контролювати рівні сечової кислоти, калію, кальцію фосфату і креатиніну в крові. Гідратація, підлужнення сечі та профілактика алопуринолом для попередження гіперурикемії можуть мінімізувати потенційні ускладнення синдрому лізису пухлини.
Пригнічення імунітету/підвищена схильність до інфекцій.Введення живих або атенуйованих живих вакцин пацієнтам, у яких імунна система ослаблена хіміотерапевтичними засобами, включаючи епірубіцин, може призвести до тяжких або летальних інфекцій. Це також стосується 6 місяців після припинення хіміотерапії. Пацієнтам, які отримують епірубіцин, слід уникати вакцинації живими вакцинами. Можна застосовувати інактивовані або вбиті вакцини, але реакція на них може бути зменшена. . Слід уникати контактів з особами, які нещодавно щеплені проти поліомієліту.
Вплив на репродуктивну функцію.Епірубіцин може спричиняти пошкодження хромосом у сперматозоїдах людини (генотоксичний вплив). Пацієнтам‑чоловікам, які одержують епірубіцин, не рекомендується зачинати дитину під час лікування і протягом 6 місяців після припинення лікування; слід розглянути питання про консервацію сперми до початку лікування епірубіцином через вірогідність розвитку безпліддя після лікування епірубіцином. Чоловікам і жінкам, які приймають епірубіцин, необхідно застосовувати відповідні засоби контрацепції. Пацієнтам, які бажають мати дітей, після завершення лікування даним лікарським засобом слід, по можливості, розглянути питання про генетичну консультацію. Епірубіцин може спричиняти аменорею або передчасну менопаузу у жінок доклімактеричного віку.
Додаткові попередження і запобіжні засоби при інших способах введення
Внутрішньоміхурове введення.Введення епірубіцину може призводити до появи симптомів хімічного циститу (наприклад, дизурії, поліурії, ніктурії, странгурії, гематурії, розладу сечовипускання, некрозу стінки сечового міхура) і зморщування сечового міхура. Особливу увагу слід приділяти проблемам, пов’язаним із катетеризацією (наприклад, непрохідність уретри через внутрішньоміхурові пухлини великого розміру). Якщо є рефлюкс сечі з сечового міхура в ниркову миску (пухирно-нирковий рефлюкс), необхідний регулярний контроль функції нирок.
Внутрішньоартеріальне введення.Внутрішньоартеріальне введення епірубіцину (черезкатетерна емболізація артерії для місцевого або регіонарного лікування первинної злоякісної гепатоми або метастазів у печінці) може призводити (окрім системної токсичності, подібної до токсичності, що спостерігається після внутрішньовенного введення епірубіцину) до місцевої або регіонарної дії, включаючи виразки шлунка і дванадцятипалої кишки (імовірно, у результаті рефлюксу лікарських засобів до шлункової артерії), і звуження протоку жовчного міхура у результаті склерозуючого холангіту, спричиненого лікарським засобом. Даний спосіб введення може призводити до обширного некрозу перфузованої тканини.
Цей лікарський засіб містить 0,154 ммоль (або 3,54 мг) натрію на мілілітр розчину для ін’єкцій, що слід враховувати пацієнтам на дієті з контрольованим вмістом натрію.
Різні упаковки цього лікарського засобу містять такі кількості натрію:
Флакон 5 мл містить менше 1 ммоль натрію (23 мг), тобто, по суті, не містить натрію.
Флакон 10 мл містить 35,42 мг натрію, що еквівалентно 1,77 % рекомендованої ВООЗ максимальної добової дієтичної норми 2 г натрію для дорослої людини.
Флакон 25 мл містить 88,55 мг натрію, що еквівалентно 4,43 % рекомендованої ВООЗ максимальної добової дієтичної норми 2 г натрію для дорослої людини.
Флакон 50 мл містить 177,1 мг натрію, що еквівалентно 8,86 % рекомендованої ВООЗ максимальної добової дієтичної норми 2 г натрію для дорослої людини.
Флакон 100 мл містить 354,21 мг натрію, що відповідає 17,71 % рекомендованої ВООЗ максимальної добової дієтичної норми 2 г натрію для дорослої людини.
Застосування у період вагітності або годування груддю.
Вагітність.Перед початком лікування жінок репродуктивного віку слід виключити можливість вагітності, а протягом самого лікування жінки повинні користуватися ефективними методами контрацепції. Жінкам репродуктивного віку слід рекомендувати уникати вагітності під час лікування та до 6 місяців після лікування.
Експериментальні дані вказують на те, що введення епірубіцину вагітним самкам може завдати шкоди плоду. Жінок репродуктивного віку необхідно детально проінформувати про потенційний ризик для плода, також слід розглянути питання про можливість генетичної консультації, якщо під час лікування епірубіцином жінка завагітніла. При хіміотерапії онкологічних захворювань не слід призначати епірубіцин вагітним жінкам або жінкам репродуктивного віку, які можуть завагітніти, за винятком випадків, коли очікувана користь для матері переважає можливий ризик для плода. До теперішнього часу дослідження з участю вагітних жінок не проводили.
Період годування груддю.Показано, що епірубіцин проникає у молоко щурів. Невідомо, чи проникає епірубіцин у грудне молоко людини. Оскільки багато лікарських засобів, включаючи інші похідні антрацикліну, проникають у грудне молоко, а також через можливий розвиток серйозних побічних реакцій на епірубіцин при годуванні груддю, годування груддю слід припинити до початку лікування даним лікарським засобом.
Фертильність.Епірубіцин може спричинити пошкодження хромосом сперматозоїдів людини. Чоловіки, які отримують лікування епірубіцином, повинні використовувати ефективні засоби контрацепції і до 6 місяців після лікування і, якщо це доречно і можливо, звернутися за порадою щодо збереження сперми у зв’язку з можливістю необоротного безпліддя, спричиненого терапією.
Епірубіцин може спричинити аменорею і передчасне настання менопаузи у жінок.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Не зареєстровано повідомлень про системні побічні ефекти, пов’язані з впливом на здатність управляти машинами або механізмами. Епірубіцин може спричиняти напади нудоти і блювання, які можуть призводити до тимчасового порушення здатності управляти автомобілем або машинами чи механізмами.
Спосіб застосування та дози.
Дозування
З метою попередження кардіотоксичності препарату не слід перевищувати загальну кумулятивну дозу 900−1000 мг/м2 епірубіцину.
Стандартна доза. При застосуванні епірубіцину як монотерапії рекомендована доза для дорослих становить 60−90 мг/м2 площі поверхні тіла. Епірубіцин слід вводити внутрішньовенно протягом 3−5 хвилин. Введення слід повторювати після інтервалу в 21 день залежно від гематологічних показників пацієнта і функції кісткового мозку. Якщо спостерігаються ознаки токсичності, включаючи тяжку форму нейтропенії/нейтропенічної гарячки і тромбоцитопенії (які можуть зберігатися до 21‑го дня), може постати питання про перегляд дози або відстрочення введення подальшої дози.
Висока доза. Епірубіцин як засіб монотерапії для лікування раку легенів високими дозами слід вводити відповідно до таких схем:
- дрібноклітинний рак легенів (раніше не лікований): 120 мг/м2 1 день кожні 3 тижні;
- недрібноклітинний рак легенів (епідермоїдний, сквамозний та аденокарцинома) у пацієнтів, які раніше не отримували лікування: 135 мг/ м2 у 1‑й день або 45 мг/м² у 1‑й, 2‑й, 3‑й дні, повторення курсу – кожні 3 тижні.
При лікуванні високими дозами епірубіцин можна вводити як внутрішньовенний болюс протягом 3‑5 хвилин або у вигляді інфузії тривалістю до 30 хвилин.
Рак молочної залози.
При ад’ювантному лікуванні пацієнтів із раком молочної залози на ранній стадії рекомендується внутрішньовенне введення доз епірубіцину у межах від 100 мг/м2 (як одноразова доза в день 1) до 120 мг/м2 (дві роздільні дози в дні 1 і 8) кожні 3−4 тижні, у комбінації з внутрішньовенним введенням циклофосфаміду і 5‑фторурацилу та пероральним застосуванням тамоксифену. Курс повторювати з періодичністю у 3-4 тижні. При лікуванні високими дозами епірубіцину гідрохлорид вводити шляхом внутрішньовенних болюсних ін’єкцій тривалістю 3−5 хвилин або внутрішньовенних інфузій тривалістю до 30 хвилин.
Нижчі дози (60−75 мг/м2 для традиційного лікування і 105−120 мг/м2 для лікування високими дозами) рекомендують пацієнтам, у яких порушена функція кісткового мозку в результаті попередньої хіміотерапії або променевої терапії, залежно від віку або неопластичної інфільтрації кісткового мозку. Загальну дозу на цикл можна розділити на 2‑3 послідовні доби. Наступні дози епірубіцину зазвичай застосовують як монотерапію або у складі комбінованої хіміотерапії різних пухлин (див. таблицю 1).
Таблиця 1
Онкологічні показання | Доза епірубіцину (мг/м2)* | |
Монотерапія | Комбінована терапія | |
Рак яєчників | 60−90 | 50−100 |
Рак шлунка | 60−90 | 50 |
Рак сечового міхура | Внутрішньоміхурове введення 50 мг/50 мл або 80 мг/50 мл (карциномаin situ). Профілактика: 50 мг/50 мл на тиждень протягом 4 тижнів, потім кожного місяця протягом 11 місяців. | |
*Загальні дози, які застосовують першого дня або першого, другого та третього дня з інтервалом у 21 день.
Комбіноване лікування.Якщо епірубіцин застосовувати у комбінації з іншими цитотоксичними препаратами, дозу слід відповідно зменшити. Зазвичай застосовувані дози наведені у таблиці вище.
Лікування пацієнтів із порушеннями функції печінки.Основний шлях виведення епірубіцину з організму – переважно гепатобіліарна система. У пацієнтів із порушеннями функції печінки дозу слід зменшувати залежно від рівня білірубіну в сироватці крові, як вказано нижче:
Рівень білірубіну | Рівень глютамат‑оксалоацетат‑трансамінази (SGOT) у сироватці крові | Зменшення дози |
1,4‑3 мг/100 мл | більше ніж у 4 рази | 50 % |
>3 мг/100 мл | 75 % |
Загалом, якщо рівень білірубіну перебуває у діапазоні 1,4−3 мг/100 мл, а рівень затримки бромсульфофталеїну (БСФ) становить 9−15%, рекомендовано призначення половини звичайної дози. Якщо ж рівень білірубіну та рівень затримки БСФ перевищують вищезгадані, рекомендовано призначення чверті звичайної дози.
Помірне порушення функції нирок не є причиною для зміни рекомендованих доз через низький рівень екскреції епірубіцину нирками.
Порушення функції нирок.Ураження нирок середнього ступеня тяжкості не вимагає зменшення дози з точки зору обмеження кількості епірубіцину, що виводиться даним шляхом. Однак може знадобитися корекція дози для пацієнтів із рівнем креатиніну у сироватці крові >5 мг/дл.
Спосіб застосування.
Епірубіцин застосовувати тільки для внутрішньовенного або внутрішньоміхурового введення. Епірубіцин неефективний при пероральному прийомі,його не слід вводити внутрішньом’язово або інтратекально
Внутрішньовенне застосування.
Внутрішньовенне введення має тривати протягом 5−10 хвилин через систему для внутрішньовенних інфузій (необхідно переконатись, що голка правильно введена у вену), причому флакон із 0,9 % розчином натрію хлориду повинен вже бути встановлений. Ця техніка знижує ризик екстравазації препарату та забезпечує можливість промивання вени 0,9 % розчином натрію хлориду наприкінці введення препарату. Витікання епірубіцину з вени протягом введення може призвести до ураження тканин і навіть до некрозу. Венозний склероз може мати місце у результаті ін’єкції у тонкі судини або при повторних ін’єкціях в одну і ту саму вену. У разі екстравазації слід негайно припинити введення.
Внутрішньоміхурове введення.Епірубіцин можна вводити внутрішньоміхурово при лікуванні поверхневого раку сечового міхура і карциномиin situ. Не слід застосовувати даний препарат внутрішньоміхурово при лікуванні інвазійних пухлин, що проникають крізь стінку сечового міхура, у даних ситуаціях більш прийнятним є системне лікування або хірургічне втручання. Епірубіцин також успішно застосовують внутрішньоміхурово як профілактичний засіб після трансуретральної резекції поверхневих пухлин для попередження рецидивів. Для лікування поверхневої карциноми сечового міхура рекомендують наступну схему, використовуючи таблицю розведення (див. таблицю 2).
Інстиляції по 50 мг/50 мл щотижня протягом 8 тижнів (препарат розводять фізіологічним розчином або стерильною дистильованою водою). При прояві місцевих токсичних ефектів рекомендується зменшити дозу до 30 мг/50 мл.
Карциномаin situ: Інстиляції по 80 мг/50 мл (залежно від індивідуальної переносимості).
Профілактика: Інстиляції по 50 мг/50 мл щотижня протягом 4 тижнів, потім щомісячні інстиляції у тій самій дозі протягом 11 місяців.
Таблиця 2
Таблиця розведення для розчинів, які застосовують для інстиляції сечового міхура
Необхідна доза епірубіцину (мг) | Об’єм розчину епірубіцину для ін’єкцій 2 мг/мл (мл) | Об’єм розчинника (води для ін’єкцій або стерильного 0,9 % розчину натрію хлориду) (мл) | Загальний об’єм для інстиляції сечового міхура (мл) |
30 | 15 | 35 | 50 |
50 | 25 | 25 | 50 |
80 | 40 | 10 | 50 |
Розчин слід вводити внутрішньоміхурово протягом 1‑2 годин. Щоб уникнути невчасного розведення сечею, пацієнта необхідно проінструктувати про те, що йому не слід вживати рідину за 12 годин до інстиляції. У процесі інстиляції пацієнта необхідно час від часу перевертати, також його слід попередити про те, що слід спорожнити сечовий міхур після закінчення інстиляції.
Діти.
Дотепер не встановлена безпека та ефективність застосування епірубіцину дітям.
Передозування.
Гостре передозування епірубіцину може спричиняти тяжку мієлосупресію (протягом 10−14 днів, в основному лейкопенію і тромбоцитопенію), токсичну дію на травний тракт (в основному мукозит) і гострі серцеві ускладнення (протягом 24 годин). Спостерігається пізня серцева недостатність, пов’язана із застосуванням похідних антрацикліну, у період від кількох місяців до кількох років після завершення лікування.
Лікування.
При появі симптомів інтоксикації введення епірубіцину слід негайно припинити та розпочати симптоматичну терапію. У разі ураження серця необхідно звернутися до кардіолога. У разі вираженої мієлосупресії слід розглянути можливість заміщення компонентів крові, яких не вистачає та переведення хворого в стерильне приміщення. Специфічний антидот не відомий. За пацієнтами необхідно ретельно спостерігати.
Побічні реакції.
Понад 10% пацієнтів, які отримували лікування, можуть очікувати розвитку небажаних ефектів.
Найпоширенішими побічними ефектами є мієлосупресія, реакції з боку шлунково‑кишкового тракту, анорексія, алопеція, інфекційні захворювання.
Під час лікування епірубіцином спостерігали та повідомляли про наспупні небажані ефекти з наступною частотою.
Таблиця 3
Системи органів | Дуже поширені (1/10) | Поширені (≥1/100 – <1/10) | Непоширені (≥ 1/1000 – <1/100) | Рідко поширені (≥1/10000 – <1/1000) | Частота невідома (не може бути оцінена на основі доступних даних) |
Інфекції та інвазії | Інфекційні захворювання, кон’юнктивіт | Бактеріальний цистит § | Сепсис*, пневмонія* | Септичний шок, целюліт | |
Доброякісні, злоякісні новоутворення та утворення невідомої етіології (включаючи кісту і поліпи) | Гострий лімфолейкоз, лейкемія, гострий мієлолейкоз (див. розділ “Особливості застосуван-ня”) | ||||
З боку системи кровообігу та лімфатичної системи | Мієлосупресія (лейкопенія, гранулоцитопенія, нейтропенія, анемія, фебрильна нейтропенія, тромбоцитопенія) | ||||
З боку імунної системи | Анафілактичні реакції, включаючи шкірний висип, свербіж, лихоманку та озноб, алергічні реакції після внутрішньомі-хурового введення, гіперчутли-вість | Анафіліктичний шок | |||
З боку метаболізму та харчування | Втрата апетиту, дегідратація* | Гіперурикемія (див. розділ «Особливості застосування») | |||
З боку органів зору | Кератит | ||||
З боку серця | Кардіотоксичні ефекти (зміни ЕКГ, тахікардія, аритмія, кардіоміопатія), ЗСН (з такими проявами, як диспное, набряки, збільшення печінки, асцит, набряк легень, плевральний випіт, ритм галопу), шлуночкова тахікардія, брадикардія, атріовентрикулярна блокада, блокада пучка Гіса (див. розділ «Особливості застосуваня»). | ||||
З боку судинної системи | Припливи, флебіт* | Кровотеча*, Почервоніння* | Емболія, емболія судин, тромбофле-біт* | Шок*, флебосклероз, тромбоемболія | |
З боку дихальної системи, органів грудної клітки та середостіння | Легенева емболія* | Гіпоксія в результаті мієлосупресії | |||
З боку травної системи | Мукозит, стоматит, блювота, діарея, нудота, що може призвести до втрати апетиту та болю в животі | Езофагіт, шлунково-кишковий біль*, біль у животі, ерозія шлунково-кишкового тракту*, шлунково-кишкові кровотечі *, виразка шлунково-кишкового тракту*, ерозія слизової оболонки порожнини рота, біль у роті, відчуття печіння слизової |
| Пігментація ротової порожнини* | |
З боку шкіри та підшкірної клітковини | Алопеція, припинення росту бороди у чоловіків, токсичність для шкіри | Висип, свербіж, гіперпігментація нігтів *, шкірні розлади, гіперпігментація шкіри *, місцева токсичність тканин | Кропивянка*, еритема* | Фотосенсибілізація* | |
З боку нирок та сечовидільної системи | Хроматурія (червоне забарвлення сечі протягом 1-2 днів після прийому) | дізурія§, гематурія§, полакіурія§ | |||
З боку репродуктивної системи і молочних залоз | Аменорея | Азооспермія | |||
Загальні розлади та порушення у місці введення | Нездужання, Пірексія | Озноб *, еритема у місці інфузії | Астенія | Місцевий біль, паравенозне введення може спричинити некроз м’яких тканин | |
З боку нервової системи | Головний біль | Запаморочення | |||
Лабораторні показники | Зміни рівня трансаміназ | Безсимптомне зменшення фракції викиду лівого шлуночка | |||
Травми, отруєння та ускладнення процедур | Хімічний цистит, іноді геморагічний, спостерігався після внутрішньоміхурового введення (див. розділ «Особливості застосування») | Підвищена чутливість опроміненої шкіри (реакція побічних явищ променевої терапії) |
§ При внутрішньоміхуровому введенні.
*Побічні реакції зареєстровані у постмаркетинговий період.
Доброякісні, злоякісні новоутворення та утворення невідомої етіології (включаючи кісту і поліпи)
Вторинна гостра мієлоїдна лейкемія з попередньою лейкемічною фазою або без неї у пацієнтів, які одержують епірубіцин у комбінації з антинеопластичними засобами, що руйнують ДНК. Такі види лейкемії демонструють короткий період латентності (1−3 роки).
Розлади крові і лімфатичної системи.Високі дози епірубіцину безпечно вводили великій кількості пацієнтів, які не приймали лікарські засоби і мали різні солідні пухлини. Застосування високих доз призводило до виникнення побічних ефектів, які не відрізнялися від побічних ефектів при застосуванні традиційних доз, за винятком оборотної тяжкої нейтропенії (<500 нейтрофільних гранулоцитів/мм3 <7 днів), яка спостерігалася у більшості пацієнтів. Тільки для кількох пацієнтів виникла необхідність у госпіталізації і підтримуючій терапії внаслідок тяжких інфекційних ускладнень при застосуванні високих доз.
Розлади шкіри і підшкірних тканин.Алопеція, зазвичай оборотна, з’являється у 60−90 % випадків при лікуванні даним лікарським засобом, вона супроводжується відсутністю росту бороди у чоловіків.
Загальні розлади і реакції у місці введення.Через 5−10 днів після початку лікування може розвинутися мукозит, який зазвичай супроводжується стоматитом із болісними ділянками ерозій, утворенням виразок і кровотечею, в основному уздовж язика і сублінгвальної слизової оболонки. Можуть спостерігатися локальний біль і некроз тканини (після випадкової паравенозної ін’єкції).
Внутрішньоміхурове введення.Оскільки після внутрішньоміхурового введення реабсорбується тільки невелика кількість активної речовини, тяжкі системні побічні реакції, а також алергічні реакції на даний лікарський засіб зустрічаються рідко. Зазвичай спостерігаються місцеві реакції, такі як відчуття печіння і прискорене сечовипускання (полакіурія). Іноді спостерігається бактеріальний або хімічний цистит. Дані побічні реакції є в основному оборотними.
Звіти про небажані лікарські реакції.
Звіти про небажані лікарські реакції після реєстрації лікарського засобу дуже важливі. Вони дозволяють продовжувати моніторинг балансу користь/ризик лікарського засобу. У випадку виникнення будь‑яких лікарських реакцій слід повідомити працівників охорони здоров’я.
Термін придатності.2,5 роки.
Умови зберігання.
Зберігати в холодильнику (2−8°С). Зберігати в недоступному для дітей місці. Зберігати флакон у картонній коробці в захищеному від світла місці.
Умови зберігання після розведення. При застосуванні розчин препарату можна додатково розбавляти в асептичних умовах 5 % розчином глюкози або 0,9 % розчином натрію хлориду і вводити внутрішньовенно інфузійно. Хімічна і фізична стабільність розведеного розчину продемонстрована протягом 48 годин в умовах зберігання при 25 °С в захищеному від світла місці.
Однак з мікробіологічної точки зору даний розчин слід використати негайно. Якщо його не використати негайно, то споживач відповідає за тривалість зберігання при застосуванні і умови застосування, що зазвичай не повинно становити більше 24 годин при 2−8°С, якщо тільки розведення не виконують у контрольованих і валідованих асептичних умовах.
Несумісність.
Слід уникати тривалого контакту даного лікарського засобу з розчинами із лужним значенням pH (включаючи розчини натрію бікарбонату), оскільки подібний контакт буде призводити до гідролізу (розкладу) активної речовини. Необхідно застосовувати як розчинники тільки 5 % розчин глюкози або 0,9 % розчин натрію хлориду.
Зареєстровані повідомлення про фізичну несумісність даного лікарського засобу з гепарином. Не слід змішувати епірубіцин з гепарином. Даний лікарський засіб не можна змішувати з іншими лікарськими засобами в одному шприці, окрім описаних вище.
Упаковка.
Епірубіцин медак 10 мг/5 мл у прозорому скляному флаконі місткістю 5 мл. По 1 флакону у картонній коробці.
Епірубіцин медак 20 мг/10 мл у прозорому скляному флаконі місткістю 10 мл. По 1 флакону у картонній коробці.
Епірубіцин медак 50 мг/25 мл у прозорому скляному флаконі місткістю 25 мл. По 1 флакону у картонній коробці.
Епірубіцин медак 100 мг/50 мл у прозорому скляному флаконі місткістю 50 мл. По 1 флакону у картонній коробці.
Епірубіцин медак 200 мг/100 мл у прозорому скляному флаконі місткістю 100 мл. По 1 флакону у картонній коробці.
Категорія відпуску.За рецептом.
Виробник.Медак Гезельшафт фюр клініше Шпеціальпрепарате мбХ.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Театерштрассе, 6, 22880 Ведель, Німеччина.

На сайті наведено виключно офіційні оновлені інструкції без перекладів та скорочень.
Інформація про лікарські засоби представлена на сайті для ознайомлення, не є приводом для самолікування та не є рекламою лікарських засобів.
 Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Важливо! До кожного лікарського засобу, який ви купуєте, обов’язково має додаватися інструкція про застосування лікарського засобу.
Тримайте всі інструкції до препаратів Домашньої аптечки під рукою – завантажуйте мобільний додаток Ліки Контроль БЕЗКОШТОВНО



